母婴分离模型的常见行为范式评价及研究进展
2020-06-24张献强孙浩然孙延超高卫星张希妹李长江
张献强,孙浩然,孙延超,高卫星,张希妹,李长江*
(1.心理学系教研室,潍坊医学院,山东 潍坊 261052; 2.临床医学院,潍坊医学院,山东 潍坊 261053;3.精神心理科,陆军第八十集团军医院,山东 潍坊 261021)
分离焦虑是指个体与其依恋对象分离,或与其家庭分离相关的过度焦虑和发展方面的不适[1]。作为重要的早期社会剥夺现象,母婴分离(maternal separation,MS)是指发生在出生后至断乳前的年幼个体与其依恋对象的分离[2],这种早期应激方式会导致持久的大脑结构改变,影响神经网络及功能,并增加个体成年后甚至更早发生精神障碍的风险[3]。 本文通过对MS 模型大、小鼠不同行为范式的综述,揭示生命早期应激对个体行为学及大脑生物学机制的影响,有助于选择对生命早期应激的更加科学的干预策略,避免其对个体身心健康所造成损害,对儿童生理及心理发展有重要意义[4]。
1 母婴分离模型的建立
新生动物断奶前(出生后1 ~21 d)的早期社会环境剥夺包括早期干预(early handling,EH)以及MS 两种方式。 EH 是指每天将母鼠与子鼠短暂地分离3~15 min;而MS 则是将母鼠与子鼠长时间地分开(1~24 h)[5]。 MS 模型构建方法多样,其主要区别在于MS 的频率和持续时间,并且不同的分离频率与每次分离的持续时间产生的实验效果也存在明显差异。 MS 的主要方式有两种,即动物出生后(postnatal day,PND)1~21 d 中的某一天(一般为第9 天)进行24 h 的MS,和连续1~3 周对新生动物每天进行一段时间(3~6 h)的MS[6-7]。 母婴分离应激在豚鼠和鸟类中都有研究,但在大鼠和小鼠动物模型中的应用较为广泛[7]。
MS 动物模型中,母鼠是构成其子代幼鼠个体社会环境的重要组成部分,为幼鼠提供了营养、热量、躯体感觉、运动觉、嗅觉及听觉刺激等重要资源[8]。 一般认为,EH 分离时间较短,等同于正常情况下母亲离巢觅食等行为的时间,因此并不构成严重的剥夺;而MS 的分离时间较长,可以代表一种严重的环境剥夺[9]。 同时,MS 可使个体前脉冲抑制减弱,产生分离焦虑,出现抑郁样行为[10]及认知功能损伤。 通过MS 这种方式干扰大鼠早期生活环境,会对大鼠的神经功能及行为产生持久的影响,因此常被用作生命早期应激模型[11]。
2 MS 动物模型前脉冲抑制范式及其生物学机制
2.1 MS 动物模型的前脉冲抑制
惊反射是人与动物对于威胁刺激的一种迅速反应,对适应环境有重要意义,但对动物的认知和行为活动产生一定的干扰作用,中枢神经系统能够抑制惊反射以减少其对认知和行为的干扰。 惊反射的前脉冲抑制(pre-pulse inhibitation,PPI)是指在强的惊反射刺激之前的一定时间内,给予弱感觉刺激对惊反射产生抑制作用,这种作用可以降低强脉冲刺激所引发的反应,是对脑内信息加工过程的一种保护机制[12]。 Ellenbroek 等[13]研究认为MS 对PPI 的影响具有延迟效应,即MS 雄性或雌性Wistar大鼠均表现出PPI 的显著降低。 还有研究发现[14],出生后MS(PND9,24 h)对Wistar 大鼠PPI 的影响较小,而出生后MS(PND9,12 h/d;PND11,12 h/d)的Wistar 大鼠PPI 受到了严重影响,即惊反射的前脉冲抑制减弱,更易产生惊反射。 提示MS 分离频率越高,对个体的行为及神经发育产生的影响越大。
2.2 MS 动物模型的前脉冲抑制的生物学机制
Long-Evans 大鼠早期的MS 会极大地增加后代对多巴胺兴奋剂的敏感性而减少对多巴胺拮抗剂的敏感性[15]。 研究表明,MS(PND9,24 h)对PPI 有明显的损害效果。 给予多巴胺受体激动剂可破环PPI[16], 这一作用可能是由伏隔核( nucleus accumbens,NAcc)的多巴胺D2 受体介导的。 NAcc接受来自内侧前额叶(medial prefrontal cortex,mPFC)等脑区的谷氨酸能纤维投射,是整合感觉信息和产生运动的交接脑区[17]。 MS 的Wistar 大鼠NAcc 内多巴胺代谢产物高香草酸水平显著高于对照组[18]。 有研究将多巴胺D2 受体激动剂喹吡罗或多巴胺注入NAcc 导致PPI 降低,而当给予多巴胺D2 受体拮抗剂后PPI 的降低效应消失[19]。 另外,如果人为提高NAcc 多巴胺受体的敏感性,原本对PPI 作用较弱的低剂量阿扑吗啡也能显著地减弱PPI。 也有报道称D4 受体拮抗剂NGD94-1 可以逆转阿扑吗啡导致的PPI 降低,显然多巴胺受体的各亚型所起的作用是不同的。 并且,在NAcc 的核心区和外周区注入谷氨酸能受体激动剂AMPA 都能减弱PPI,NAcc 可能是通过谷氨酸能和多巴胺能系统的相互作用共同调节PPI[20],但其具体机制还有待进一步探讨。
此外,Fijal 等[21]研究发现抗精神病药改善PPI的机制中,5-羟色胺(5-hydroxytryptamine,5-HT)受体也参与了部分作用。 也有研究表明全身应用5-HT 释放剂或部分受体兴奋剂可以使Sprague-Dawley(SD)大鼠的PPI 降低[19]。
3 MS 动物模型焦虑样抑郁样行为及其生物学机制
3.1 MS 动物模型的焦虑样与抑郁样行为
MS 焦虑样与抑郁样行为可运用旷场实验(open field test,OFT)、高架十字迷宫实验(elevated plus maze,EPM)、强迫游泳实验(forced swimming test,FST)、糖水偏好实验(sucrose preference test,SPT)等进行评价。
3.1.1 旷场实验
旷场实验是通过观察并记录实验动物在新异环境中的自发活动行为而对其焦虑水平进行评价的一种行为学范式。 研究表明MS(PND3 ~14,3 h/d)可显著增加成年期Wistar 大鼠在旷场测试中的自发运动水平[22],然而,也有研究发现经历MS(PND1~14,3 h/d)的雄性C57BL/6 小鼠进入旷场的中央区域的时间显著减少,相同处理下的雌性小鼠也表现出类似的结果[23]。 这说明在相同的MS处理条件下,子代大、小鼠在旷场中的焦虑水平可能因实验动物品种的差异而产生不同的结果。
3.1.2 高架十字迷宫实验
高架十字迷宫实验也是利用动物对新异环境的探究和对高架开放臂的恐惧来评估动物焦虑水平的行为学范式。 研究发现,与对照组相比,经历MS(PND1 ~21,4.5 h/d)的Wistar 大鼠在开放臂的停留时间显著降低,表现出更为明显的焦虑情绪[24]。 此外,MS(PND1 ~14,3 h/d)处理后的雄性C57BL/6 小鼠进入开放臂与进入所有臂的次数之比明显低于正常雄鼠,表现为焦虑水平的提高,而雌性C57BL/6 小鼠在EPM 测试中则不受母婴分离的影响[23],这说明性别差异可能在MS 诱发的焦虑障碍等疾病中发挥着重要的调控作用。
3.1.3 强迫游泳实验
强迫游泳实验最早由法国学者Porsolt 等[25]提出,用于大、小鼠等实验动物抑郁样行为的研究,常用不动时间的变化作为检测指标。 Paternain 等[10]研究发现,经历MS(PND2 ~21,3 h/d)后的成年Wistar 大鼠,静止不动行为时间显著高于对照组。而另一项研究发现MS(PND2 ~14,3 h/d)对SD 大鼠的不动时间没有影响[26],这些研究结果的不同或许与大鼠的品系以及母婴分离的频率和时程有关。
3.1.4 糖水偏好实验
糖水偏好实验是通过计算糖水偏好百分比(糖水偏好百分比=糖水消耗量/总体消耗量×100%)来检测快感缺乏的一种行为范式[27]。 有研究表明,与对照组的Wistar 大鼠相比,经历MS(PND2 ~21,3 h/d)处理的Wistar 大鼠糖水偏好百分比显著下降,出现快感缺乏的症状,而MS 后的Wistar 大鼠与对照组在总体水的摄取量上没有差异[28]。 这些动物实验结果表明MS 处理能够诱发大鼠产生显著的抑郁样行为,并且不同的分离方式和动物品系可能产生不同的实验结果。
3.2 MS 动物模型的焦虑与抑郁样行为的生物学机制
大量的前期研究已证实,实验动物的焦虑、抑郁样行为可能与下丘脑- 垂体- 肾上腺(hypothalamic-pituitary-adrenal,HPA)轴的功能失调密切相关[29]。 经历MS(PND2~14,3 h/d)的成年期Wistar 大鼠在出现焦虑、抑郁样行为的同时,HPA轴功能亢进,表现为肾上腺皮质激素(Adrenal cortical hormone,ACTH)和皮质酮(Corticosterone,CORT)浓度显著升高[26-28]。
此外,炎性细胞因子在MS 引发的焦虑、抑郁样行为中也发挥着重要作用[30]。 MS 处理能增加炎性细胞因子IL-1β 在腹侧海马、PFC 及血清中的表达,同时降低腹侧海马IL-10 的表达水平,并且该现象能被逆转并改善焦虑抑郁样行为。 近期研究显示,抑制元素-1 沉默转录因子(Repressor element-1 silencing transcription factor,REST)能通过与抑制元素-1 特异性结合,调控受MS 影响的促肾上腺皮质激素释放激素(Corticotropin releasing hormone,CRH)的表达水平。 研究表明,MS(PND2 ~14,3 h/d)增加了REST4 蛋白质及mRNA 的含量,并在经历MS 的SD 大鼠mPFC 中发现了REST4 的瞬时过度表达[26]。 综上,HPA 轴的失调以及炎性细胞因子可能与焦虑、抑郁样行为的产生有密切联系,同时REST 对相关激素的调节功能或许在动物应激行为的恢复过程中发挥着关键作用。
4 MS 动物模型认知、学习记忆障碍及其生物学机制
4.1 MS 动物模型的认知与学习记忆能力
目前有多种实验被用来评价大脑认知和学习记忆能力的改变。 其中认知记忆的改变常用新颖物体识别测试(object recognition test)来评价,Morris水迷宫(Morris water maze)和T 迷宫(T-maze)通常用来检测模型动物空间记忆能力的改变,而与恐惧相关的学习记忆能力的变化则通过条件性恐惧记忆测试来检测。
4.1.1 新颖物体识别测试
新颖物体识别测试利用动物先天对新物体的探究倾向并通过动物对熟悉与新鲜刺激的鉴别来检测实验动物认知记忆的改变。 该项试验对研究记忆的获得、巩固与再巩固有重要意义[31]。 在一项不同母婴分离时间对Wistar 大鼠不同发育阶段影响的研究显示,不同类型的MS 会产生不同程度的认知损伤。 研究发现,MS(PND1~10,4 h/d)会导致青春期的Wistar 大鼠目标识别损伤;而MS(PND1 ~21,4 h/d)则会将这种损伤一直持续到成年期[32]。
青春期前食物中的胆碱水平也会引发成年期大鼠认知行为的改变,摄入少于需求量胆碱的Wistar 大鼠在经历MS(PND1 ~14,3 h/d)后表现出对新颖物体识别的能力降低,摄取的食物中含有超量胆碱的MS 大鼠对新物体的识别能力显著高于机会水平;而对照组中只有无胆碱摄入组对新物体的识别能力低于机会水平[33]。 以上结果为胆碱能够恢复由母婴分离所引起的认知功能障碍提供了新依据。
4.1.2 Morris 水迷宫
Morris 水迷宫通过强迫实验动物游泳,学习寻找隐藏在水中的平台来检测其空间记忆能力。 结果显示[34-35],MS(PND1 ~10,3 h/d;PND2 ~14,3 h/d)与MS(PND1~14,6 h/d)均造成了成年SD 大鼠空间学习记忆能力的下降。 而在Tata 等人的研究显示,虽然MS(PND1 ~6,3 h/d)也明显降低了Wistar 大鼠的空间记忆能力,但MS(PND1 ~6,15 min/d)并未影响Wistar 大鼠的空间记忆能力。 这提示MS 的持续时间可能是影响大鼠的空间记忆能力的关键因素之一。 且有研究显示,随着MS 每天分离时间的增强,大鼠空间记忆能力的损伤也在不断增大[36]。 此外,在Morris 水迷宫的反向测试实验中,MS 处理损伤了SD 大鼠获取新的学习记忆的能力[12],导致青春期和成年初期的Wistar 子鼠反向学习能力下降[22]。 这些结果表明子代大鼠的学习和记忆能力均受到MS 的影响,存在一定的记忆功能损伤。
然而,目前的研究所采用的不同的MS 处理方式对实验的结果及影响仍存在较大争议,不同的实验数据显示MS 的频率和持续时间与大鼠的学习记忆能力之间可能存在交互作用,而这两种影响因素对大鼠的学习记忆能力、反向学习能力之间的具体关系,还需要进一步的研究探索和验证。
4.1.3 条件性恐惧记忆测试
条件性恐惧记忆作为一种独特的记忆形式,是通过将动物的一个厌恶事件(通常是足部电击)与一个中性刺激条件(例如环境、灯光或声音)结合在一起,并在再次经历中性刺激条件时诱发条件反射,通过测试再次经历刺激时一定时间内动物的僵住时间来判断恐惧相关记忆的形成[37-38]。 Chocyk等[39]通过研究发现,MS(PND1 ~14,3 h/d)后的Wistar 大鼠在青春期会表现出环境相关和听觉相关恐惧条件反射的降低。 同时,另一项研究显示,经历MS(PND1~21,6 h/d)的雌性Wistar 大鼠在成年后恐惧记忆测试中表现为僵住时间的降低[40]。 这表示MS 可能对不同成长阶段的大鼠恐惧条件反射的建立均能造成影响。
4.2 MS 动物模型的认知与学习记忆障碍的生的学机制
海马区神经细胞对糖皮质激素(glucocorticoid,GC)的脆弱性被认为是影响认知功能的最重要机制之一。 海马体具有高密度的糖皮质激素受体(glucocorticoid receptor,GR),在调节HPA 轴中发挥重要的作用。 Sapolsky 等[33]提出的糖皮质激素级联假说认为,高水平的GC 会导致海马体的神经元缺失,进而导致GR 的减少。 由于GR 在GC 的负反馈中起作用,它的丢失可能导致GC 水平的增加。因此,早期MS 与海马体中CRH 的表达和记忆损伤有很强的联系。 此外,鼻周皮层的改变同样可能是引起认知损伤的原因之一。 鼻周皮层是一个高级联合区域,其中某些神经细胞对熟悉物体的反应性较低。 这种认知缺乏产生原因的一种解释是,MS会导致乙酰胆碱酯酶的增加,而当使用乙酰胆碱酯酶抑制剂如加兰他敏时,这种认知损伤可以被逆转[32]。 因此,鼻周皮层乙酰胆碱酯酶的调控可能是治疗母婴分离导致的认知损伤的重要靶点。
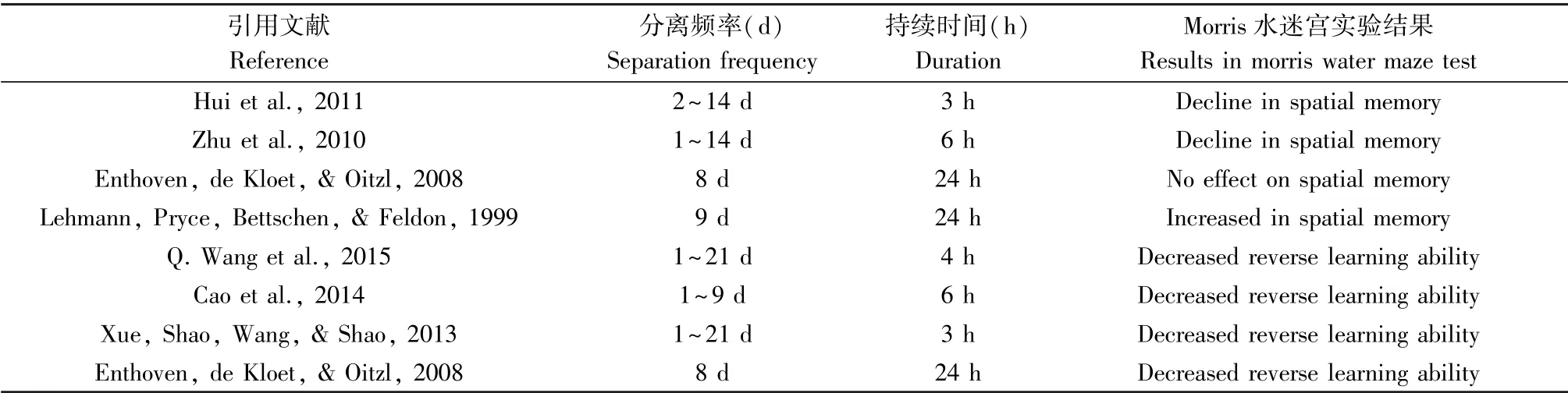
表1 各文献中MS 方式与Morris 水迷宫实验结果比较Table 1 Comparison of maternal separation methods and experimental results using the Morris water maze in the literature
脑源性神经营养因子 ( brain-derived neurotrophic factor,BDNF)广泛分布于中枢神经系统及周围神经系统,尤其在海马中的表达水平最高。BDNF 对学习相关的突触可塑性和长期记忆的维持至关重要[41]。 研究表明[39]MS(PND10 ~15,3 h/d)处理的Wistar 子鼠海马内BDNF 的mRNA 在第16天时降低,但在第30 天和第60 天却显著增加。Roceri 等[42]在研究中发现,经历MS(PND2 ~14,3 h/d)的SD 大鼠在出生后第17 天海马内BDNF mRNA 以及BDNF 蛋白质水平显著升高,但在第35天和第90 天与对照组无显著性差异。 而Shu 等[43]研究显示,受MS(PND2~14,3 h/d)的影响,成年期MS 的SD 大鼠海马内BDNF 的表达显著低于对照组。 这些不同的研究结果表明,作为大脑代偿机制的一部分,在经历过MS 刺激后,BDNF 的表达会在一个短暂时间的降低后出现明显的上调,而在分离后期则会趋向一个相对稳定的水平。 目前,BDNF这种相对稳定的表达水平与MS 实验条件的关系尚不明确,个体在经历MS 后海马内BDNF 的具体变化过程也需要进一步研究。
5 结 论
MS 作为一种早期社会剥夺方式,可用于早期生命应激研究的动物模型的建立。 该模型在动物行为学实验及生理学实验研究中表现出较好的应用前景。 但MS 建模方式中分离频率和持续时间之间的交互作用对实验结果的影响尚未完全明确。同时,大部分对相关分子机制的研究仅仅只是呈现某一年龄阶段的结果,较少有研究对MS 导致的相关分子变化的连续检测来反映其在MS 的影响下一个持续反应变化的过程。 随着表观遗传学的不断发展,表观遗传修饰在早期的生活经验中通过改变某些神经元基因的表达水平,从而控制学习和记忆的相关机制已经成为一个新的研究热点。 因此,在今后的研究中,针对分离方式的深入研究及分析,以及对相关分子的持续性变化过程的检测和相应的表观遗传修饰的研究是有必要的。 本文对大、小鼠中母婴分离常见的行为学范式及相关生物学机制的研究成果进行了综述,阐明MS 应用于早期生命应激研究中建模以及行为学实验的可行性与广泛适用性,为今后采用该模型进行深入研究提供一定的理论基础及实验指导。 另一方面,我们还需更严格地控制实验条件,进而为应激损伤的治疗研究奠定基础,这对提高其社会实用价值具有重要意义。
