miRNA-144 基因过表达对肝癌小鼠的抑瘤作用及对肠道菌群的影响
2020-06-24许达峰周开伦武金才丁驿超古海强谢明微刘向梅
王 雨,许达峰,周开伦,武金才,丁驿超,古海强,谢明微,刘向梅
(海南省人民医院肝胆胰外科,海口 570031)
原发性肝癌是临床最常见的恶性肿瘤之一,病死率仅次于肺癌,居于第2 位,其发病率逐年增长[1]。 肝硬化时,肠黏膜通透性增高与肠道细菌移位及肠源性内毒素血症密切相关,进而增加细胞癌变风险,肝硬化、肝癌患者存在肠道细菌紊乱的情况[2]。 肿瘤的侵袭、转移受多基因调控影响,目前肿瘤的基因治疗已成为医学研究的热点[3]。 研究表明[4-6],微小RNA-144(microRNA-144,miRNA-144)是与肿瘤密切相关的miRNA,在食管癌、甲状腺癌、大肠癌组织中均有异常表达,且参与细胞发育分化过程中蛋白与基因的合成环节。 杨锐[7]认为,miRNA-144 在胆管癌组织和胆管癌细胞系中的表达降低,推测miRNA-144 可抑制肝癌细胞的增殖、迁移和侵袭。 目前,关于miRNA-144 与恶性肿瘤的相关性研究较多,但关于其对肝癌及肠道菌群影响的研究尚少。 本研究对miRNA-144 基因过表达对肝癌小鼠的抑瘤作用及对肠道菌群的影响进行探讨,旨在为肝癌的基因治疗及肠道功能紊乱的防治提供参考。
1 材料和方法
1.1 实验动物
SPF 级C57BL/6J 雄鼠,4 周龄,43 只,体重20~22 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011],饲养于海南医学院动物实验中心[SYXK(京)2017-0033]。 自由进水饮食,温度维持在23℃~25℃,相对湿度50%~60%,12 h/12 h 明暗交替安静环境下适应性饲养1 周,实验研究过程做到了减少、替代、优化的3R 原则,动物实验开展前获得实验动物伦理委员会审批(IACUC-20180509-44)。
1.2 主要试剂与仪器
腹水型肝癌H22 细胞株(中国科学院上海细胞库);miRNA-144 高表达慢病毒颗粒(上海吉满生物科技有限公司);BCA 蛋白定量试剂盒(上海研谨生物科技有限公司);DAB 显色试剂(北京索莱宝科技有限公司);紧密链接跨膜蛋白(occludin)、闭锁小带蛋白-1(zonula occluden-1,ZO-1)多克隆抗体(美国Santa Cruz 公司);SP 免疫组化试剂盒、苏木素-伊红(hematoxylin and eosin HE)染色试剂盒、双歧杆菌、乳酸杆菌、大肠杆菌、肠球菌选择性培养基(广东环凯微生物科技有限公司);粪便QIAamp® DNA Stool Mini Kit(德国Qiagen 公司);实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪、全段酶标仪(美国Bio-Rad 公司);石蜡切片机(德国SLEE 公司);光学显微镜(日本Olympus 公司)。
1.3 实验方法
1.3.1 制备移植性腹水型肝癌
取33 只小鼠,腹水型肝癌H22 细胞株复苏,体外培养传代至对数生长期,1 000 r/min 离心5 min,PBS 缓冲液清洗2 次,取中上层细胞,生理盐水4 倍稀释,每只小鼠右前腋下无菌皮下接种0.2 mL,接种完成后正常饲养2 周。 定期以游标卡尺测量小鼠腋下瘤块长短径,待肿瘤最长径为0.8 ~1 cm 时为造模成功,进行实验干预。
1.3.2 实验分组及干预
选取建模成功小鼠30 只,随机分为模型组、空载组和过表达组,每组10 只,另选取10 只健康对照小鼠为对照组。 建模成功小鼠于建模后24 h进行尾静脉注射,空载组小鼠注射空载体慢病毒液0.1 mL,过表达组注射miRNA-144 高表达慢病毒液0.1 mL,对照组与模型组小鼠于同时间注射生理盐水0.1 mL,注射完毕后继续饲养3 d,期间观察记录小鼠的精神状况、毛色变化、进食量、体重及排便情况。
1.3.3 组织取材及粪便采集
各组小鼠在干预结束后24 h 脱颈处死,观察肿瘤形成情况,剥离肿瘤组织,称量模型组、过表达组瘤重,计算抑瘤率,并取正常肝组织、肝癌组织及结肠组织,储存于-80℃冰箱备用。 抑瘤率=[模型组平均瘤重(g)-过表达组平均瘤重(g)]/模型组平均瘤重(g)×100%。 无菌收集小鼠处死前48 h 内新鲜直肠粪便(≥200 mg),迅速装入无菌冻存管中储存于-80℃冰箱备用。
1.3.4 组织病理学观察
取小鼠肝及结肠组织标本,PBS 溶液冲洗干净,4%多聚甲醛溶液固定,常规石蜡包埋,制成4 μm 厚切片,常规HE 染色,于光学显微镜下观察肝组织及结肠组织病理变化。
1.3.5 盲肠内容物菌群丰度及多样性检测
按照粪便DNA 基因组提取试剂盒说明提取样本基因组DNA,进行细菌PCR 扩增,通用引物forward primer(5’-3’)序列:ATGCTCGACTGTAGCT AGTG-3(F341)reverse primer(5’-3’);GCTCGAT CGCATCGATATCG(R806),扩增细菌核糖体RNA基因V3~V4 区,得到500 bp 左右片段。 PCR 反应条件:95℃预变性3 min;98℃变性25 s,58℃退火15 s,72℃延伸20 s,重复30 个循环,72℃延伸5 min。应用Illumina Misq 技术对PCR 产物进行高通量测序,根据97%相似度进行操作分类单元(operational taxonomic units,OUT)聚类,应用软件MEGAN 分析计算菌群多样性(shannon)指数和丰富度(chao)指数。
1.3.6 肠道屏障功能及及细菌异位率检测
于小鼠处死前收集眼眶静脉丛血样,静置分层后离心收集上层血清,检测血清二胺氧化酶(diamine oxidase,DAO)、内毒素水平(分光光度计法),读取酶标仪436 nm 处吸光光密度(optical density,OD)值。 无菌获取小鼠肠系膜淋巴结、腹腔灌洗液及肝、肾、脾、肺,分别将其置于增菌液中,需氧条件下培养24 h,涂片鉴定增菌培养阳性标本,将出现大肠杆菌或类杆菌者记为阳性,计算细菌异位率,细菌异位率=阳性器官个数/(小鼠个数×5)×100%。
1.3.7 结肠组织Occludin、ZO-1、miRNA-144 mRNA相对表达量鉴定
取模型组、空载组、过表达组癌组织及各组结肠组织80 mg,TRIzol 法提取总RNA,以Nanodrop 系统测定RNA 样品浓度与纯度,测定260 nm、280 nm处OD 值,判断样品纯度是否符合实验要求,以1.2%琼脂糖凝胶电泳检测总RNA 定量。 以逆转录试剂盒将RNA 逆转录为cDNA,经电泳鉴定、酶标仪定量后,采用RT-PCR 法进行检测,反应体系:Master Mix 10 μL,上下游引物各0.5 μL,cDNA 模板2 μL,ddH2O 5 μL;反应条件:94℃预变性10 min;95℃变性10 s,58℃退火40 s,72℃延伸48 s,重复40 个循环。 β-actin 或U6 为管家基因,2-△△Ct为目的基因的相对表达量。 实验重复3 次,取平均值。各基因引物序列,见表1。

表1 各基因引物序列Table 1 Primer sequences of genes
1.3.8 结肠组织Occludin、ZO-1 蛋白相对表达量检测
取80 mg 结肠组织,BCA 法检测蛋白定量,取蛋白样品50 μg 经8%聚丙烯酰胺凝胶电泳分离,电转60 min 后蛋白转移至硝酸纤维素膜上,5%脱脂奶粉TTBS 液(0.121% Tris, 0.9% NaCl, 0.1%Tween-20,pH7.5),漂洗后加Occludin 一抗(1 ∶800)或ZO-1 一抗(1 ∶500)4℃摇床孵育过夜,TTBS 液洗膜3 次,以辣根过氧化物酶标记的二抗(1:10 000)室温孵育2 h,漂洗后ECL 曝光成像,以目的蛋白OD 值/内参β-actin 的OD 值比值为蛋白表达量。
1.4 统计学方法
采用SPSS 20.0 统计软件分析处理数据,计量资料均以(±s)描述,多样本计量资料比较采用方差分析,两两样本比较采用SNK-q 检验。 P<0.05为差异有统计学意义。
2 结果
2.1 一般情况及抑瘤率
对照组小鼠精神状态良好,毛色光泽,进食量、活动量及粪便性状正常,模型组、空载组及过表达组随着时间的延长,精神状态变差,毛色欠光滑,进食量下降,活动量减少,体重减轻,出现腹泻及便血,过表达组症状稍轻。 过表达组抑瘤率为(35.90±5.32)%。
2.2 肝及肠道组织病理学观察
HE 染色结果显示,对照组肝组织中央清晰,肝细胞大小均匀,形态完整,核圆而大、居中;肠道壁结构、形态均正常。 模型组及空载组肝组织正常结构被破坏,肝索结构消失,肝细胞大小不均、排列不齐、细胞核大、深染、可见核分裂,肝小叶内见大量的碎片状坏死,坏死周围伴随大量炎性细胞浸润和增生的纤维细胞;肠道壁结构破坏严重,肠绒毛萎缩、排列稀疏,黏膜下层可见大量炎症细胞浸润,伴有上皮细胞坏死及纤维素样渗出。 过表达组肝组织结构被破坏,细胞变性、坏死较轻,可见细胞体积固缩,部分细胞裂解,染色质浓缩,炎性细胞浸润较轻;肠道壁结构损伤轻微,有少量的炎症细胞浸润,见图1、图2。
2.3 癌组织miRNA-144 mRNA 表达情况
模型组、空载组、过表达组miRNA-144 mRNA相对表达量分别为(0.38±0.06)、(0.39±0.07)、(0.65±0.10),3 组间比较差异有统计学意义(F=38.000,P=0.000),模型组、空载组的miRNA-144 mRNA 相对表达量低于过表达组(t=7.321、6.736,P=0.000、0.000),模型组与空载组比较,差异无统计学意义(t=0.343,P=0.736)。
2.4 肠道内容物菌多样性及丰度比较
各组间肠道菌群、shannon 及chao 指数比较,差异有统计学意义(P<0.05);模型组、空载组、过表达组的双歧杆菌、乳酸菌、shannon 及chao 指数均低于对照组(P<0.05),大肠杆菌、肠球菌均高于对照组(P<0.05);模型组与空载组的双歧杆菌、乳酸菌、shannon 及chao 指数均低于过表达组(P<0.05),大肠杆菌、肠球菌均高于过表达组(P<0.05);模型组与空载组的肠道菌群、shannon 及chao 指数比较,差异无统计学意义(P>0.05),见表2。

图1 肝组织病理图片(HE 染色)Figure 1 Pathological picture of liver tissue (HE staining)

图2 结肠组织病理学图片(HE 染色)Figure 2 Histopathological picture of colon(HE staining)
表2 肠道内容物菌群多样性及丰度比较( ±s,n=10)Table 2 Diversity and abundance of intestinal microflora

表2 肠道内容物菌群多样性及丰度比较( ±s,n=10)Table 2 Diversity and abundance of intestinal microflora
注:4 组间比较,△P<0.01;与对照组比较,*P<0.01;与模型组比较,#P<0.01;与空载组比较,&P<0.01。Note. Compared with the control group,△P <0.01.Compared with the control group,*P <0.01.Compared with the model group,#P <0.01.Compared with the no-load group,&P <0.01.
组别Groups双歧杆菌(lgCFU/g)Bifidobacterium乳酸杆菌(lgCFU/g)Lactobacillus大肠杆菌(lgCFU/g)E.coli肠球菌(lgCFU/g)Enterococcus Shannon 指数Shannon index Chao 指数Chao index对照组Control group 9.01±0.80△ 8.75±0.88△ 7.55±0.88△ 6.85±0.65△ 4.10±0.55△ 836.32±65.32△模型组Model group 5.35±0.55△* 5.68±0.66△* 12.01±0.98△* 10.32±0.85△* 2.02±0.45△* 585.63±55.30△*空载组No-load group 5.30±0.57△* 5.60±0.70△* 12.10±0.95△* 10.28±0.88△* 2.05±0.50△* 584.20±56.32△*过表达组Over-expression group 6.55±0.60△*#& 7.12±0.80△*#& 10.32±0.85△*#& 9.01±0.76*#& 2.85±0.52△*#& 703.02±60.32△*#&
表3 肠道屏障功能比较( ±s,n=10)Table 3 Comparison of intestinal barrier function
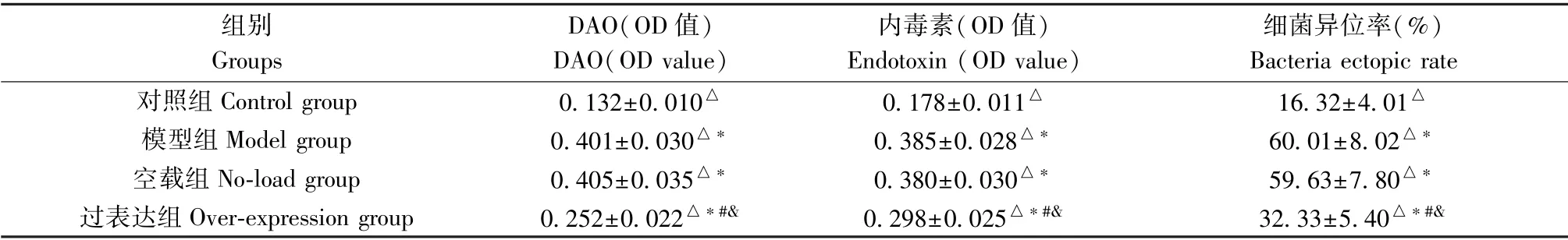
表3 肠道屏障功能比较( ±s,n=10)Table 3 Comparison of intestinal barrier function
注:4 组间比较,△P<0.01;与对照组比较,*P<0.01;与模型组比较,#P<0.01;与空载组比较,&P<0.01。Note. Compared with the control group,△P<0.01.Compared with the control group,*P<0.01.Compared with the model group,#P<0.01.Compared with the no-load group,&P<0.01.
组别Groups DAO(OD 值)DAO(OD value)内毒素(OD 值)Endotoxin (OD value)细菌异位率(%)Bacteria ectopic rate对照组Control group 0.132±0.010△ 0.178±0.011△ 16.32±4.01△模型组Model group 0.401±0.030△* 0.385±0.028△* 60.01±8.02△*空载组No-load group 0.405±0.035△* 0.380±0.030△* 59.63±7.80△*过表达组Over-expression group 0.252±0.022△*#& 0.298±0.025△*#& 32.33±5.40△*#&
2.5 肠道屏障功能比较
各组间血清DAO、内毒素OD 值及细菌异位率比较,差异有统计学意义(P<0.05);模型组、空载组、过表达组的血清DAO、内毒素OD 值及细菌异位率均高于对照组(P<0.05);过表达组的血清DAO、内毒素OD 值及细菌异位率均低于模型组与空载组(P<0.05);模型组与空载组的血清DAO、内毒素OD 值及细菌异位率比较,差异无统计学意义(P>0.05)。 见表3。
2.6 结肠组织Occludin、ZO-1、miRNA-144 mRNA表达情况
各组间Occludin、ZO-1、miRNA-144 mRNA 相对表达量比较,差异有统计学意义(P<0.05)。 对照组、模型组、空载组的miRNA-144 mRNA 相对表达量均低于过表达组(P<0.05),模型组、空载组低于对照组(P<0.05);模型组、空载组、过表达组的Occludin、ZO-1 mRNA 相对表达量均低于对照组(P<0.05),模型组与空载组低于过表达组(P<0.05);模型组、空载组的Occludin、ZO-1、miRNA-144 mRNA 相对表达量比较,差异无统计学意义(P>0.05)。 见图3、表4。
2.7 结肠组织Occludin、ZO-1 蛋白表达情况
各组Occludin、ZO-1 蛋白相对表达量比较,差异有统计学意义(P<0.05);模型组、空载组、过表达组的Occludin、ZO-1 蛋白相对表达量均低于对照组(P <0.05),模型组、空载组低于过表达组(P<0.05);模型组、空载组Occludin、ZO-1 蛋白相对表达量比较,差异无统计学意义(P>0.05)。 见图4、表5。

图3 RT-PCR 分析结果Figure 3 RT-PCR analysis results

图4 结肠组织中紧密连接蛋白表达情况Figure 4 The expression of tight junction protein in colonic tissue
表4 结肠组织中Occludi、ZO-1、miRNA-144 mRNA 相对表达量( ±s,n=10)Table 4 Relative expression of Occludi, ZO-1 and miRNA-144 mRNA in colon tissue

表4 结肠组织中Occludi、ZO-1、miRNA-144 mRNA 相对表达量( ±s,n=10)Table 4 Relative expression of Occludi, ZO-1 and miRNA-144 mRNA in colon tissue
注:4 组间比较,△P<0.01;与对照组比较,*P<0.01;与模型组比较,#P<0.01;与空载组比较,&P<0.01。Note. Compared with the control group,△P <0.01.Compared with the control group,*P <0.01.Compared with the model group,#P<0.01.Compared with the no-load group,&P <0.01.
组别Groups miRNA-144 Occludin ZO-1对照组Control group 1.10±0.15△ 0.95±0.10△ 1.55±0.20△模型组Model group 0.50±0.10△* 0.50±0.07△* 0.95±0.15△*空载组No-load group 0.51±0.09△* 0.49±0.08△* 0.96±0.16△*过表达组Over-expression group 2.56±0.22△*#& 0.66±0.08△*#& 1.20±0.18△*#&
表5 结肠组织中Occludin、ZO-1 的蛋白相对表达量( ±s,n=10)Table 5 Relative expression of Occludin and ZO-1 proteins in colonic tissues

表5 结肠组织中Occludin、ZO-1 的蛋白相对表达量( ±s,n=10)Table 5 Relative expression of Occludin and ZO-1 proteins in colonic tissues
注:4 组间比较,△P<0.01;与对照组比较,*P<0.05;与模型组比较,#P<0.05;与空载组比较,&P<0.05。Note. Compared with the control group,△P <0.01.Compared with the control group,*P<0.01.Compared with the model group,#P <0.01.Compared with the no-load group,&P <0.01.
组别Groups Occludin ZO-1对照组Control group 0.90±0.13△ 0.62±0.10△模型组Model group 0.35±0.07△* 0.20±0.06△*空载组No-load group 0.36±0.08△* 0.19±0.07△*过表达组Over-expression group 0.62±0.10△*#& 0.40±0.08△*#&
3 讨论
肝癌具有恶性程度高、发病隐匿、浸润和转移性强的特点,目前手术切除、放化疗等手段虽可消除病灶或抑制瘤体的发展,但仍有较高的复发、转移率[8]。 “肝肠轴”概念(机体肠道与肝间的交互作用,前者的紊乱是肝疾病发生的重要原因,肠道的稳态环境对肝的保护及机体内环境的稳定有重要作用)的提出,使肝疾病与肠道的作用受到关注,为肝癌肠转移机制提供新的切入点[9]。 随着基因检测手段的进步,miRNA 在肿瘤发生发展中的作用受到重视,成为肿瘤治疗新途径,了解miRNA 在原发性肝癌中表达的意义及对小鼠肠道微生态环境的影响,可为临床的治疗提供依据。
miRNA 是近年来新发现的一类短小、内源性、非编码特性的单链RNA 分子,全长21 ~25 个核苷酸,在多种真核生物中参与转录后的调控表达,其异常表达可影响细胞的增殖、凋亡、分化等重要过程[10-11]。 刘旭斌等[12]认为miRNA 参与肝癌的发生发展;赵立涵等[13]研究发现,miRNA-144-3p 能通过抑制HDGF 基因与蛋白的表达,促进肝癌细胞的凋亡。 本研究结果中,除对照组外,其余3 组小鼠随着时间的延长,精神状态变差,毛色欠光滑,进食量、活动量、体重均下降,出现腹泻及便血,肝组织与结肠组织均有不同程度的破坏,而过表达组较轻;模型组、空载组中癌组织miRNA-144 mRNA 相对表达量低于过表达组。 证实miRNA-144 过表达可抑制肝癌的发展。 肠道黏膜屏障可防止肠腔内有害物质通过肠黏膜进入其他组织及循环中,肠道黏膜屏障功能受损时,肠道内细菌和内毒素可进入门静脉系统,引起炎症和免疫反应,进一步加重肠道黏膜损伤并造成远隔器官损伤。 而肝癌患者因肿瘤细胞的浸润和转移,维持表皮和内皮细胞的选择性渗透屏障功能被破坏,细胞间的紧密连接受损,导致肠道黏膜损伤[14-15]。 王轲等[16]认为,肠道微生态失衡促进肝硬化-肝癌癌前病变的恶性转变,通过调节肠道菌群,阻止细菌的移位并阻断相关信号通路,可延缓或阻止肝癌癌前病变的形成和恶性转变。 本研究结果中,与对照组比较,其余3 组的双歧杆菌、乳酸菌、shannon 及chao 指数更低,过表达组高于模型组与空载组;与对照组比较,其余3组的大肠杆菌、肠球菌、血清DAO、内毒素OD 值及细菌异位率更高,而过表达组低于模型组与空载组。 以上结果说明miRNA-144 过表达能减轻肝与肠道组织损伤,调节肠道菌群,改善肠黏膜屏障功能。
机械屏障是肠黏膜屏障功能中的重要组成部分,紧密连接和黏附连接是肠道上皮机械屏障功能的重要组成部分[17]。 Occludin 与ZO-1 是紧密连接的主要组成成分,Occludin 蛋白的外形结构及跨膜结构参与肠壁通透性的调节;ZO-1 在紧密连接中起桥梁作用,与ZO-2、ZO-3 形成复合体,通过其PDZ区与Occludin 的羧基端结合,其羧基端与细胞内骨架蛋白结合,是紧密连接的功能蛋白,其表达在上皮细胞渗透性与维持细胞极性中发挥重要作用[18-19]。 李永春等[20]认为,蜡样芽孢杆菌能改善胆汁淤积肝损伤大鼠的肠黏膜通透性,其机制与上调小肠组织中紧密连接蛋白的表达有关。 王莉[21]认为,黄芩苷能通过调节miRNA,改善TNF-α 诱导的肠上皮细胞通透性,提高靶基因ZO-1 的表达。 本研究结果中,除过表达组外,其余3 组结肠组织的miRNA-144 mRNA 相对表达量均下降,模型组、空载组均低于对照组;除对照组外,其余3 组Occludin、ZO-1 mRNA 及Occludin、ZO-1 蛋白相对表达量均下降。 提示miRNA-144 过表达能上调Occludin、ZO-1 mRNA 和蛋白的表达,从而调节肠道微生态,改善肠黏膜屏障功能。
综上所述,miRNA-144 过表达,能抑制肝癌的发展,改善小鼠肠道微生态环境与肠道黏膜功能,其调节机制可能与增加Occludin、ZO-1 mRNA 和蛋白的表达有关,可将miRNA-144 作为肝癌基因治疗的切入点。
