不同处理条件下金鱼藻净水效果与微生物群落变化
2020-06-24史传奇胡宝忠于少鹏杨春雪丁俊男
史传奇,胡宝忠,于少鹏,孟 博,杨春雪,刘 嘉,丁俊男
(哈尔滨学院 黑龙江省寒区湿地生态与环境研究重点实验室,哈尔滨湿地研究院, 黑龙江 哈尔滨 150086)
沉水植物可以通过富集作用去除水体污染物,同时提高微生物多样性、丰度与活性,使水体生态得以修复[1]。金鱼藻(CeratophyllumdemersumL.)为金鱼藻科(Ceratophyllaceae)多年生沉水无根植物,世界范围均有分布[2]。王丹等[3]提出金鱼藻对污染水体中总氮(total nitrogen, TN)、总磷(total phosphorus, TP)、化学需氧量具有良好的去除效果。Foroughi等[4]研究表明,金鱼藻可吸收废水中N、P元素以达到净化作用。谭洪涛等[5]利用金鱼藻处理生活污水至28 d,TN、TP去除率达到88.6%、86.9%。姜小玉等[6]研究表明,金鱼藻的加入,可有效提高控藻效果,减少水中N、P含量,长期有效地改善水质。
水体微生物以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)等为优势类群[7-11],也包括古细菌[12-13]。水体环境中,微生物存在于沉水植物根际和叶面形成多孔网状黏液质的“生物膜”中[14-15],可利用植物提供的有机碳源和氧气,参与植物矿质元素交换[16-18]。两者的互利关系易受到环境因子的影响而改变微生物群落结构,如pH值、溶解氧(dissolved oxygen, DO)含量、营养物质等[14-15,19-21]。不同水生植物表面可附着不同的微生物以组建不同的群落结构[14,22],可通过PCR-DGGE、T-RFLP、16S rDNA片段扩增、宏基因组等技术获取其群落结构与多样性特征[1,17,23-24],用于进一步分析两者间,以及环境因子间的相关性,以便更高效地修复水体生态环境[25]。
黑龙江省位于我国最北方,拥有丰富的寒区湿地资源,寒区湿地在气候调节、碳汇、水分平衡和生物多样性保护等方面均发挥着重要作用[26]。然而,农业生产中施用化肥容易导致湿地水体N、P污染[27-28]。尤其是黑龙江省结冰期较长,导致在自然条件下水体净化能力达不到理想效果,开展针对微生物-植物联合净化寒区湿地水体的研究显得十分重要。本研究在实验室内利用金鱼藻,在不同种植密度、不同曝气条件下对水体TN、TP进行去除;同时,利用高通量测序技术测定不同阶段水体微生物群落结构与多样性,为寒区静水湿地水体净化研究提供基础数据,并为今后探明微生物-植物联合净化寒区湿地水体的机制和筛选功能微生物奠定基础。
1 材料与方法
1.1 野外采集与实验设置
水体样品于2018年7月29日取自于黑龙江省哈尔滨市民主乡施肥后的水稻田排水口处,实地取样时水体温度(20.2±1.3)℃、pH 6.59±0.10、DO含量(6.42±0.25)mg·L-1,TN浓度(8.65±0.05)mg·L-1,TP浓度(2.39±0.04)mg·L-1。底泥0~5 cm处取100 g,3次重复,充分混匀,低温保存带回实验室。实验室内设置对照组(A组)和5个处理组(B~F组),每组各重复3次。将实验室内已用蒸馏水培养3 d、生长良好的金鱼藻用蒸馏水漂洗3次,置于筛网上至无水滴连续滴落时称量,B组、C组、E组各投加200 g(种植密度D为4.44 g·L-1),D组、F组各投加400 g(D为8.89 g·L-1),各组均放置于玻璃容器(长×宽×高=50 cm × 30 cm × 40 cm)中,用18 L蒸馏水将底泥充分稀释,每个容器中加入1 L,再分别加入水体样品至水位高30 cm (45 L),实验过程中加入蒸馏水以保持各容器内水量不变。曝气处理组使用流量为50 L·min-1的曝气泵(森森ACO-003电磁式空气泵),每个曝气泵连接4个微孔曝气头,安装于玻璃容器的4个底角处。处理设计如表1。
1.2 室内取样与测定
水体样品取样共3次,分别于7月30日、8月10日、8月21日10:00进行,编号为A1~A3、B1~B3、C1~C3、D1~D3、E1~E3、F1~F3。各玻璃容器内取1.0 L水体样品,采用0.22 μm孔径聚碳酸酯滤膜进行抽滤(每次抽滤前装置用蒸馏水清洗3次,抽滤后将水体样品倒回原玻璃容器),共获得54个水体微生物样品,低温保存送上海天昊生物技术服务公司,进行微生物DNA提取,利用Illumina PE150测序平台对细菌V4-V5区进行高通量测序。测定各玻璃容器内液面下10 cm处pH(雷磁PHB-4 pH计)、DO含量和水体温度(衡欣AZ8403溶解氧仪),每个指标测定重复3次。清除植株残体,于水体液面下5 cm处取样,每玻璃容器中重复3次,分别装入100 mL试管中。采用过硫酸钾消解紫外分光光度法(GB 11894—1989)测定TN浓度,钼酸铵分光光度法(GB 11893—1989)测定TP浓度。
1.3 数据处理与分析
利用SPSS 17.0进行Duncan多重比较,分析不同处理间TN、TP去除率的差异显著性,去除率(%)=(第1次取样时浓度-第3次取样时浓度)/第1次取样时浓度×100。得到水体样品微生物优化序列,在97%相似度水平下聚类为操作分类单位(operational taxonomic units,OTU),统计各样品中OTU的相对丰度信息,计算每组3次重复的平均值。利用Mothur v.1.39.5软件分析微生物群落Chao 1丰富度指数和Shannon多样性指数。Office Excel 2010绘制门水平的群落结构柱状图,SPSS 17.0进行Duncan多重比较,分析门、属水平优势类群相对丰度与多样性指数的差异显著性。利用Canoco for Windows 4.5对OTU水平做主成分分析(principle component analysis, PCA),并分别对门和属水平优势类群相对丰度矩阵做去趋势对应分析(detrended correspondence analysis,DCA),根据DCA结果中梯度长度在第一轴上的值,选择典范对应分析或冗余分析(redundancy analysis,RDA),分析微生物群落与理化因子间相关性,利用Monte Carlo置换检验方法检验理化因子对微生物群落影响的显著性,置换次数为999,并利用CanoDraw for windows 4.0进行作图。
2 结果与分析
2.1 水体样品理化因子检测结果
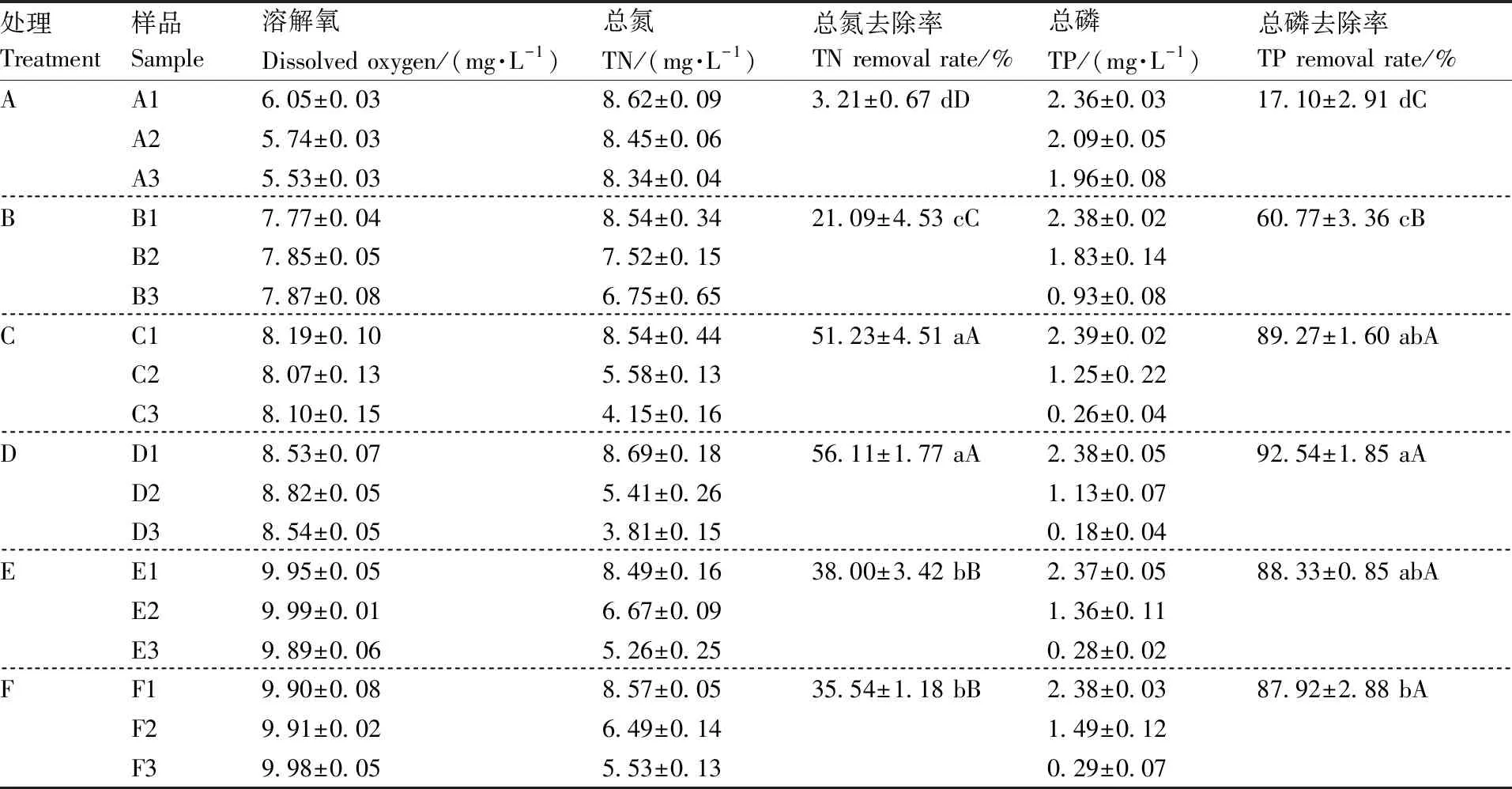
实验室内样品取样时水体温度和pH(6.64±0.04)变化程度较小,且无明显规律。实验结束时,各处理组金鱼藻质量变化差异不显著(P>0.05)。DO含量具有较大差异,如表2,B组、C组和D组DO含量均高于A组,说明取样时金鱼藻可通过光合作用释放氧气,增加水体DO含量,而取样时E、F组仍在进行曝气,其DO含量高于其余组,接近饱和状态。
与A组相比,B~F处理组的TN、TP均有极显著(P<0.01)下降。C组和D组处理条件下TN的去除效果最好,即12 h曝气条件下金鱼藻对TN的去除效果最好。进一步从C组和D组、E组和F组比较中可以看出,相同曝气处理条件下提高金鱼藻种植密度未显著(P>0.05)提高TN去除效果。
表1 实验设计
Table 1 Experimental setting

处理Treatment金鱼藻质量Mass of C. demersum/g种植密度Planting density/(g·L-1)曝气时间Aeration time/hA000B2004.440C2004.4412 (18:00~次日06:00) 12 (from 18:00 to 06:00 the next day)D4008.8912 (18:00~次日06:00) 12 (from 18:00 to 06:00 the next day)E2004.4424F4008.8924
表2 不同处理条件下水体样品理化因子
Table 2 Physicochemical factors of water samples under different treatments
处理Treatment样品Sample溶解氧Dissolved oxygen/(mg·L-1)总氮TN/(mg·L-1)总氮去除率TN removal rate/%总磷TP/(mg·L-1)总磷去除率TP removal rate/%AA16.05±0.038.62±0.093.21±0.67 dD2.36±0.0317.10±2.91 dCA25.74±0.038.45±0.062.09±0.05A35.53±0.038.34±0.041.96±0.08BB17.77±0.048.54±0.3421.09±4.53 cC2.38±0.0260.77±3.36 cBB27.85±0.057.52±0.151.83±0.14B37.87±0.086.75±0.650.93±0.08CC18.19±0.108.54±0.4451.23±4.51 aA2.39±0.0289.27±1.60 abAC28.07±0.135.58±0.131.25±0.22C38.10±0.154.15±0.160.26±0.04DD18.53±0.078.69±0.1856.11±1.77 aA2.38±0.0592.54±1.85 aAD28.82±0.055.41±0.261.13±0.07D38.54±0.053.81±0.150.18±0.04EE19.95±0.058.49±0.1638.00±3.42 bB2.37±0.0588.33±0.85 abAE29.99±0.016.67±0.091.36±0.11E39.89±0.065.26±0.250.28±0.02FF19.90±0.088.57±0.0535.54±1.18 bB2.38±0.0387.92±2.88 bAF29.91±0.026.49±0.141.49±0.12F39.98±0.055.53±0.130.29±0.07
表中数据为平均值±标准差,同列数据后无相同大小写字母分别代表差异极显著(P<0.01)和显著(P<0.05)。

B~F处理组中TP的去除效果达到60%以上,C~F处理组可使TP去除率接近或大于90%,D组TP去除率达到92.54%,但去除效果与C组、E组和F组间未达到极显著差异(P>0.01),说明在投加金鱼藻情况下,曝气处理有利于TP去除,但受曝气时长影响不大。
实验过程中发现,金鱼藻种植密度大的D组、F组曝气条件下常造成金鱼藻断裂、死亡现象。因此,综合考虑金鱼藻用量和曝气条件能耗,本研究中金鱼藻种植密度为4.44 g·L-1, 曝气12 h的C组效果最佳,TN、TP去除率分别为51.23%、89.27%。
2.2 水体微生物高通量测序结果
在97%的序列相似度水平下,通过对序列进行质控和过滤,获得3 283个OTU。计算54个微生物样品中各组重复样品的平均值绘制稀释曲线,如图1所示。各样品的稀释曲线逐渐趋于平缓,即再增大测序深度也不会增加新的OTU,说明该样品的OTU覆盖度已达到饱和,能够反映出水体微生物群落结构的组成。多数样品OTU数量介于700~1 000,B1、D2、A1和B2的OTU数量超过1 000。
依据18个样品OTU数量绘制花瓣图(图2),核心OTU数量为107个,占OTU数量最多的B1样品的9.40%,占OTU数量最少的B3样品的14.84%。A1中特有OTU数量最多,为192个,占该样品OTU总数的17.89%,特有程度最低的为C1,仅占1.00%。从数量上看,A组特有OTU数量较多,说明投加金鱼藻和曝气处理改变了原始微生物群落组成。
图1 稀释曲线Fig.1 Rarefaction curve
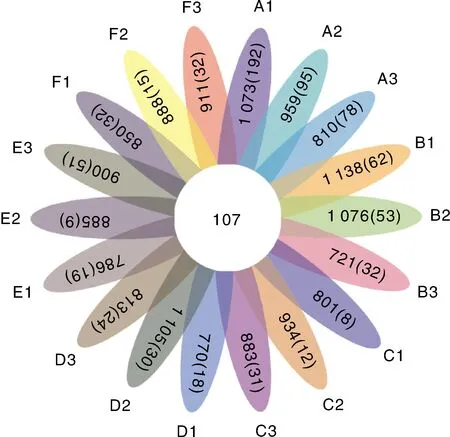
图2 OTU数量花瓣图Fig.2 Petal diagram of OTU number
2.3 微生物群落多样性变化
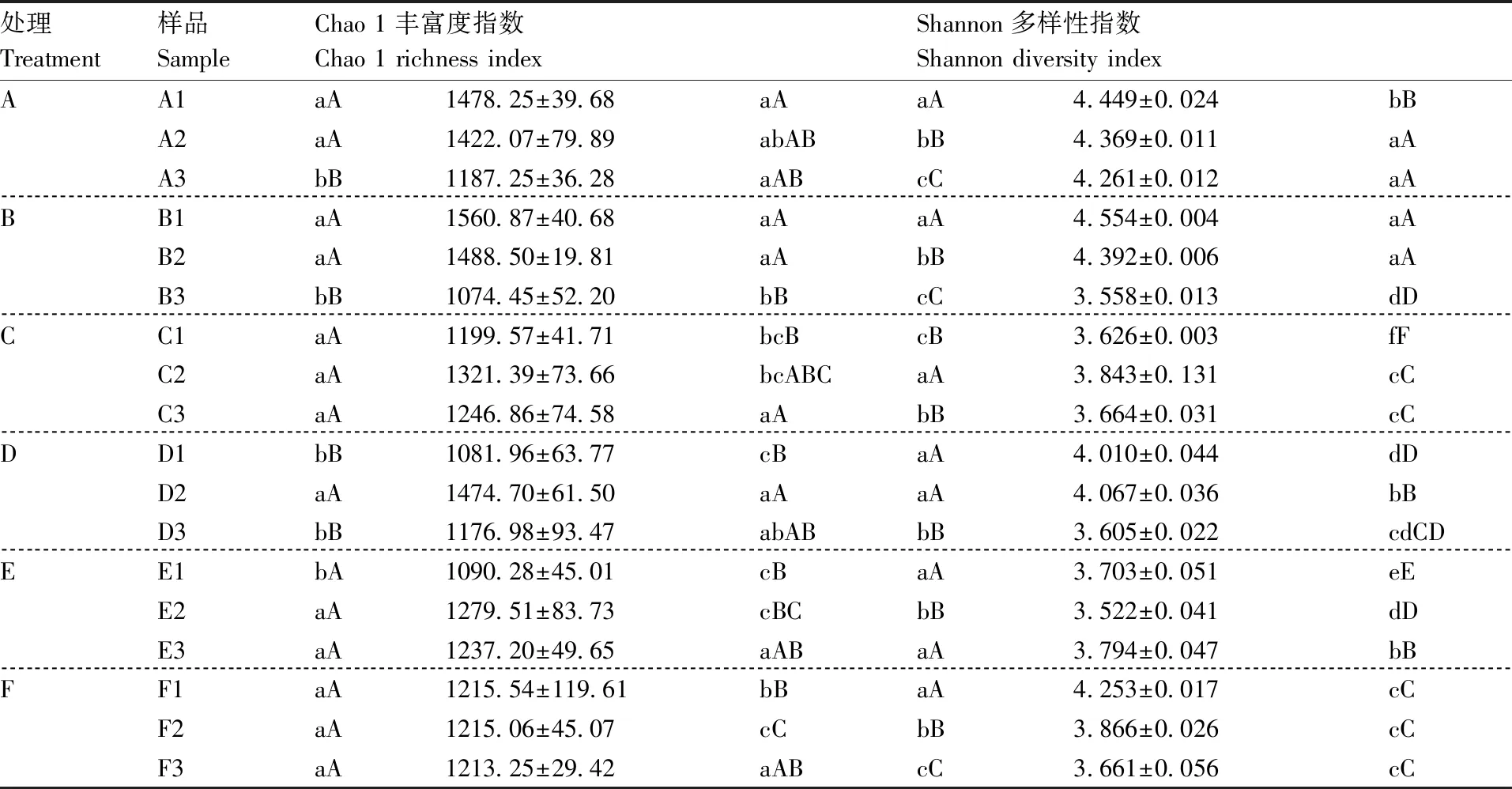
基于OTU水平,在3次取样过程中,A组、B组的Chao 1指数均降低,差异极显著,即丰富度随取样时间变化而降低(表3)。C组、E组和F组各自的Chao 1指数差异未达到极显著水平(P>0.01),D组中在第2次取样时虽有极显著
(P<0.01)上升,但在第3次取样时又极显著(P<0.01)下降至与第1次取样时无极显著差异(P>0.01),说明4个组各自的丰富度在3次取样后未产生极显著(P>0.01)差异。Shannon指数差异反映群落多样性的变化,A组、B组、D组和F组在第3次取样时均有极显著(P<0.01)下降,C组中升高后下降,而E组中下降后升高,C、E两组在第3次取样时其多样性与第1次取样时均无极显著差异(P>0.01)。总体上看,3次取样过程中,各组内微生物群落的丰富度和多样性均未升高。
同一取样时间不同组间比较表明,第1次取样时,A组和B组的丰富度高于其余4组,其余4组间差异未达到极显著水平(P>0.01);6组的Shannon多样性指数差异均达到极显著(P<0.01)水平,B组中最高,C组中最低。第2次取样时,C组和D组丰富度接近A组和B组,且C组与E组、F组差异不显著(P>0.05);A组和B组、C组和F组Shannon多样性差异不显著(P>0.05),与D组、E组差异极显著(P<0.01)。第3次取样时,除B组丰富度极显著(P<0.01)低于C组外,其余组间差异均未达到极显著水平(P>0.01);A组多样性指数最高,其次为E组,C组和F组多样性差异仍不显著(P>0.05),与B组差异极显著(P<0.01),而C、F、B组与D组多样性差异均不显著(P>0.05)。总体上看,不同处理条件下,随取样次数变化,各组间微生物群落的丰富度与多样性差异显著性逐渐降低。
表3 水体微生物群落丰富度指数与多样性指数(OTU水平)
Table 3 Aquatic microbial community richness index and diversity index (OTU level)
处理Treatment样品SampleChao 1丰富度指数Chao 1 richness indexShannon多样性指数Shannon diversity indexAA1aA1478.25±39.68aAaA4.449±0.024bBA2aA1422.07±79.89abABbB4.369±0.011aAA3bB1187.25±36.28aABcC4.261±0.012aABB1aA1560.87±40.68aAaA4.554±0.004aAB2aA1488.50±19.81aAbB4.392±0.006aAB3bB1074.45±52.20bBcC3.558±0.013dDCC1aA1199.57±41.71bcBcB3.626±0.003fFC2aA1321.39±73.66bcABCaA3.843±0.131cCC3aA1246.86±74.58aAbB3.664±0.031cCDD1bB1081.96±63.77cBaA4.010±0.044dDD2aA1474.70±61.50aAaA4.067±0.036bBD3bB1176.98±93.47abABbB3.605±0.022cdCDEE1bA1090.28±45.01cBaA3.703±0.051eEE2aA1279.51±83.73cBCbB3.522±0.041dDE3aA1237.20±49.65aABaA3.794±0.047bBFF1aA1215.54±119.61bBaA4.253±0.017cCF2aA1215.06±45.07cCbB3.866±0.026cCF3aA1213.25±29.42aABcC3.661±0.056cC
指数前的字母为同组不同取样时间的差异显著性,指数后字母为同一取样时间不同处理间的差异显著性。
The letters in front of the index were the difference significance of different sampling time in the same group, and the letters at the back of the index were the difference significance between different groups in the same sampling time.
2.4 水体微生物群落样品间关系
在OTU水平上,对水体微生物样品做PCA(图3),前2个主成分累计贡献率为40.4%。在第一主成分轴上,A1、A2、A3与其余样品分开,说明A组样品OTU种类与其余5组存在差异,即投加金鱼藻使微生物种类发生变化。B2、B3与其余样品同样具有差异,而C组、D组、E组、F组相距较近,说明投加金鱼藻后曝气处理同样会影响微生物的群落组成。在第二主成分轴上,按照3次取样时间,大致可将水体样品分为3组,即随着取样时间变化,微生物种类发生了变化。总体上看,第一主成分反映出实验处理组间微生物群落差异,即投加金鱼藻和曝气处理,而第二主成分反映了不同取样时间微生物群落之间的差异。
2.5 水体微生物群落结构与变化
2.5.1 门水平群落结构与变化
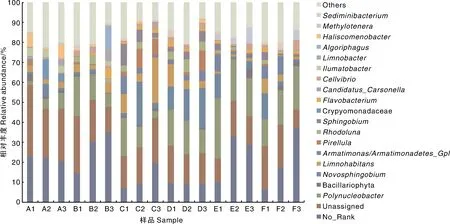
测序结果共得到33个微生物门水平类群(图4),优势类群为变形菌门、拟杆菌门和放线菌门,3个门相对丰度之和均占各样品总相对丰度的70%以上,尤其在E2中高达84.34%。第1次取样时,相较于A组,其余5组中3个优势类群均具有极显著(P<0.01)差异,说明投加金鱼藻和曝气处理在短时间内即可改变水体微生物群落结构。
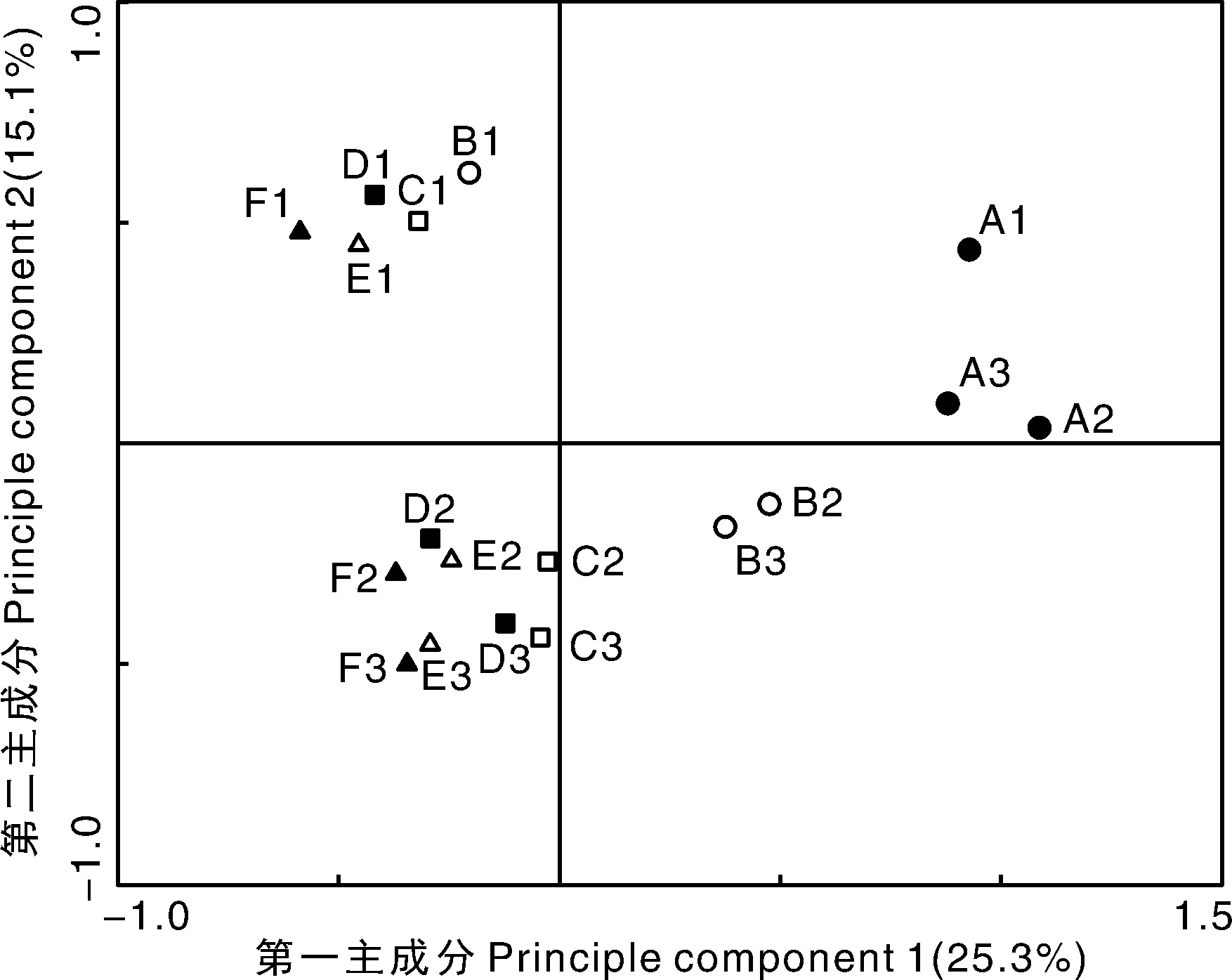
图3 基于OTU水平的主成分分析Fig.3 Principal component analysis based on OTU level
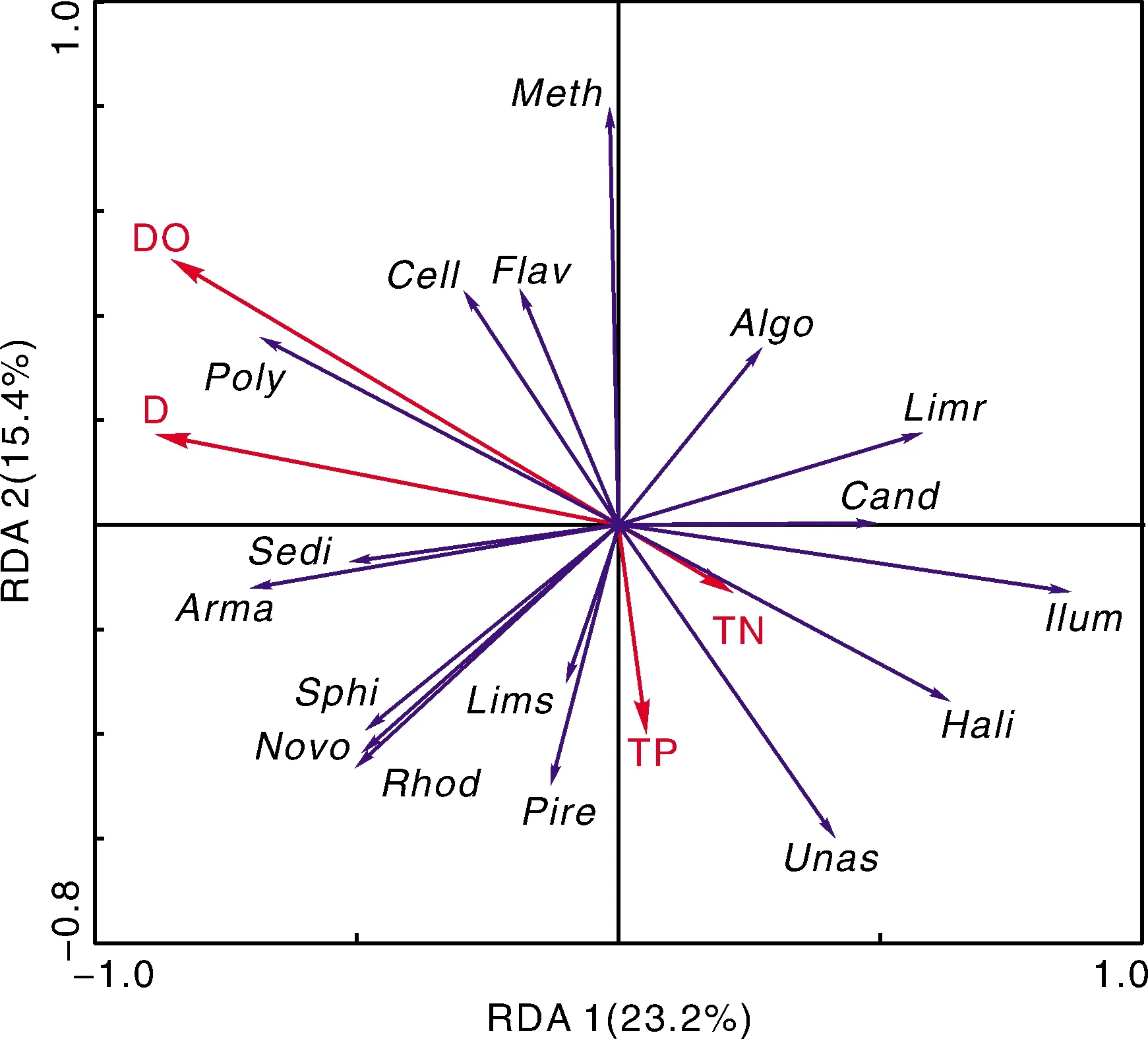
变形菌门相对丰度在E1、E2与C2差异未达到极显著水平(0.01 图4 水体微生物群落门水平相对丰度Fig.4 Relative abundances of aquatic microbial communities at phylum level 拟杆菌门相对丰度在A1、B2、B3中最高,E1、E2、D3(与C3、E3差异不显著,P>0.05)最低;同组不同取样时间,A组、B组、C组和E组在第3次取样时相对丰度有上升趋势,D组和F组下降,说明投加适量金鱼藻有利于提高其相对丰度,但过量的金鱼藻和曝气处理不利于其繁殖。 放线菌门相对丰度在A1、E2、F3最高,F1、D2、D3最低;同组不同取样时间,6个组中放线菌门相对丰度随取样时间均呈上升趋势,E组和F组中上升幅度非常大,说明投加金鱼藻有利于提高其相对丰度,且该门适于长期曝气环境。 此外,浮霉菌门(Planctomycetes)在A组3次取样中相对丰度分别为7.86%、10.28%、9.93%,C2(10.28%)、C3(9.21%)、D3(11.03%)中接近10%,装甲菌门(Armatimonadetes)在C1(8.88%)、E1(8.18%)、F1(6.40%)、F2(8.98%)中比例高于A组、B组(均小于0.2%);其余微生物类群相对丰度均小于5%,其中,迷踪菌门(Elusimicrobia)、Cloacimonetes、Microgenomates及古细菌Woesearchaeota、Pacearchaeota、广古菌门(Euryarchaeota)存在于A、B组,其余组内比例极低或无,说明曝气条件改变了原始水体环境,不利于其繁殖。 2.5.2 属水平群落结构及变化 属水平共得到427个类群,其中变形菌门168属,接近总属数的40%,厚壁菌门73属、拟杆菌门55属、放线菌门39属。如图5所示,前20个属水平类群(相对丰度之和占77%以上)均为细菌类群(及藻类),无古细菌,除No_Rank、硅藻门(Bacillariophyta)和隐鞭藻科(Cryptomonadaceae)之外的17属,包括变形菌门9属(包括Unassigned)、拟杆菌门4属、放线菌门2属,浮霉菌门和装甲菌门各1属;但无厚壁菌门,说明该门下属的相对丰度低。 相对丰度较高的Unassigned、多核杆菌属(Polynucleobacter)、新鞘氨醇杆菌属(Novosphingobium)均隶属于变形菌门,Unassigned隶属于草酸杆菌科(Oxalobacteraceae)。在同组的不同取样时间,相比于第1次取样,第3次取样时只有C组、E组中其相对丰度上升,其余4组中均极显著(P<0.01)降低。在不同组间,A组中其相对丰度在3次取样时均为最高(P<0.01),分别达到35.96%、24.27%、26.09%,说明投加金鱼藻和曝气处理不利于其繁殖。 多核杆菌属在同组不同取样时间,A组、F组中相对丰度极显著(P<0.01)升高,其余4组中均极显著(P<0.01)降低;在同一取样时间不同组间,E1(30.26%)、E2(20.81%)、F3(21.07%)最高,而A1(2.02%)、A2(4.89%)、C3(3.35%)最低,说明投加金鱼藻有利于提高多核杆菌属相对丰度,且适于持续曝气处理。 图5 水体微生物群落属(前20)水平相对丰度Fig.5 Relative abundances of aquatic microbial communities at genus level (top 20) 其余属仅在个别样品中占有一定比例,而在其余样品中相对丰度较低,如变形菌门的新鞘氨醇杆菌属(C2中相对丰度为21.98%)、Limnohabitans(C3中相对丰度为22.75%)、装甲菌门的Armatimonas/Armatimonadetes_gp1(F2中相对丰度为8.98%)、浮霉菌门的小梨形菌属(Pirellula) (D3中相对丰度为10.38%)、放线菌门的Rhodoluna(D2中相对丰度为6.56%)等。 2.6.1 理化因子对微生物门水平群落的影响 根据微生物样品门水平类群的相对丰度矩阵做DCA,结果显示,梯度长度在第一轴上的值为0.920,选择RDA研究其相关性。如图6所示,第一、二排序轴分别解释总变量的24.6%、9.6%,多数类群与第一排序轴成正相关,与第二排序轴成负相关。变形菌门、放线菌门与第一排序轴成负相关,拟杆菌门与第一排序轴成正相关,但其贡献率较小。变形菌门与放线菌门、拟杆菌门均成负相关,后两者成正相关,但相关性较小。 图中4个字母为图4中门拉丁名缩写。D代表金鱼藻种植密度。The four letters in figure were short for the phylum Latin names in figure 4. D represented the planting density of C. demersum.图6 水体微生物群落(门水平)与理化因子间冗余分析Fig.6 RDA between aquatic microbial community (phylum level) and physicochemical factors DO、D对各门水平群落影响极显著(P<0.01),与多数微生物类群成负相关,而TN、TP对各门水平群落影响未达到极显著(0.01 2.6.2 理化因子对微生物属水平群落的影响 微生物样品前20个属水平群落,除No_Rank、硅藻门和隐鞭藻科外,对剩余17个属(包括Unassigned)的相对丰度矩阵做DCA,结果中梯度长度在第一轴上的值为1.681,同样选择RDA。如图7所示,第一、二排序轴分别解释总变量的23.2%、15.4%。Unassigned与第一排序轴成正相关,多核杆菌属与第一排序轴成负相关。DO、D对17个属的影响均达到极显著(P<0.01),与多核杆菌属成正相关,且DO与多核杆菌属相关性较强,说明投加金鱼藻与曝气处理有利于提高多核杆菌属的相对丰度。TN、TP对17个属的影响不显著(P>0.05),即与TN、TP浓度变化所产生的影响相比,投加金鱼藻和曝气处理对微生物优势属相对丰度的影响更大。 图中4个字母为图5中属拉丁名缩写。其中Lims为Limnohabitans的缩写,Limr为Limnobacter的缩写。The four letters in figure were short for the genus Latin names in figure 5. Lims was short for Limnohabitans and Limr was short for Limnobacter.图7 水体微生物群落(属水平)与理化因子间冗余分析Fig.7 RDA between aquatic microbial community (genus level) and physicochemical factors 本研究表明:沉水植物金鱼藻在曝气条件下对寒区静水湿地水体具有较好的净化作用,在实验室固定容器内,投加金鱼藻并进行曝气处理可有效去除水体TN、TP;水体微生物优势类群为变形菌门、拟杆菌门和放线菌门,属水平存在较大比例的未分类类群,投加金鱼藻和曝气处理改变了微生物优势门、属的相对丰度,各组内微生物群落多样性随取样时间均未升高,且组间差异显著性逐渐降低;金鱼藻种植密度和DO含量对水体微生物群落有极显著影响,对微生物群落起到定向驯化的作用。 本研究利用寒区静水湿地常见沉水植物金鱼藻,通过曝气处理增加水体DO含量,达到TN、TP去除效果。多种水生植物具有净化水体的作用,如伊乐藻(Elodeanuttallii)[10]、美人蕉(CannaindicaL.)[29]、黄花鸢尾(IriswilsoniiC. H. Wright)[30]等,但这些植物不适合在黑龙江省寒区湿地环境中生长。而篦齿眼子菜(PotamogetonpectinatusL.)、芦苇[Phragmitesaustralis(Cav.) Trin. ex Steud.][31]、香蒲(TyphaorientalisPresl.)、浮萍(LemnaminorL.)[32]、金鱼藻等同样具有去除水体污染物的功能,而且在黑龙江省自然分布[33]。其中,金鱼藻在静水中悬浮生长,对污染水体中N、P均具有较好的去除作用[3-6]。本实验投加金鱼藻在曝气条件下可以达到TN、TP去除效果。 张萌等[34]研究表明,金鱼藻的种植密度为4.0 g·L-1时,对TN、TP去除率高达86.78%、91.82%,最优种植密度为4.5~5.0 g·L-1。本研究中金鱼藻种植密度分别为4.44 g·L-1和8.89 g·L-1,但在相同曝气条件下,2种种植密度对TN、TP去除率差异并不显著,可能是在固定容器中,金鱼藻种植密度在4.44 g·L-1左右已经达到“饱和”。此外,金鱼藻种植密度过大常会造成金鱼藻生长不良,植株枯萎。 微生物亦可参与水体生态修复[23,35-36],通过参与固氮、脱氮、硫酸盐还原、产甲烷过程、金属离子还原等过程,去除水体污染物[17-18,37-38]。如变形菌门中的氨化细菌、氨氧化细菌、亚硝酸盐氧化细菌、反硝化细菌和浮霉菌门等参与氮循环[9,39-40]。微生物与植物联合可达到较强的净化能力,但两者联合对水体净化的机制尚不清晰[15,41],可能是因为与植物关联的细菌大多具有降解作用从而增加植物净化水体的能力[42]。微生物可将有机氮转化为氨氮,在有氧条件下转化为硝态氮,氨氮和硝态氮均可被植物吸收利用[43]。如在本研究对照组中TN去除率仅为3.21%,且前期相同环境下单独间歇曝气处理TN去除率与之差异不显著,投加金鱼藻在未曝气条件下为21.09%,投加金鱼藻在曝气条件下显著提高了TN去除率。一方面植物光合作用和曝气可为微生物硝化过程中提供所需的氧气,另一方面植物吸收微生物转化的氨氮和硝态氮以去除TN,在一定程度上说明两者联合可有效提高水体净化能力。 水体微生物群落中变形菌门、拟杆菌门、放线菌门、厚壁菌门常占有绝对优势[7-11]。本研究结果同样表明,寒区湿地水体样品不同处理间变形菌门、拟杆菌门、放线菌门相对丰度较高。变形菌门适应能力强,在不同生境中广泛分布,在水体脱氮除磷过程中起重要作用[44]。本研究中Unassigned、多核杆菌属、新鞘氨醇杆菌属等优势属均隶属于变形菌门,且2个属常见于水体环境中[45-46]。 微生物生长、繁殖受植物种类与形态、pH、DO含量和温度等因素的影响[14-15,19-21,24]。本研究因在实验室内进行,水体温度较为稳定,且实验期间加入蒸馏水以保持水量恒定,pH较小的变化对微生物群落中优势类群的影响程度均不大。PCA结果表明,微生物群落变化与不同处理条件、不同的取样时间相关,RDA进一步证明理化因子中影响较大的因素为金鱼藻种植密度和DO含量。DO含量是对微生物群落结构影响最显著的环境因子[16]。敬双怡等[11]研究表明,变形菌门、拟杆菌门与DO含量成正相关,放线菌门与DO含量成负相关。但本研究中变形菌门、放线菌门与DO含量成正相关,而拟杆菌门与DO含量成负相关,可能是因为处理条件或门下所包含种类不同而产生的不同结果。Gagnon等[15]认为,不同湿地植物可构建不同的微生物群落形成“生物膜”,植物根、茎形态可能是影响“生物膜”中微生物群落多样性和活性的关键因素。金鱼藻为无根沉水植物,在其水体净化体系中,种植密度影响茎、叶的表面积,以及光合作用与呼吸作用效率,即影响微生物的附着面积和DO含量,进而影响微生物群落。因此,在本研究中金鱼藻种植密度和DO含量是影响微生物群落变化的直接因素,而TN、TP浓度变化主要依赖于金鱼藻与微生物共同作用,是影响微生物群落变化的间接因素。 沉水植物可以影响微生物的群落结构,显著提高水体中细菌的多样性[1]。DO可激活微生物的生物活性,同时也为微生物提供良好的生长环境[47]。本研究结果表明,投加金鱼藻和曝气处理使微生物特有种类减少,各组多样性指数均未升高,组间多样性差异降低,在3次取样后相对丰度较高的变形菌门(与拟杆菌门、放线菌门成负相关性)和属水平的Unassigned总体上均呈下降趋势,说明微生物群落通过改变原优势类群以逐渐适应不同处理条件,即投加金鱼藻和曝气处理使微生物群落得以定向驯化。
2.6 理化因子对微生物群落的影响

3 结论与讨论
3.1 水体净化效果
3.2 微生物群落变化及其影响因素
