棘孢木霉和超微粉腐殖质改善连作土壤微生态
2020-06-24原倩宇孙万春虞轶俊俞巧钢马军伟
林 辉,张 锦,原倩宇,2,叶 静,孙万春,虞轶俊,俞巧钢,马军伟,*
(1.浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021; 2.西北农林科技大学 环境资源学院,陕西 杨凌 712100; 3.浙江省耕地质量与肥料管理总站,农业农村部肥料质量监督检验测试中心(杭州),浙江 杭州 310020)
设施栽培是我国蔬菜、瓜果等经济作物栽培的重要方式。随着连作年限延长,设施蔬菜土壤环境恶化,土壤微生物区系失衡,土传病害等发生日益严重,连作障碍现象普遍。尖孢镰刀菌(Fusariumoxysporum)是典型的土传病害真菌,可引起100多种植物发生枯萎病。随栽培年限增加,土壤中的尖孢镰刀菌数量一般呈上升趋势[1]。研究显示,致病尖孢镰刀菌增殖已成为设施连作中较为突出的问题之一,可导致作物减产甚至绝收[2]。因此,寻求高效、低成本且环境友好型的方法抑制尖孢镰刀菌,改善土壤环境,对减轻设施土壤连作障碍具有重要意义。目前,在防治连作障碍、杀灭土传病菌方面,研究人员提出了物理防治、化学防治、生物防治等多种手段,其中用生物菌剂进行生物防治的方法受到了广泛关注。此外,一些土壤调理剂的使用也可以达到降低土传病害、减轻连作障碍的目的。例如,向土壤中施用生物炭可降低土壤中尖孢镰刀菌的数量,改善土壤微生物区系[3-5]。
在生物菌剂方面,部分木霉、枯草芽孢杆菌、角担子菌属真菌等被发现均有较好的尖孢镰刀菌拮抗能力,在作物栽培上应用后减少了蔬菜发病,增加了经济产量[6-7]。其中,木霉菌被公认为是一类普遍存在并具有重要经济意义的生防益菌,以其高效、安全、不易引起病原菌抗药性的特点,在以可持续发展为宗旨的生物防治中发挥了重要作用[8]。大量国内外研究也报道了木霉富集型生物有机肥(Trichoderma-enriched biofertilizer)在促进作物生长、提高养分利用、抑制氧化亚氮等温室气体排放和助力化肥减量等方面的积极作用[9-10]。据报道,部分棘孢木霉(Trichodermaasperellum)添加到有机肥或者直接施用于土壤,可以防治枯萎病等植物病害[11-12]。但总的来看,现有的生物防治菌剂或多或少地仍存在一些问题,筛选、开发更多的候选微生物仍显得非常迫切。棘孢木霉T-1具有产孢能力较强、pH耐受范围较广等特点。目前,关于棘孢木霉T-1的研究主要集中在其对木质纤维素的降解上[13-15]:在餐厨-秸秆堆肥中接种棘孢木霉T-1,提高了垃圾中有机物的降解率(纤维素降解率最高可增长10%),降低了垃圾堆肥中氮、磷等养分的损失,提高了堆肥产物的种子发芽率[16],但棘孢木霉T-1的生物防治能力及其对土壤微生物的影响等还未明确。
泥炭、风化煤等矿物腐殖质是腐殖酸肥料的重要原料,也常用作生物有机肥的载体,这些风化煤原料的粒度往往在100目以上。风化煤等矿物腐殖质中腐殖酸含量丰富,含有多种活性基团,具有吸附、络合、交换等性能,可通过改善土壤团聚体质量、提高土壤腐殖酸含量、增加土壤阳离子交换量等途径来改良土壤[17]。武俊俊等[18]研究指出,以经过简单微生物处理的风化煤作为长山药的基肥,可增加土壤疏松度、地温、活性物质等,改善土壤理化性质,有效促进长山药的出苗和生长,提高其产量和品质。在水稻土中使用风化煤可促进水稻对N、P等养分的吸收,增强根系活力,提高产量[19]。超微粉腐殖质是一种利用机械化学技术将泥炭、风化煤等矿物腐殖质研磨加工到粒度小于1 000目的超微细颗粒,成品为深褐色超微细粉末,其中,研磨细度达到纳米级的腐殖质也被称为乌金散。研究表明,超细粉碎改变了煤粒表面亲水基和疏水基的比例、电动电位绝对值等各种表面性质,对水溶性组分含量、腐植酸的析出性能等也有影响[20]。笔者所在课题组的前期研究也表明,超微粉加工提高了风化煤的游离腐殖酸含量,粉碎粒度在100目左右的原料风化煤中可溶性腐殖酸含量为46%,而超微粉腐殖质中可溶性腐殖酸含量增加到了76%。由此推测,超微粉腐殖质对土壤的调理作用可能与未经加工处理的腐殖质原料存在差异。但无论是矿物腐殖质原料还是超微粉腐殖质,均未见深入探讨其对土壤病原菌或微生物区系影响的研究。
针对以上背景,本文以棘孢木霉T-1和超微粉腐殖质为对象,研究二者单一和复合使用下对连作土壤微生物区系的影响,尤其是对典型土传病菌——尖孢镰刀菌的影响,以期为进一步研发蔬菜土传病害预防、控制材料和方法提供依据。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
尖孢镰刀菌黄瓜专化型(F.oxysporumf. sp.cucumberium,FOC)、尖孢镰刀菌西瓜专化型(F.oxysporumf. sp.niveum,FON)和尖孢镰刀菌萎蔫专化型(F.oxysporumf. sp.vasinfectum,FOV),均购自中国农业微生物菌种保藏中心。棘孢木霉T-1为本实验室保藏菌株。
1.1.2 试验土壤
试验土壤采集自宁波某设施蔬菜大棚。土壤理化性质如下:含水率17.9%,pH值5.67,电导率(EC)1.40 mS·cm-1,有机质含量6.00%,总氮含量0.442%,有效磷含量151.52 mg·kg-1,速效钾含量11.1 mg·kg-1,阳离子交换量17.89 cmol(+)·kg-1。
1.1.3 棘孢木霉T-1菌剂
将棘孢木霉T-1菌株斜面保藏物接种到马铃薯葡萄糖琼脂培养基(PDA)平板,置于28 ℃培养4 d,直至形成大量孢子,采用无菌水(含有0.1%吐温80)将孢子和菌丝洗下,平板培养法测定活菌数,通过稀释将活菌数保持在1×108mL-1,作为待接种的液体菌剂备用。
1.1.4 超微粉腐殖质
超微粉腐殖质取自浙江丰瑜生态科技有限公司,原料为风化煤,通过机械超细粉加工技术研磨到超微细颗粒,粒度<1 000目,成品为深褐色超微细粉末,腐殖质含水量19%,有机质含量90%,pH值5.2,EC 1.45 mS·cm-1,总氮0.86%。将棘孢木霉T-1液体菌剂与超微粉腐殖质按照体积质量比1∶2混匀,低温烘干,即为腐殖质-T1。
1.2 试验设计
1.2.1 平皿对峙培养
以尖孢镰刀菌(含FOC、FON、FOV)为抑制对象,采用平板对峙试验,分析棘孢木霉的抑菌活性。在直径为9 cm的PDA平板一侧接种直径为5 mm的病原真菌菌丝块,在另一侧接种棘孢木霉T-1,25 ℃共培养,以仅接种尖孢镰刀菌的平板为对照,定期观察棘孢木霉对尖孢镰刀菌的抑制作用,记录菌落生长直径和相互作用情况,观察菌株之间的拮抗效果,计算平皿抑菌率。
1.2.2 微宇宙土壤培养试验
开展室内土壤培养。共设4个处理:CK-S,空白处理;TS1,超微粉腐殖质添加量1%(质量分数);TS2,棘孢木霉T-1菌剂添加量0.5%(质量分数);TS3,腐殖质-T1添加量1%(质量分数)。每个处理3个重复。在250 mL培养瓶中装入50 g新鲜土样,放在28 ℃培养箱中培养,相对湿度为75%,定期补充水分。隔一段时间进行1次采样,共采样3次。
1.2.3 黄瓜盆栽试验
采用圆形塑料盆开展盆栽试验。塑料盆直径17 cm,高12 cm(内尺寸),装干土2 kg。盆栽植物为黄瓜(银胚99)。试验设3个处理:CK-C,空白处理;TC1,超微粉腐殖质添加量1%(质量分数);TC2,腐殖质-T1添加量1%(质量分数)。将不同处理的添加物与土壤混匀,装盆,浇透水,及时补充水分。精选大小一致、健壮的黄瓜种子于50 ℃热水浸泡15 min,接着在常温水里浸泡6 h,之后放在室内24 h,最后将露白的种子播种到育苗盘中。当黄瓜幼苗长到三叶期时,选取大小一致的黄瓜幼苗播种于盆栽中,每盆3颗幼苗,每个处理5个重复。盆栽放在温室内培养,温度22~28 ℃,相对湿度为60%~70%。每天浇水1次,隔1 d拍照记录1次,每隔几天进行一次土壤采样,共采样3次。
1.3 检测方法
1.3.1 土壤中尖孢镰刀菌数量测定
采用MP FastDNA®Spin Kit for Soil试剂盒提取土壤基因组DNA。引物(10 mmol·L-1)名称及其序列如下:AFP308R,CGAATTAACGCGAGTCCCAAC;ITS1-F,CTTGGTCATTTAGAGGAAGTAA[21]。采用北京全式金生物技术有限公司的2×EasyTaqPCR SuperMix试剂盒对土壤基因组进行PCR扩增,对PCR产物进行凝胶电泳分析,确定片段大小与待测基因基本一致后,将获得的PCR产物重组到pMD19-T质粒上,委托生工生物工程(上海)股份有限公司对质粒上的基因片段进行测序验证。将测序验证正确的尖孢镰刀菌基因片段重组质粒作为定量PCR(qPCR)的标准品,用于建立质粒拷贝数与CT值(即PCR反应管内荧光信号达到设定的阈值时所经历的循环数)对应关系的标准曲线。采用Qubit 3.0荧光计对质粒DNA浓度进行测定,随后通过计算可以获得质粒标准品的拷贝数。qPCR扩增在ABI公司的StepOnePlusTM实时荧光定量PCR系统上进行,扩增试剂采用宝生物工程(大连)有限公司(Takara)提供的MightyAmpTMfor Real-time PCR Kit试剂盒,选用20 μL的反应体系:模板DNA 2 μL,2 ×MightyAmp for Real Time (SYBR plus) 10 μL,引物各0.4 μL(10 μmol· L-1),ROX reference Dye (50×) 0.4 μL,超纯水补齐至20 μL。扩增反应采用3步法:预变性98 ℃ 2 min;变性98 ℃ 10 s,58 ℃退火15 s,延伸72 ℃ 30 s,40个循环;熔解曲线(melting curve stage)。采用的qPCR方法可保证待测样品的熔解曲线为单一峰,扩增特异性良好,并且和标准品具有相同的DNA熔解温度(Tm)。该方法的标准曲线线性良好(决定系数R2>0.99),扩增效率较高(90%~110%)。通过获得的土壤中尖孢镰刀菌的绝对拷贝数(以单位质量干土计)计算抑菌率。
1.3.2 土壤中棘孢木霉活菌数测定
取新鲜或冷藏土样5 g,加入45 mL无菌水,配制成土壤悬浮液(稀释度为10-1),180 r·min-1振荡60 min,使微生物均匀分散,静置后吸取上层清液依次进行10倍梯度的稀释,不同稀释度的土壤悬浮液各取100 μL,涂抹于分离棘孢木霉菌的选择性培养基上,25 ℃恒温黑暗培养5~7 d,统计菌落数量,选取合适的稀释度进行计数,每处理重复3次。
棘孢木霉选择性培养基TSM[22-23]:MgSO4·7H2O 0.2 g,K2HPO40.9 g,KCl 0.15 g,NH4NO31.0 g,孟加拉红0.15 g,葡萄糖 3.0 g, 琼脂20 g,115 ℃ 灭菌30 min。使用前先将培养基冷却到60 ℃,加入无菌的氯霉素0.25 g、对二甲基氨基苯重氮磺酸钠0.3 g、五氯硝基苯0.2 g。
1.3.3 土壤中真菌、细菌和放线菌数量测定
取新鲜或冷藏土样5 g,加入45 mL无菌水,配制成土壤悬浮液(稀释度为10-1),180 r·min-1振荡60 min,使微生物均匀分散,静置后吸取上层清液依次进行10倍梯度的稀释,不同稀释度的土壤悬浮液各取100 μL,涂布于不同培养基上。采用稀释平板法,使用选择性培养基分别测定土壤中细菌、真菌、放线菌的数量:细菌用牛肉膏蛋白胨培养基,真菌用孟加拉红培养基,放线菌用高氏1号培养基。25 ℃ 恒温黑暗培养一定时间后统计菌落数量,选取合适的稀释度进行试验计数,每处理重复3次。
1.4 数据分析
采用Excel 2010软件进行数据处理和作图,采用SPSS 19.0软件对数据进行方差分析,对有显著(P<0.05)差异的,采用LSD法进行多重比较。
2 结果与分析
2.1 棘孢木霉T-1对不同尖孢镰刀菌的拮抗效果
如图1所示,棘孢木霉T-1的生长速度明显快于尖孢镰刀菌,可抑制各种类型尖孢镰刀菌的生长。其中,T-1对FON的抑制效果最佳,培养7 d的平皿抑菌率为74.5%,而对FOC和FOV的抑制效果略差,培养7 d的平皿抑菌率分别为59.5%和68.2%。
2.2 室内土壤培养下不同处理对连作土壤微生物群落的影响
2.2.1 尖孢镰刀菌

图1 平板对峙培养试验结果Fig.1 Plate confrontation assays of strain T-1
如图2所示,添加超微粉腐殖质(TS1)、棘孢木霉T-1菌剂(TS2)与腐殖质-T1(TS3)的处理均能抑制连作障碍土壤的尖孢镰刀菌数量,各处理组的尖孢镰刀菌绝对拷贝数显著(P<0.05)下降,13 d时各处理对土壤尖孢镰刀菌的抑制作用最强,抑菌率在68.7%~90.4%。相比单独添加超微粉腐殖质或棘孢木霉T-1,腐殖质-T1的抑菌效果更佳,TS3处理4 d和13 d对尖孢镰刀菌的抑制率分别为78.9%和90.4%,而相同时间点TS1和TS2处理的的抑菌率分别为34.9%~41.1%和68.7%~74.2%。此外,TS1和TS2处理对连作土壤尖孢镰刀菌数量的影响无显著差异。综上,超微粉腐殖质和棘孢木霉T-1菌剂复配使用对尖孢镰刀菌的抑制具有协同增强效应。
2.2.2 可培养微生物
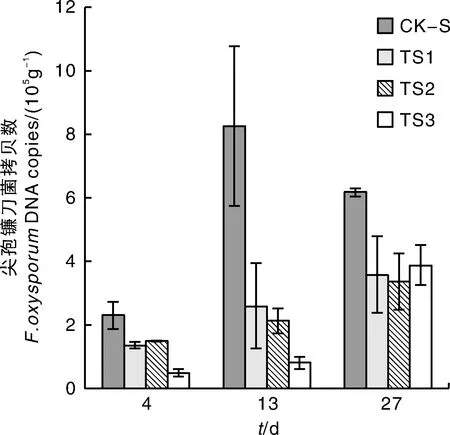
图2 不同处理下连作障碍土壤中尖孢镰刀菌的绝对拷贝数Fig.2 Absolute copy number of F. oxysporum in continuous cropping soil under different treatments
由表1可知,相较于对照(CK-S),向未栽培作物的连作土壤模拟生态系统中添加超微粉腐殖质(TS1)、棘孢木霉T-1菌剂(TS2)和腐殖质-T1(TS3)均未对土壤细菌数量产生显著影响,表明3种添加剂对土壤细菌生长的干扰较小。从添加后4 d的数据来看,添加超微粉腐殖质显著(P<0.05)降低了土壤中的真菌数量,但抑制作用较为短暂。添加棘孢木霉T-1菌剂和腐殖质-T1的土壤中的真菌数量在27 d时显著(P<0.05)高于对照(CK-S)土壤和单独添加超微粉腐殖质的土壤,该现象可能与TS2和TS3处理中棘孢木霉T-1在土壤中的定殖有关。此外,棘孢木霉T-1菌剂和腐殖质-T1还短暂(3 d)促进了土壤中放线菌的生长,但在13 d和27 d时不同处理土壤中的放线菌数量均无显著差异。
2.2.3 棘孢木霉T-1
由图3可知,对照(CK-S)和添加腐殖质(TS1)的土壤中均未检出木霉菌,而添加棘孢木霉T-1菌剂(TS2)和腐殖质-T1(TS3)的土壤中检出2×104g-1以上的棘孢木霉,并随着时间延长,其数量先增加后下降,有效活菌数在13 d时达到高峰。
2.3 盆栽条件下不同处理的试验效果
2.3.1 对黄瓜生长及其枯萎病防治效果的影响
如表2所示,在黄瓜栽培前向土壤中施用超微粉腐殖质(TC1)或腐殖质-T1(TC2)均可增强黄瓜的抗病能力,降低病死株数量,促进黄瓜生长,且以腐殖质-T1的促黄瓜幼苗生长和抗病效果最佳。与施用超微粉腐殖质相比,施用腐殖质-T1的黄瓜叶片更强壮、更绿(图4)。
表1 室内土壤培养下不同处理土壤中真菌、放线菌和细菌数量
Table 1 Cultivable number of fungi, actinomycetes and bacteria in soils under soil microcosm conditions
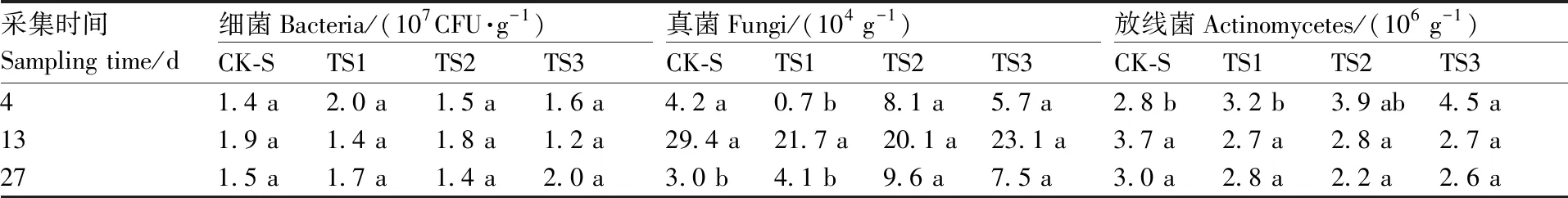
采集时间Sampling time/d细菌Bacteria/(107CFU·g-1)CK-STS1TS2TS3真菌Fungi/(104 g-1)CK-STS1TS2TS3放线菌Actinomycetes/(106 g-1)CK-STS1TS2TS341.4 a2.0 a1.5 a1.6 a4.2 a0.7 b8.1 a5.7 a2.8 b3.2 b3.9 ab4.5 a131.9 a1.4 a1.8 a1.2 a29.4 a21.7 a20.1 a23.1 a3.7 a2.7 a2.8 a2.7 a271.5 a1.7 a1.4 a2.0 a3.0 b4.1 b9.6 a7.5 a3.0 a2.8 a2.2 a2.6 a
相同时间不同处理下同一类别微生物数量无相同字母的表示处理间差异显著(P<0.05)。表3同。
Data marked without the same letters of the same microbial community indicated significant (P<0.05) difference within treatments at the same time. The same as in Table 3.
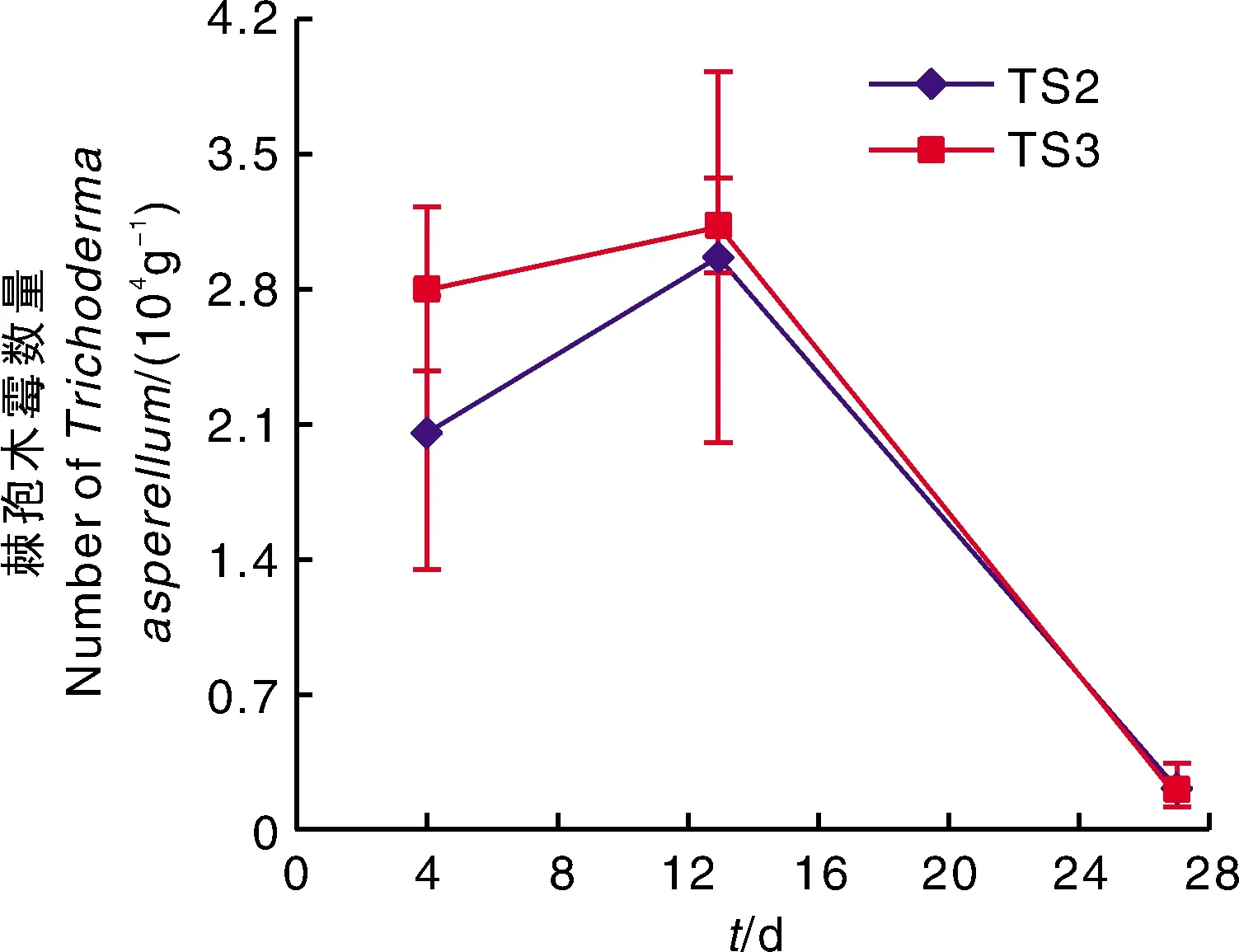
图3 不同处理下连作障碍土壤中棘孢木霉T-1数量Fig.3 Number of Trichoderma asperellum T-1 in continuous cropping soil under different treatments
表2 黄瓜幼苗移栽10天后的病死率
Table 2 Mortality rate of cucumber seedlings after 10 days of transplanting

处理Treatment病株(不含死株)Sick plant(no dead plants)/%死株Deadplants/%总病死率Total mortalityrate/%CK-C6.746.753.4TC113.320.033.3TC206.76.7
2.3.2 对土壤中尖孢镰刀菌数量的影响
采集黄瓜苗移栽4、13、27 d的土壤样品,其中尖孢镰刀菌的数量变化如图5所示。可知,施用超微粉腐殖质(TC1)或腐殖质-T1(TC2)均能有效抑制黄瓜土壤中的尖孢镰刀菌,且腐殖酸-T1

图4 不同处理下黄瓜幼苗移栽2周后的生长情况Fig.4 Growth of cucumber seedlings under different treatments after transplanting for 2 weeks

图5 黄瓜盆栽下不同处理土壤的尖孢镰刀菌数量Fig.5 Number of F. oxysporum in cucumber potting soils under different treatments
的抑菌效果优于超微粉腐殖质,在27 d观察期内,TC2处理的抑菌率稳定在72%~80%,而TC1处理的抑菌率从59.6%降至17.3%。盆栽试验结果进一步证实,超微粉腐殖质和木霉T-1菌剂复配使用可以有效抑制土壤中尖孢镰刀菌的增殖。
2.3.3 对土壤可培养微生物群落和棘孢木霉数量的影响
从表3可以看出,相同时间不同处理盆栽土壤的细菌数量无显著差异,与室内土壤培养试验结果一致,说明施用超微粉腐殖质或腐殖质-T1并不会对土壤细菌产生显著影响。施用超微粉腐殖质(TC1)或腐殖质-T1(TC2)有助于增加黄瓜栽培过程中土壤放线菌数量,其中,分别在4 d和21 d时,TC1和TC2处理与CK-C的土壤放线菌数量差异达到了显著水平(P<0.05)。施用超微粉腐殖质(TC1)或腐殖质-T1(TC2)改变了土壤真菌数量的变化趋势:对照(CK-C)的土壤真菌数量随时间增加而下降,而TC1和TC2的土壤真菌数量却随时间延长先增加后下降。4 d时,施用超微粉腐殖质的处理显著(P<0.05)降低了土壤中的真菌数量,但抑制作用较为短暂;13 d时,施用腐殖质-T1的土壤中真菌数量显著(P<0.05)高于其他处理,而另2个处理的土壤真菌数量已无显著差异;21 d时,3个处理的土壤真菌数量均无显著差异。进一步测定TC2处理土壤中的棘孢木霉数量,发现其数量变化趋势与真菌完全一致,推测栽培13 d时TC2处理土壤中真菌数量的显著增加与外源棘孢木霉的定殖有关。
表3 盆栽条件下不同处理土壤中真菌、放线菌和细菌数量
Table 3 Number of fungi, actinomycetes and bacteria in cucumber potting soils under different treatments
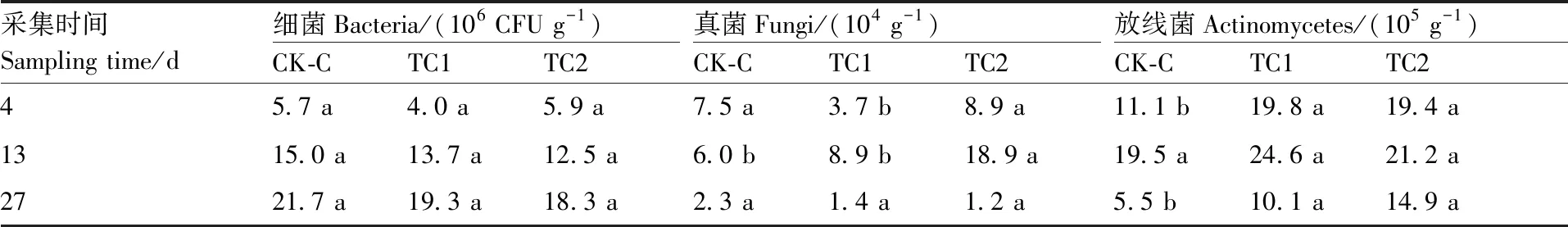
采集时间Sampling time/d细菌Bacteria/(106 CFU g-1)CK-CTC1TC2真菌Fungi/(104 g-1)CK-CTC1TC2放线菌Actinomycetes/(105 g-1)CK-CTC1TC245.7 a4.0 a5.9 a7.5 a3.7 b8.9 a11.1 b19.8 a19.4 a1315.0 a13.7 a12.5 a6.0 b8.9 b18.9 a19.5 a24.6 a21.2 a2721.7 a19.3 a18.3 a2.3 a1.4 a1.2 a5.5 b10.1 a14.9 a

图6 TC2处理土壤中棘孢木霉T-1数量变化Fig.6 Number of Trichoderma asperellum T-1 in soils under TC2 treatment
3 讨论
在连作障碍土壤中,微生物种群失衡现象非常常见。在连作生产条件下,改变土壤微生物种群结构,降低尖孢镰刀菌等土传病害菌数量,营造健康的土壤微生物环境是解决连作障碍的重要途径之一。在一般情况下,细菌真菌比值较高的土壤肥力更高,抑病能力更强。在以往改善连作障碍的相关研究中[24-26],尖孢镰刀菌等病原真菌数量的显著减少往往伴随着土壤细菌和放线菌数量、比例的显著增加,以及真菌数量比例的明显下降。在本研究中,棘孢木霉T-1、超微粉腐殖质及其复配物均被证实可改善连作土壤微生态结构,施用于常年蔬菜连作的土壤能抑制尖孢镰刀菌生长,增加土壤放线菌数量,且不影响土壤细菌繁殖,黄瓜盆栽试验和土壤培养试验的结果基本一致,其中,超微粉腐殖质和棘孢木霉T-1复配物的效果最佳,能提高黄瓜的抗病和生长性能。
棘孢木霉对黄瓜专化型尖孢镰刀菌的抑制效应在以往的报道中多有涉及,如张春秋等[27]筛选的棘孢木霉525、贺字典等[7]研究的棘孢木霉菌肥等。棘孢木霉T-1在木质纤维素降解方面具有优势,可作为微生物菌剂促进农业有机废弃物的降解和肥料化[16]。本研究进一步证实,棘孢木霉T-1还具有防治土传病害的能力,并发现其施用能够促进连作土壤上黄瓜的生长。棘孢木霉生物农药、生物杀菌剂产品一直受到各方面的关注和欢迎。棘孢木霉T-1的生物质分解能力和植物病原菌拮抗功能使其具备发展成为生物有机肥生产菌种的潜能:一方面,T-1可以用于促进木质纤维素类废弃物的降解和腐殖化;另一方面,T-1在物料中的定殖可赋予发酵产物一定的生物防治能力,有利于实现农业有机废弃物的高值资源化。在本研究检索范围内,还未见到关于棘孢木霉防治西瓜枯萎病或棉花枯萎病的研究报道。本研究显示,棘孢木霉T-1除了能拮抗尖孢镰刀菌黄瓜专化型,对萎蔫专化型和西瓜专化型也具有拮抗能力,暗示其有望同时应用于西瓜或棉花枯萎病的防治。
风化煤作为土壤调理剂已被证实具有改良土壤理化性状、增加土壤腐殖质、提高作物产量品质等作用[17-18],与传统的风化煤原料相比,超微粉加工后的风化煤在性质上有一定的改变,如游离腐殖酸含量增加等。本研究发现,以风化煤为原料的超微粉腐殖质具有一定的抑制土壤尖孢镰刀菌生长、提高黄瓜抗病能力的作用。金平等[28]研究发现,腐殖酸可以作为农药增效剂来提高黄瓜的抗病能力。我们推测,超微粉腐殖质对土壤尖孢镰刀菌的抑制作用及其对黄瓜的促生长能力可能与其高含量的腐殖酸有关。此外,超微粉腐殖质施用后土壤中有机质含量的增加可能也是其改良连作土壤微生态的重要途径。要特别指出的是,超微粉腐殖质呈酸性,因此更适用于碱性较强的土壤,如盐碱土的改良修复。
在实际生产中,单独试验生防菌的防治效果结果往往不稳定,影响其推广和应用。目前,将生防菌同有机肥相结合使用是主要的发展趋势。谷祖敏等[29]报道了香菇菌糠对绿色木霉防治黄瓜枯萎病的增效作用,二者混合使用提高了绿色木霉在土壤中的定殖,土壤中枯萎病菌数量减少56.9%~77.7%,增效显著。本研究发现,棘孢木霉T-1和超微粉腐殖质复配具有协同增效作用,其对土壤尖孢镰刀菌的抑制作用更持久,对土壤放线菌的促进作用更强,添加后黄瓜的生长性能和抗病能力更高。超微粉腐殖质对土壤真菌的抑制效果显著,推测可能是通过广谱性的抑菌行为降低了土壤中尖孢镰刀菌的数量。生防木霉对尖孢镰刀菌的抑制效用有一定的针对性和靶向性。研究指出,生防木霉与尖孢镰刀菌在土壤中的生长繁殖一般呈负相关,生防木霉数量的增加往往伴随着尖孢镰刀菌数量的下降[7]。综合以上信息推测,超微粉腐殖质和棘孢木霉T-1的协同增效作用与二者不同的生防机制有极大相关性。此外,我们认为超微粉腐殖质和棘孢木霉T-1存在明显的互作行为,并且二者通过互作实现了抑菌和促生长的协同增效。在一些与微生物菌剂相关的专利中常发现风化煤的添加,据此我们认为,超微粉腐殖质与棘孢木霉T-1复配的协同增效作用可能还与前者可以作为微生物的吸附载体,并可以提供养分有关。载体的存在可以增加菌种的存活率和稳定性,而外源养分对于提高棘孢木霉T-1在土壤中竞争营养和浸染位点的能力具有重要作用[29],这一推测的直接证据是,本研究发现超微粉腐殖质促进了棘孢木霉T-1在土壤中的生长和定殖。此外,微生物已被证实在风化煤等矿物腐殖质的降解和活化中具有重要作用[30]。Namasivayam等[31]研究表明,生防绿色木霉通过溶解褐煤释放腐殖酸,获得的腐殖酸添加到高粱栽培土壤中大幅促进了高粱生长,且效果优于人工合成的腐殖酸。因此,棘孢木霉的生长代谢还可能促进超微粉腐殖质中活性物质,如腐殖酸的快速活化释放,从而进一步增强超微粉腐殖质对土壤的改良效果和对植物的促生长作用。
综上,本研究发现,棘孢木霉T-1、超微粉腐殖质及其复配物(腐殖质-T1)均能抑制连作土壤中尖孢镰刀菌的生长,其中,腐殖质-T1的抑菌作用最佳,在室内土壤培养条件下,腐殖质-T1处理的尖孢镰刀菌抑菌率达68.7%~90.4%,在黄瓜盆栽条件下,前13 d的抑菌率均保持在70%以上。黄瓜盆栽试验还表明,施用腐殖质-T1复配物有效降低了黄瓜病死株数量,表现出促生长效应。研究成果可为设施连作土壤调理和土传病害防治提供材料与技术参考,其中,棘孢木霉T-1和超微粉腐殖质复配物具有较高的应用开发价值。
