胰蛋白酶的纯化及质量研究
2020-06-23汪雅雯王欣黄臻辉
汪雅雯 王欣 黄臻辉

摘 要 目的:建立一种胰蛋白酶的纯化方法,并进行质量研究。 方法:胰蛋白酶原(粗品)经溶解、低pH孵放法灭活病毒、超滤除盐、酶原活化、亲和层析纯化、洗脱液超滤除盐、膜过滤法去除病毒和真空冷冻干燥等工序,即得胰蛋白酶。 结果:所获的胰蛋白酶符合药典规定的限度要求。结论:该方法可缩短生产工时、提高成品效价和工艺稳定性,降低糜蛋白酶含量,提升了胰蛋白酶的质量和安全性。
关键词 胰蛋白酶 纯化 质量
中图分类号:TQ464.8; TQ460.64 文献标志码:A 文章编号:1006-1533(2020)11-0089-04
Study on purification and quality of trypsin
WANG Yawen*, WANG Xin, HUANG Zhenhui
(SPH NO.1 Biochemical & Pharmaceutical Co., Ltd., Shanghai 200240, China)
ABSTRACT Objective: To prepare high-purity trypsin and investigate its quality. Methods: The manufacturing process for the production of trypsin included dissolving trypsinogen (crude extract), inactivating virus by incubation at low pH value, desalinating by ultra-filtration, trypsinogen activating, purification by affinity chromatography, eluent desalinating by ultrafiltration, virus removal by nano-film filtration and vacuum freeze-drying. Results: The prepared trypsin could reach to the standard of pharmacopeia. Conclusion: The production cycle can be shortened, the potency of trypsin and the stability of the process can be improved, the content of chymotrypsin can be reduced and the quality and safety of trypsin can be increased.
KEy WORDS trypsin; purification; quality
胰蛋白酶(trypsin,EC3.4.21.4)属于丝氨酸蛋白酶家族[1],为特异性肽链内切酶,可选择性地切断赖氨酸和精氨酸残基羧基端形成的肽键。胰蛋白酶主要来源于猪、牛或羊的胰脏,经分离纯化所得。
牛胰蛋白酶是由223个氨基酸组成的单一肽链,含6对二硫键,分子量约为23 800 Da[2]。目前胰蛋白酶生产工艺多采用硫酸铵盐析法,此工艺纯化能力弱,耗时长、成品效价低,且有关物质糜蛋白酶含量易超出限度要求。另外,鉴于胰蛋白酶原粗品来自动物脏器,存在病毒感染的风险,会对终产品临床应用的安全性构成一定的威胁。因此,极有必要开发一种能克服现有技术缺陷的制备工艺。亲和层析纯化胰蛋白酶,工艺较为简便,工时较短,可得到高纯度、高效价的成品;在制备过程中增加病毒灭活/去除工序,进一步提高了产品的质量和安全性。本研究以提取过糜蛋白酶的牛胰滤液经盐析所得的胰蛋白酶原(粗品)为原料,经溶解、低pH孵放法灭活病毒、超滤除盐、酶原活化、亲和层析纯化、洗脱液超滤除盐、膜过滤去除病毒和真空冷冻干燥等工序获得胰蛋白酶[3]。同时严格按照国内外药典标准[4-6]进行检测,分子排阻色谱法分析纯度,进一步控制产品质量,保证产品的安全性。
1 材料和方法
1.1 仪器与材料
Benzamidine Sepharose 4FF(HS)和AKTA(GE Healthcare公司);FE20 pH计、S230电导率仪和XS205分析天平(Mettler Toledo公司);中空纤维膜柱和Microza-Table超滤仪(Pall公司);MIR-254低温恒温培养箱(Panasonic公司);UV-2450紫外-可見分光光度计(Shimadzu公司);JJ2000电子天平(常熟市双杰测试仪器厂);LC-6M离心机(上海市离心机械研究所有限公司);BPZ-6033真空干燥箱(上海一恒科学仪器有限公司);YB-2澄明度检测仪(天大天发科技有限公司);SX2-2.5-12TP箱式电阻炉(上海跃进医疗器械有限公司);ZHJH-C1118B超净工作台(上海智城分析仪器制造有限公司);GSP-9270MBE隔水式恒温培养箱(上海博迅医疗生物仪器股份有限公司);(0.45 mm+0.2 mm)囊式过滤器、(0.2 mm+0.1 mm)囊式过滤器和Virosart CPV病毒过滤器(Sartorius Stedim公司);TSKgel G2000SWXL柱(7.8 mm×300 mm,5 μm, Tosoh公司);e2695/2489液相色谱仪(Waters公司)。
胰蛋白酶原粗品购自集宁区牛羊脏器加工部;胰蛋白酶由上海上药第一生化药业有限公司自制;N-乙酰-L-酪氨酸乙酯购自Sigma公司;核糖核酸酶A对照品、人胰岛素对照品、胸腺法新对照品、生长抑素对照品购自中国食品药品检定研究院;BCA蛋白质定量检测试剂盒购自生工生物工程(上海)股份有限公司;其余试剂均为国产试剂。
1.2 实验方法
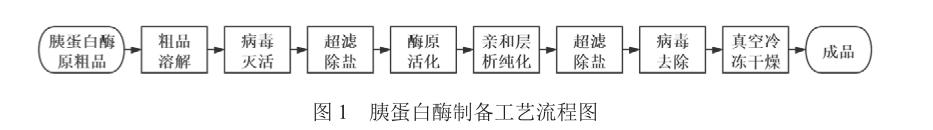
制备工艺流程见图1。
1.2.1 粗品溶解
称取胰蛋白酶原粗品1 000 g,加入5倍量(V/W)酸性水溶液(用2.5 mol/L H2SO4调节纯化水至pH 2.8~3.2)搅拌,直至全部溶解。
1.2.2 病毒灭活
粗品溶液于20~25 ℃孵放60 min。在此条件可使病毒表面的细胞抗原电荷发生改变,蛋白质的空间结构发生不可逆变性,从而使病毒丧失与细胞受体结合的能力,不能进入细胞完成侵染[7],达到灭活病毒的目的。
1.2.3 超滤除盐
病毒灭活后的粗品溶液,于4 ℃、4 000 r/min的条件下离心15~20 min,取上清液,加入等体积pH 3.0水溶液,用截留分子量为10 kDa的中空纤维膜柱超滤除盐至1/2体积;补加等体积pH 3.0水溶液,超滤至1/2体积;重复以上操作,直至电导率降至5 ms/cm以下,降低高盐对胰蛋白酶原活化的影响。亲和层析纯化后,用截留分子量为6 kDa的中空纤维膜柱再次超滤除盐,直至电导率降至1.5 ms/cm以下。两次超滤除盐后溶液的终体积均约为5~6 L。
1.2.4 酶原活化
待超滤除盐后,加5 mol/L CaCl2溶液至终浓度为100 mmol/L。用5 mol/L NaOH调节至pH 7.3~7.6,按1/1 000倍量粗品加入胰蛋白酶1.0 g(W/W),搅拌溶解后于0~10 ℃活化。每小时取样,参照《中国药典》2015年版(二部)“胰蛋白酶”质量标准中“效价”[4]检测溶液效价;待液体效价无显著增长时结束活化,测定蛋白浓度,计算活化液的比活。
1.2.5 亲和层析纯化
预先将亲和层析填料Benzamidine Sepharose 4FF(HS)装柱。用Tris-HCl(pH 7.3~7.6,50 mmol/L)、NaCl(150 mmol/L)、CaCl2(100 mmol/L)缓冲液作为平衡液进行平衡;上样前活化液须经深层过滤器和(0.45 mm+0.2 mm)囊式过滤器压滤处理;上样完毕,用平衡液洗柱,直至流穿峰A280nm下至基线;用NaCl溶液(pH 2.0,500 mmol/L)洗脱,收集洗脱液。其中上样、洗柱和洗脱的流速均为200 ml/min。测定洗脱液的蛋白浓度和效价,计算洗脱液的比活。
1.2.6 病毒去除
将上述超滤除盐后所获的溶液用5 mol/L NaOH调节至pH 5.9~6.1,4层中速滤纸抽滤得滤液。滤液于0~10℃经(0.45 mm+0.2 mm)-(0.2 mm+0.1 mm)-Virosart CPV病毒过滤器三联膜、2 Bar压力下压滤。Virosart CPV为纳米膜,利用蛋白质和病毒的大小差异来分离病毒[7],达到去除病毒的目的。
1.2.7 真空冷冻干燥及分析检测
将胰蛋白酶滤液冷冻干燥,经前后箱制冷、抽真空、一次升华、二次升华、保温,出箱得胰蛋白酶成品。
根据《中国药典》2015年版(二部)“胰蛋白酶”质量标准[4]进行胰蛋白酶成品的全项测定。同时依据《美国药典》42版(USP42)和《英国药典》2019(BP2019)中“胰蛋白酶”质量标准,新增吸收系数、组胺(可反映胰蛋白酶中有机杂质含量)[5]、炽灼残渣(可反映无机杂质含量)[6]、微生物(可反映外源因子污染)[5-6]的检测,进一步控制成品的质量,保证产品的安全性。
取核糖核酸酶A(分子量13 700 Da)对照品、人胰岛素(分子量5 808 Da)对照品、胸腺法新(分子量3 108 Da)对照品、生长抑素(分子量1 638 Da)对照品,加流动相溶解制成每1 ml中含1 mg的溶液,作为分子量对照溶液;流动相为三氟乙酸-乙腈-水(0.5∶350∶650);检测波长280 nm,流速1 ml/min,柱温30 ℃。 取对照溶液20 ml,注入液相色谱仪,以各峰保留时间为横坐标,分子量对数为纵坐标,进行线性回归。取胰蛋白酶成品溶解液20 ml,注入液相色谱仪,按面积归一化法计算分子量大于10 000 Da的蛋白的比例,作为胰蛋白酶纯度的检测。
2 结果
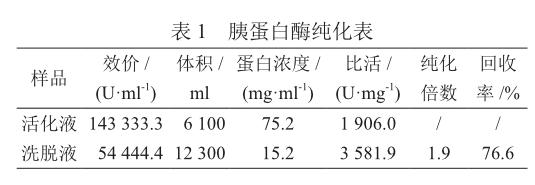
2.1 亲和层析纯化效果评估
对活化液和洗脱液进行效价(活性)、蛋白浓度的测定及比活的计算,以评估纯化的效果(纯化倍数),结果如表1所示。亲和层析的纯化倍数为1.9,活性回收率为76.6%。
2.2 纯化产品测定
胰蛋白酶冷冻干燥后得固体粉末82.4 g。胰蛋白酶性状、鉴别、酸度、溶液澄清度、干燥失重、糜蛋白酶和效价等检测结果均符合《中国药典》各项的限度要求;吸收系数、组胺、炽灼残渣和微生物等检测结果均符合《美國药典》和《英国药典》规定的限度要求(表2)。胰蛋白酶收率为3.21亿U/kg,分子排阻色谱法检测纯度达90.0%(图2)。
3 讨论
本制备工艺的优势主要包括以下几方面:①亲和层析法取代硫酸铵多次盐析,缩短了生产工时;②超滤工序可实现单元操作管道化和自动化;③提高了成品效价:《中国药典》2015年版“胰蛋白酶”[4]限度要求不得<2 500 U/mg,此制备工艺所得的效价约为4 000 U/mg,显著提高了产品的质量;④降低糜蛋白酶含量:有关物质糜蛋白酶是牛胰脏中理化性质和胰蛋白酶非常相近的杂蛋白;在亲和纯化条件下,牛源糜蛋白酶不能与Benzamidine结合,确保了胰蛋白酶成品中糜蛋白酶含量合格,且远低于药典规定的“每2 500 U胰蛋白酶中不得多于50 U的糜蛋白酶[4]”;⑤胰蛋白酶质量符合美国药典和英国药典的质量标准;⑥传统工艺中硫酸铵盐析法受蛋白质浓度等多个因素影响较大,因而得到的成品质量批次间差异较大,而亲和层析法可减少胰蛋白酶原粗品的质量影响,提高工艺稳定性;⑦针对潜在污染病毒的威胁并结合胰蛋白酶低温、低pH稳定的特性,增加低pH孵放法灭活病毒和膜过滤法去除病毒;两种有效工序从机制上可互补,进一步提升了产品的质量和安全性。
按照上述的制备工艺可得高质量的胰蛋白酶,但是制备过程中中间体研究还待细化,明确关键工艺参数,以达到生产过程控制的目的;同时鉴于胰蛋白酶在低温条件比较稳定,可预冷亲和层析的缓冲液,提高胰蛋白酶的稳定性,提高回收率;加强胰蛋白酶原粗品的质量控制,减少动物组织提取制品普遍存在的批次间差异大的问题。
亲和层析具有吸附洗脱速率快、色谱柱壓较低、生产规模容易按比例放大等多项优点[8]。但鉴于亲和层析填料价格昂贵,如何提高填料的重复利用率,还有待进一步摸索。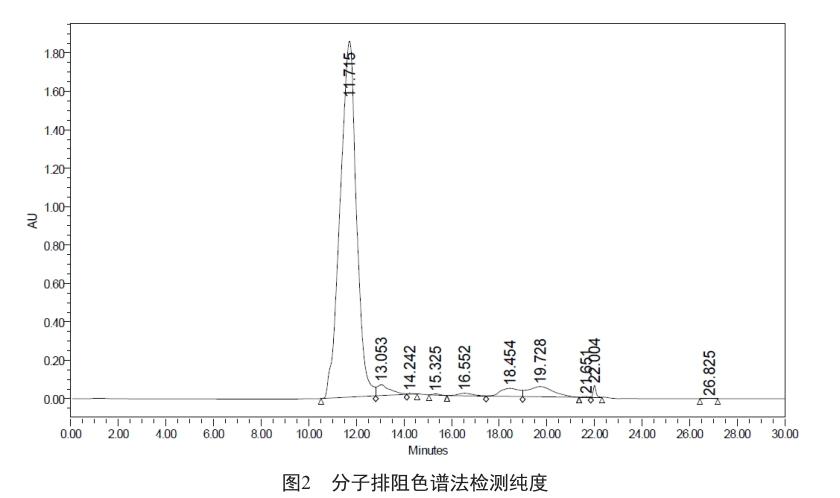
参考文献
[1] Rawlings ND, Barrett AJ. Families of serine peptidases[J]. Methods Enzymol, 1994, 244: 19-61.
[2] Ohshima Y, Suzuki Y, Nakatani A, et al. Refolding of fully reduced bovine pancreatic trypsin[J]. J Biosci Bioeng, 2008, 106(4): 345-349.
[3] 黄臻辉, 汪雅雯, 周伟洁, 等. 一种高纯度胰蛋白酶的制备方法: CN104762284A[P]. 2015-07-08.
[4] 国家药典委员会. 中华人民共和国药典2015年版二部[M]. 北京: 中国医药科技出版社, 2015: 1169-1170.
[5] British Pharmacopoeia Commission. BP2019[EB/OL].[2019-10-12]. https://www.pharmacopoeia.com/bp-2019/monographs/trypsin.html?published-date=2018-08-01&text=trypsin.
[6] The United States Pharmacopeial Convention. USP42-NF37[EB/OL]. [2019-10-12]. https://online.uspnf.com/ uspnf/document/GUID-F4F923EE-11B8-4069-829F-39BB0E2C4625_1_en-US?highlight=trypsin.
[7] 宋清爽, 吴恩应, 张运佳, 等. 血液制品病毒灭活及去除工艺进展[J]. 生物技术通讯, 2012, 23(4): 627-630.
[8] 安小宁, 高崴. 磁性亲合分离法纯化胰蛋白酶[J]. 现代食品科技, 2007, 23(11): 37-40.
