姜黄素逆转结肠癌HCT-116/5FU 细胞耐药作用机制研究
2020-06-23张鑫杰张闰哲姚庆华
徐 露 张鑫杰 张闰哲 姚庆华
结肠癌(colon cancer,CC)是最为常见的消化道恶性肿瘤之一,占据我国恶性肿瘤发病和致死率的第四位[1]。目前治疗方式仍以化疗为主,而氟尿嘧啶(5-FU)作为中晚期结肠癌最主要的化疗药物,其化疗耐药致使的化疗失败案例并不少见。姜黄活血行气,通经止痛,而姜黄素具有抗氧化、抗炎、抗肿瘤、抗老年痴呆症等作用[2]。本研究旨在观察姜黄素对结肠癌耐药细胞株HCT-116/5FU 细胞增殖、凋亡作用,探讨其逆转耐药的可能机制,报道如下。
1 材 料
1.1 细胞株 人源结肠癌细胞系HCT-116(美国ATCC 公司,批号CCL-247),HCT-116/5FU 耐药株由浙江省中西医结合重点实验室通过HCT-116 亲本株自行培养提供。
1.2 药 品 姜黄素(批号G1304004)购于上海阿拉丁公司;氟尿嘧啶(5-FU,99.97%,批号s1209)购于美国Selleck 公司。姜黄素和5-FU 配置于二甲基亚砜溶液中(姜黄素存储液浓度为100mM;5-FU 存储液浓度为200mM)。
1.3 试 剂 640 培养基(批号8118241)购于美国Gibico 公司,二甲基亚砜(批号67-68-5)、噻唑蓝(MTT)试剂盒(批号3580GR001)购于美国Sigma 公司,Annexin V-FITC/PI 细胞凋亡检测试剂盒(批号8072965)购于美国BD Biosciences 公司,一抗(批号9929T)购于美国cell Signaling 公司,甘油醛-3-磷酸脱氢酶(GAPDH)、鼠二抗及兔二抗(批号A0216、A0208)购于上海碧云天公司。
1.4 仪 器 细胞培养箱(山东BIOBASE 博科,型号QP-160)、酶标仪(山东BIOBASE 博科,型号EL10A)、显微镜(日本奥林巴斯,型号BX43)、流式细胞仪(美国贝克曼库尔特,型号CytoFLEX S)、蛋白电泳系统(美国Bio-Rad,型号1645050)等仪器及设备均由中国科学院大学附属肿瘤医院中西医结合重点实验室提供。
2 方 法
2.1 细胞培养 HCT-116/5FU 常规培养条件:使用含有10%胎牛血清的1640 培养基,予37℃,5% CO2孵箱,另加5-FU 于1640 培养液中配置成100μM 的5-FU 维持培养,所有实验均基于指数生长期细胞。胰酶消化时间3min,传代比例1:2~1:4。
2.2 MTT 法检测细胞增殖 取对数生长期的HCT-116/5FU 细胞,消化后均匀吹打,以3000 个/孔接种在96 孔板中,24h 后加入5-FU 和姜黄素配置成不同摩尔浓度的培养基,48h 后加MTT 20μL 培养箱孵育4h,加入DMSO 150μL,摇匀后使用酶标仪测定其在A570nm 波长处吸光值,并计算细胞生长抑制率。生长抑制率=(对照组A-处理组A)/对照组A×100%。
2.3 流式细胞仪检测 HCT8 细胞的凋亡率HCT-116/5FU 细胞以2×105个/孔接种在6 孔板中,24h 后按四组予以不同药物浓度的培养基进行换液(对照组:不含5-FU 及姜黄素的1640 培养基;5-FU 组:含5-FU 200μM 的1640 培养基;姜黄素组:含姜黄素20μM 的1640 培养基;联合用药组:含5-FU 200μM+姜黄素20μM 的1640 培养基),复孔3 个。换液后48h 收集细胞,加入5μL 50 mg/L Annexin V-FITC和10μL PI,摇匀后避光30min,使用流式细胞仪检测细胞凋亡率。
2.4 蛋白质印迹法(Western blot)检测凋亡相关蛋白表达情况 细胞培养及分组步骤同上,药物干预48h 后收集细胞,使用含有酶抑制剂的RIPA 裂解液提取总蛋白。BCA 试剂盒检测蛋白浓度,使用缓冲剂及双蒸水配齐各样品30μg,95℃变性5min,-20℃保存。电泳使用预制10% SDS-PAGE 凝胶板,电泳(100V 1h),冰浴转膜(200mA 2h),封闭1h,一抗4℃冰箱摇晃过夜,次日二抗室温孵育2h,最后使用Image Lab 软件行图像采集和分析。
2.5 统计学方法 使用SPSS 17.0 及GraphPad Prism 6 软件进行统计分析,计量资料以均数±标准差() 表示,计量资料的两组间均数比较采用t 检验,多组间均数的比较采用单因素方差分析。实验重复3 次,以P<0.05 为差异有统计学意义。
3 结果
3.1 姜黄素联合5-FU 使用后耐药株细胞形态变化HCT-116 亲本细胞株及5-FU 耐药细胞株皆贴壁生长,上皮样单层排列,形态相似。联合姜黄素使用后,细胞增殖受到明显抑制,细胞形态增大,生长速度变缓,且部分细胞呈漂浮状态。见图1。

图1 HCT-116/5FU 细胞形态
3.2 姜黄素与5-FU 联用抑制结肠癌HCT-116 细胞增殖 酶标仪检测吸光度后计算HCT-116 及HCT-116/5FU 细胞株5-FU 作用48h 时的IC50 值,分别为12.78μM、>1000μM(见图2A)。相比单药使用,5-FU 联合姜黄素后,细胞增殖受到明显抑制(P<0.05,见表1)。从图2B 的增殖抑制曲线中选取最佳用药浓度:姜黄素取20μM,5-FU 取200μM。
3.3 姜黄素对耐药株凋亡率影响 流式细胞检测仪结果显示,与对照组比较,5-FU 组、姜黄素组凋亡率有所升高,联合用药组凋亡率显著高于对照组(P<0.01)。联合用药组与5-FU 组、姜黄素组比较,凋亡率明显增加(P<0.05)。见表2,图3。

图2 HCT-116 亲本及耐药株细胞增殖曲线
表1 不同姜黄素、5-FU 浓度及联合用药后HCT-116/5FU细胞活性比较()

表1 不同姜黄素、5-FU 浓度及联合用药后HCT-116/5FU细胞活性比较()
注:单药姜黄素组仅干预规定浓度姜黄素;单药5-FU 组仅干预规定浓度5-FU;联合用药组按照规定浓度同时干预姜黄素和5-FU;5-FU为氟尿嘧啶;姜黄素与5-FU 规定浓度见表格第一、二列;与相同浓度单药组比较,aP<0.05
表2 各组细胞凋亡率比较(%,)

表2 各组细胞凋亡率比较(%,)
注:对照组予不含5-FU 和姜黄素1640 培养基;5-FU 组予含5-FU 200μM 的1640 培养基;姜黄素组予含姜黄素20μM 的1640 培养基;联合用药组予含5-FU 200μM 和姜黄素20μM 的1640 培养基;5-FU 为氟尿嘧啶;与对照组比较,aP<0.01;与5-FU 组、姜黄素组比较,bP<0.05

图3 HCT-116/5FU 细胞凋亡散点图
3.4 蛋白表达水平比较 Western blot 检测结果显示,亲本细胞HCT-116 的IL-6 及STAT3 蛋白表达量明显低于耐药细胞株HCT-116/5FU。干预用药后,5-FU 组IL-6 及STAT3 表达下调,而cleaved-Casepase3 蛋白表达量无明显差异。姜黄素组IL-6及STAT3 蛋白表达下调,并诱导cleaved-Casepase3蛋白表达。两药联合使用时,cleaved-Casepase3 蛋白表达显著上调,IL-6 及STAT3 蛋白表达下调,且表达量的变化较单药组更为明显。见图4。
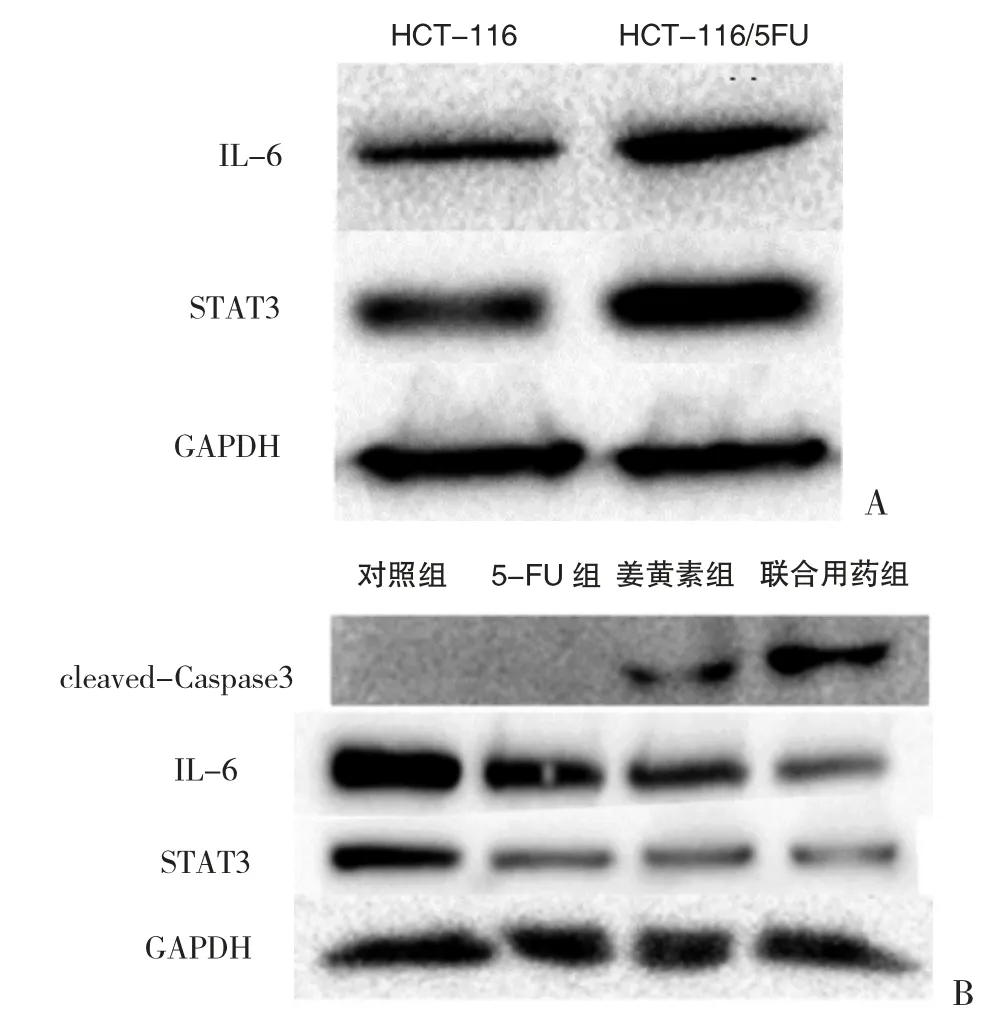
图4 细胞内各蛋白表达差异
4 讨论
5-FU 作为结直肠癌常用化疗药物,其耐药是结直肠癌患者化疗过程中亟待解决的关键问题,这主要由核苷代谢酶异常、代谢活性酶异常、DNA 修复系统激活、肿瘤微环境改变及EGFR-Akt、IL-6/STAT3等信号通路异常所导致[3-5]。而IL-6/STAT3 信号通路被证实参与多种肿瘤发生发展及预后,并有研究指出临床常用的MEK 抑制剂因STAT3 的磷酸化激活导致胰腺癌及肠癌细胞耐药,寻找靶向STAT3 的小分子抑制剂可能是治疗耐药的突破点[6-7]。而有实验证据表明,姜黄素可作为STAT3 小分子抑制剂能通过抑制STAT3 的磷酸化和IL-6 的表达起到双重抑制IL-6/STAT3 通路的作用[8-9]。因此,本研究旨在探究5-FU 耐药是否和IL-6/STAT3 信号通路相关,进一步探索姜黄素是否有逆转耐药的功能。研究结果显示,IL-6 及STAT3 蛋白在耐药株细胞中的表达明显高于亲本株,预示耐药株细胞的耐药特性可能和IL-6/STAT3 信号通路有关。姜黄素能降低HCT-116/5FU 的细胞活性,增加细胞凋亡率,提示姜黄素能逆转HCT-116/5FU 的耐药水平。IL-6、STAT3 蛋白表达量的变化提示姜黄素可能是通过下调IL-6 及STAT3 实现逆转耐药。此外,联合用药组凋亡相关蛋白cleaved-Caspase3 表达增加印证了姜黄素的促凋亡能力,提示姜黄素所致的凋亡可能和Caspase 家族有关。总而言之,姜黄素逆转5-FU 耐药细胞可能和IL-6/STAT3 信号通路有关。
STAT 参与细胞增殖分化、炎症反应等过程,其中STAT3 在肿瘤细胞中研究最广泛[10]。研究表明,STATS 被磷酸化激活后可形成二聚体,入核与启动子结合,调控下游多种靶向基因,参与肿瘤细胞的分化、增殖、凋亡、血管生成、转移及免疫监视等[11-13]。而IL-6 是STAT3 的上游激活因子,是重要的肿瘤抗凋亡因子之一,IL-6 通过活化IL-6Rβ 产生六聚体,继而激发JAKs,而JAKs 反向调节IL-6Rβ 的磷酸化,致使STAT3 激活[14]。STAT3 也是EGFR、IL-6/JAK、Src 等多个致癌性酪氨酸激酶信号通路汇聚的焦点,主导各信号通路间的交互作用使其成为肿瘤发生发展的中心枢纽[15-16]。本研究从IL-6/STAT3 通路出发,探讨姜黄素逆转5-FU 耐药的可能机制。而姜黄素因其低溶解性、结构不稳定性及生物低利用度,导致临床应用受限。现有的临床研究揭示了姜黄素治疗癌症的可能性,为了寻求更好的临床应用方式,需要更具体的研究揭示姜黄素的生物利用度及药理作用[17]。
综上所述,姜黄素能逆转结肠癌细胞株HCT-116/5FU 的5-FU 耐药特性,其机制可能和下调IL-6/STAT3 有关。未来的研究进一步探究姜黄素联合用药后所发生的凋亡率的提高是否单纯与Caspase 半胱氨酸蛋白酶家族有关,同时可更具体的研究IL-6/JAKs/STAT3 通路,定位STAT3 激活过程中核外向核内转移的异常增高。
