M-MOF-74(M=Ni,Co,Zn)的制备及其电化学催化合成氨性能
2020-06-22杨通何小波银凤翔
杨通,何小波,银凤翔,
(1 北京化工大学化学工程学院,北京100029; 2 常州大学石油化工学院,江苏常州213164)
引 言
氨(NH3)不仅是生产氮肥、药物、染料、炸药和树脂的重要原料[1-2],也是一种优异的氢能载体[3],对人类社会发展至关重要。目前工业合成氨主要采用Haber-Bosch 工艺[4],然而该工艺需要高温(400~500℃)、高压(15~25 MPa)[2],不仅消耗大量能源,而且产生大量。因此,开发清洁高效合成氨新途径具有深远意义。
电化学氮还原反应(NRR)被认为是一种极具应用前景的绿色合成氨方法。该方法借助可再生能源产生的电能,在常温常压下以氮气和水为原料,通过电化学催化反应来合成氨[6-8]。然而,由于N2键能较大,需要高效电催化剂来还原N2[9]。贵金属NRR 电催化剂(Ru[10]、Au[11]等)表现出很好的催化活性,但是它们存在较强的析氢(HER)副反应,降低了法拉第效率(FE),并且贵金属昂贵,难以大规模应用。非贵金属或非金属NRR 电催化剂主要有过渡金属氧化物类(Fe2O3/TiO2[12]、MoO3[13]、Cr2O3微球[14]),过渡金属硫化物类(MoS2[15]),非金属类(薄层黑磷纳米片[16]、MXene 纳米片[17]、N 掺杂多孔碳[18])等。这些催化剂不仅具有成本优势,而且催化性能也较好,受到极大关注。如碳布上VN纳米线的NH3生 成 速 率 和FE 可 达2.48×10-10mol·s-1·cm-2和3.58%[19];CoS2纳米颗粒和氮/硫掺杂的还原石墨烯复合催化剂(CoS2/NS-G)在-0.05 V(vs RHE)电势下NH3生 成 速 率 和FE 可 达3.02×10-11mol·s-1·cm-2和25.9%[20]。但是这些催化剂的性能离工业化应用要求还有较大的距离,因此,开发高性能非贵金属催化剂对推动电化学合成氨工业化进程具有重要意义。
金属有机骨架(MOFs)具有高比表面积、可控的孔结构、均匀的结晶度,特别是它的不饱和金属阳离子或金属团簇可以很方便设计成催化活性物种[21],是一类优异的催化材料[22-24]。本文采用水热法合成了三种不同金属的MOF-74(Ni-MOF-74、Zn-MOF-74 和Co-MOF-74),并对所合成的样品进行了结构表征,在0.1 mol·L-1Na2SO4电解液中,评价了它们在常温常压下的电化学合成氨催化性能。结果表明,三种MOF-74 具有较好的电催化合成氨性能,其中,Ni-MOF-74 具有最好的电催化性能,在-0.7 V(vs Ag/AgCl)下最高NH3生产速率为6.68×10-11mol·s-1·cm-2,特别是法拉第效率高达23.69%,该法拉第效率处于已报道合成氨电催化剂的法拉第效率前列。本工作将为MOFs 材料在电催化合成氨中的应用提供新思路。
1 实验部分
1.1 试剂与仪器
试剂:2,5-二羟基对苯二甲酸(H4DOBDC,98.0%) ,Ni(NO3)2·6H2O(98%) ,Co(NO3)2·6H2O(99%),Zn(NO3)2·6H2O(99%),亚硝基铁氰化钠(99%),无水硫酸钠(99%),水杨酸(99.5%),盐酸肼(N2H4·2HCl,98%),酒石酸钾钠(KNaC4H6O6·4H2O,99%),购自上海阿拉丁生化科技股份有限公司;N,N-二甲基甲酰胺(DMF,99.5%)购自江苏强盛功能化学股份有限公司;H2O2(30%),乙醇(99.7%),浓盐酸(AR),购自中国医药集团有限公司;高纯氮气(99.999%),高纯氩气(99.999%),购自常州市武进华阳气体有限公司;15N2(>99%(atom)15N)同位素气体购自上海化工研究院有限公司;次氯酸钠溶液(NaClO,特定级)购自上海凌峰化学试剂有限公司;Nafion 溶液(5%),Nafion 膜(Nafion N-117,厚度0.18 mm),二甲氨基苯甲醛(98%),购自阿法埃莎(中国)化学有限公司;炭黑(Vulcan XC-72)购自Cabot Corporation;碳纸(40%疏水)购自日本东丽株式会社;超纯水自制。
仪器:电化学工作站(CHI 760E,上海辰华仪器有限公司);电子天平(BT25S,赛多利斯公司);紫外可见分光光度计(UV5100B,上海元析仪器有限公司);恒温水浴(DF-101S,巩义市予华仪器有限责任公司);水热反应釜(HT 型,安徽科幂机械科技有限公司);恒温干燥箱(DHG-9070A,上海久工实业有限公司);离心机(TG16G,盐城市凯特实验仪器有限公司);真空干燥箱(DZF-6050,上海精宏实验设备有限公司)。
1.2 样品制备
对文献[25]中的水热法进行了改进,用于本文Ni-, Co-和Zn-MOF-74 的合成。将0.1473 g 的H4DOBDC 和0.7718 g 的Ni(NO3)2·6H2O,加入60 ml的DMF-乙醇-超纯水(1∶1∶1,体积比)混合溶剂中,搅拌,直到混合均匀。然后移入100 ml 的水热反应釜,在100℃下保持24 h 后,自然降至室温,离心除去母液,得到的固体产物用DMF 和甲醇分别洗涤3次。最后,在80℃下真空干燥12 h,就可得到Ni-MOF-74。Co-MOF-74 的合成与上述过程基本相同,除了Co(NH3)2·6H2O 的质量为0.7202 g。在Zn-MOF-74 的合成过程中,需要将0.1577 g 的H4DOBDC 和0.6851 g 的Zn(NO3)2·6H2O 加入31.5 ml的DMF-超纯水(20∶1,体积比)混合溶剂中,其他过程与Ni-MOF-74合成过程相同。
1.3 表征
采用Smartlab9 型X 射线粉末衍射仪(XRD)对样品进行晶相结构分析,射线源为Cu Kα靶,2θ 扫描范围5°~80°。采用FEI Quanta 400FEG型场发射扫描电镜(SEM)观察样品的表面形貌。采用Thermo ESCALAB 250XI 型的X 射线光电子能谱仪(XPS)对样品的表面元素组成和价态进行表征,射线源为Al Kα靶,步长为0.1 eV。采用Micromeritics ASAP 2460型吸附仪在77 K 条件下测定样品的静态N2吸附等温线,来表征其孔径分布、比表面积和孔容。采用Bruker AVANCE Ⅲ型核磁共振波谱仪(500 MHz)来测试15N2同位素标记实验中产生的15NH4+的1H谱。
1.4 电化学测试
1.4.1 工作电极制备 取8 mg催化剂和8 mg炭黑,加入900 μl 乙醇和100 μl Nafion 溶液中,超声30 min,得到混合均匀的悬浊液(称之为ink)。然后将135 μl 的ink 滴加到碳纸上(有效面积为1.5 cm×1.5 cm),最后在室温下干燥24 h,得到催化剂负载量为0.5 mg/cm2的工作电极。
1.4.2 Nafion 膜预处理 将Nafion N-117 膜在80℃的H2O2(5%)水中加热1 h,然后在80℃超纯水中继续加热2 h,最后室温下浸泡于超纯水中,待后续使用。
1.4.3 电催化合成氨 如图1 所示,电催化合成氨采用Nafion N-117 膜分隔的双室电解池,每个室中加入45 ml 的0.1 mol·L-1Na2SO4。以上述制备的工作电极为工作电极,Pt 丝为对电极,KCl 饱和的Ag/AgCl电极为参比电极。在NRR反应之前,将高纯N2鼓泡到电解液中,排出电解液中的氧,0.5 h 后将高纯N2流量设置为20 ml·min-1,持续通入电解池的阴极室中。常温常压下用电化学工作站测试NRR。首先采用线性扫描伏安法(LSV)初步探测催化剂的NRR 活性,速率扫描为5 mV·s-1。然后采用计时电流法测试不同电势下催化剂的NRR 活性,进而测定催化剂的氨生成速率和法拉第效率,每个电势下测试时间为3 h。作为对比,在相同实验条件下,用高纯Ar 代替N2也进行了计时电流法测试。
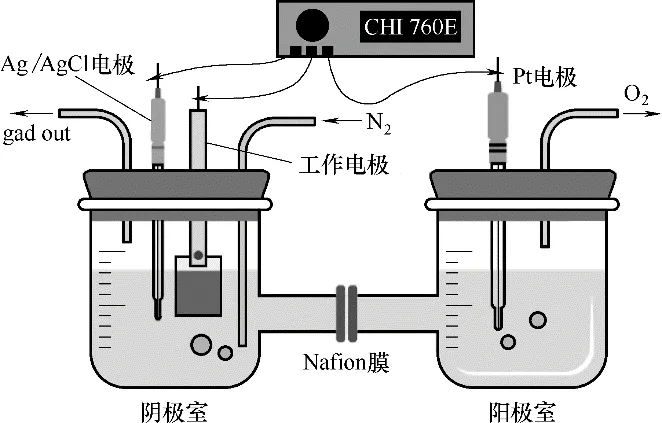
图1 电催化合成氨装置Fig.1 Device of electrocatalytic ammonia synthesis
1.4.4 双层电容和电化学比表面积 测量样品的双层电容(Cdl),以确定其电化学比表面积(ECSA)。在-0.04~0.06 V(vs Ag/AgCl)的电势范围内以2、4、6、8、10 mV·s-1不同扫描速率测量循环伏安图(CV)。电流密度差ΔJ(Ja-Jc)与扫描速率具有线性关系,其斜率是Cdl的两倍。取-0.015 V(vs Ag/AgCl)时的ΔJ,绘制ΔJ-扫描速率图,即可得到Cdl。根据文献[17]中的方法,使用Cs=0.035 mF·cm-2的比电容来估算样品的ECSA(ECSA=Cdl/Cs)。
1.4.5 电化学阻抗 在10 ~105Hz的频率范围内测量电化学阻抗,进而计算样品的电荷转移电阻Rct。
1.5 氨和肼的定量分析
1.5.1 氨的定量分析 反应产生的NH3会溶解到电解液中以NH3·H2O 的形态存在,检测时加入一定量的酸使其全部变为,通过测定NH4+的浓度求出生成NH3的量。本文采用次氯酸钠-水杨酸分光光度法[26]检测浓度。首先,配制显色剂,即含有水杨酸(0.36 mol·L-1)和酒石酸钾钠(0.18 mol·L-1)的NaOH(0.375 mol·L-1)混合溶液;其次,配制次氯酸钠使用液,即含有NaClO(ρCl=3.5 g/L)和NaOH(0.75 mol·L-1)的混合溶液;然后,分别从阴、阳两室各取3 ml 电解液分别加入两支10 ml 比色管中,再分别加入1 ml 显色剂、100 μl 次氯酸钠使用液和100 μl 亚硝基铁氰化钠(1%,质量分数)溶液;最后,用0.005 mol·L-1硫酸稀释至比色管的10 ml 刻度处,均匀混合,暗处放置1 h 后,用紫外可见分光光度计在697 nm波长下测量吸光度。根据上述过程,用一系列已知浓度的NH4Cl 溶液(表1),建立标准NH4+浓度-吸光度曲线,得到本实验的拟合曲线(图2),表明吸光度与浓度有良好的线性关系,从而可以计算出浓度。每次反应后Nafion N-117 膜中的氨也需要检测,将反应后的Nafion N-117 膜在50 ml 的0.005 mol·L-1的H2SO4中浸泡24 h,再检测其中NH4+浓度。所产生氨的总量为阴极室、阳极室和膜中氨的总和。
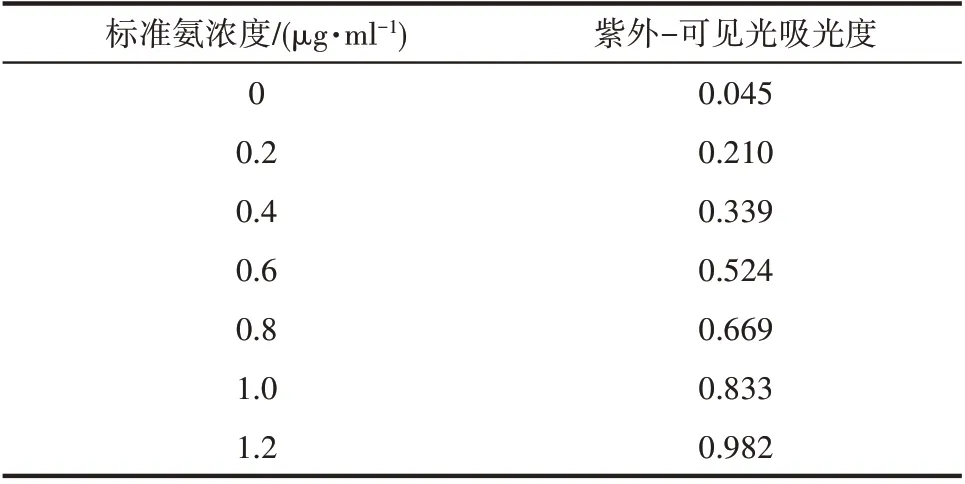
表1 标准氨浓度及其吸光度Table 1 Standard ammonia concentration and its absorbance

图2 用已知浓度的标准氯化铵溶液建立次氯酸钠-水杨酸分光光度法的标准曲线(y=0.7834x+0.0445,R2=0.999)Fig.2 Absolute calibration of sodium hypochlorite-salicylic acid spectrophotometry method using ammonium chloride solutions with known concentration as standard(y=0.7834x+0.0445,R2=0.999)
采用式(1)计算NH3的生成速率RNH3

法拉第效率(FE)定义为:合成过程中,用于合成NH3的电荷量所占通过电极总电荷量的百分比[27]。FE越大,表明合成NH3的选择性越高,计算公式为
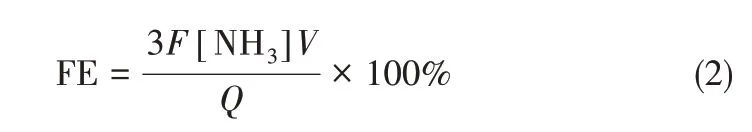
式中,[NH3]是测得的氨浓度,mol·L-1;V 是电解液的体积,L;t 是电解时间,s;S 是负载催化剂碳纸的有效面积,cm2;F 是法拉第常数,96500 C·mol-1;Q是通过电极的电荷量,C。
1.5.2 肼(N2H4)的定量分析 电催化NRR 可能会有副产物N2H4产生,这将干扰NH3的准确计算,因此需要验证反应过程中是否有N2H4生成。电解液中肼的浓度采用Watt-Chrisp[28]方法检测。首先,配制乙醇(200 ml)、浓盐酸(20 ml)和二甲氨基苯甲醛(4.0 g)的混合物作为显色剂。其次,取5 ml 反应后的电解液于50 ml 比色管中,再加入10 ml 上述制备的显色剂,最后用0.12 mol·L-1的盐酸稀释至比色管的50 ml 标线处,混合均匀。20 min 后,在458 nm 波长处测量吸光度。根据上述过程,用盐酸肼制备一系列已知浓度的肼溶液(表2),建立本实验的标准肼溶液浓度-吸光度曲线(图3),用于定量检测反应产生的肼。
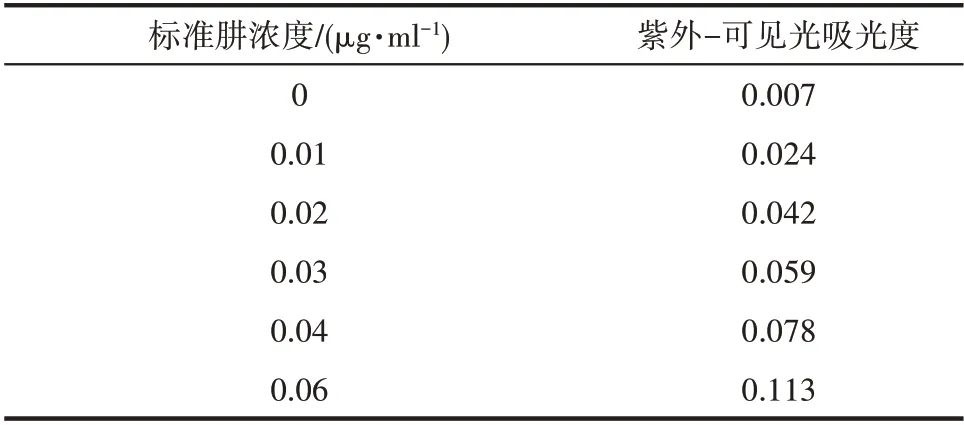
表2 标准肼浓度及其吸光度Table 2 Standard N2H4 concentration and its absorbance
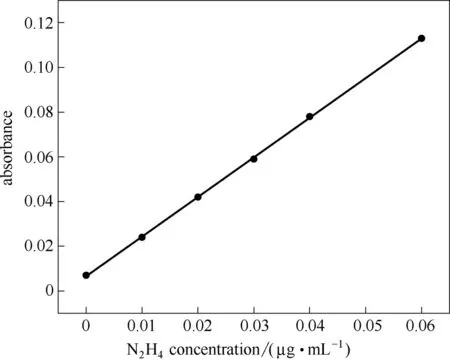
图3 用已知浓度的标准肼溶液建立Watt-Chrisp分光光度法的标准曲线(y=1.7729x+0.0066,R2=0.999)Fig.3 Absolute calibration of Watt-Chrisp spectrophotometry method using N2H4 solutions with known concentration as standard(y=1.7729x+0.0066,R2=0.999)
1.5.315N2同位素标记测试 在同位素标记实验中,将15N2[上海化工研究院有限公司,>99%(atom)15N]用作原料气体来合成氨。在进行电化学反应之前,用高纯Ar 鼓泡到电解液中以去除电解液中的14N2,然后用15N2以5 ml·min-1的流速预饱和电解液30 min(由于15N2同位素气体价格昂贵,在预饱和处理时将流速设置成5 ml·min-1,正式测试时再调节到20 ml·min-1)。在-0.7 V(vs Ag/AgCl)下15N2反应3 h 后,取出35 ml电解液,并用0.5 mol·L-1H2SO4将其pH 调节到3。然后,将酸化后的电解液浓缩至1 ml,再取出0.8 ml 所得液体移入核磁管中,并加入0.1 ml D2O,采用核磁共振波谱仪来检测反应生成的15NH4+的1H谱。
2 实验结果与讨论
2.1 样品表征
图4(a)是所制备的三种MOF-74 的XRD 谱图,在图中也列出了根据晶体结构数据模拟出的Zn-MOF-74 的XRD 标准谱 图[29]。三种MOF-74 的XRD谱图与标准谱图吻合很好,表明成功制备了MOF-74 晶体。图4(b)是三种MOF-74 的N2吸脱附等温线。从图中可以看出,三种样品的N2吸脱附等温线都符合典型的I 型等温线,说明它们均是微孔材料。同时可以观察到等温线在低压区域内(P/P0<0.05)都迅速升高,这表明气体分子很容易吸附在MOF-74 开放的金属位点。图4(c)是样品的孔径分布,从图中可以发现三种MOF-74 的孔径都小于2 nm,证明它们都具有微孔。此外,三种样品的BET 比表面积和孔容列于表3 中。显然Co-MOF-74 的BET 比表面积和孔容最大,Ni-MOF-74 次之,Zn-MOF-74的最小。
图5 是三种MOF-74 的SEM 图片。Ni-MOF-74晶体由许多微小的花状多面体聚集而成,平均粒径约4 μm[图5(a)]。Co-MOF-74 是单相六角柱状颗粒,约150 μm 长、26 μm 宽[图5(b)]。Zn-MOF-74 是直径为10~20 μm的块状颗粒[图5(c)]。
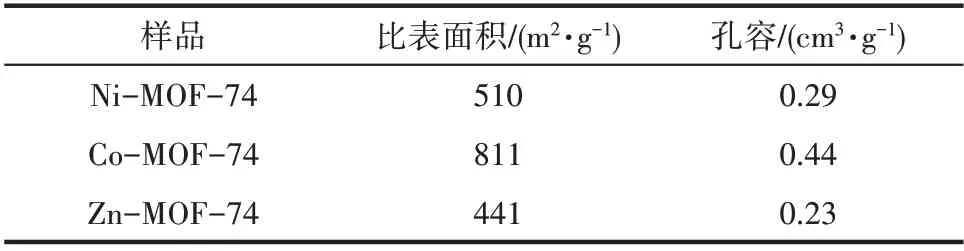
表3 M-MOF-74样品的织构特性Table 3 Textural properties of MOF-74

图4 M-MOF-74的XRD、N2吸附-脱附等温线和DFT 孔径分布Fig.4 XRD,N2 adsorption-desorption isotherms and DFT pore size distribution of M-MOF-74

图5 M-MOF-74的SEM图Fig.5 SEM images of M-MOF-74
图6(a)是三种MOF-74 的XPS 全扫描能谱图,可以看出它们都含有三种元素,即金属(M=Ni,Co,Zn)、C和O,它们的表面百分含量如表4所示。从图6(b)可得,三种MOF-74 的O 1s 都可以拟合为四个峰,依据结合能从低到高,这些峰依次归为金属-氧(M-O)、金属-羟基(M-OH)、C O 和C—OH[30]。Ni-O 峰的相对百分含量最大(40.61%),Co-O 峰次之(30.97%),Zn-O 峰最小(23.51%),说明Ni-MOF-74 中Ni-O 的键 数量要 多于Co-MOF-74 的Co-O 键和Zn-MOF-74 中的Zn-O 键。如图6(c)所示,Ni-MOF-74 的Ni 2p 有两个主峰,集中在873.6 和856.0 eV 附近,分别对应于Ni 2p1/2和Ni 2p3/2;其他两个峰分别位于879.4 和861.0 eV 处,对应于Ni 2p1/2和Ni 2p3/2的卫星峰(表示为Sat.),这些都是Ni2+的特征峰[31]。根 据 图6(d),Co-MOF-74 包 含 两 个 位 于781.6 eV(Co 2p3/2)和797.3 eV(Co 2p1/2)的峰,以及两个卫星峰,这说明其中的Co 主要处于二价状态[32]。由图6(e)可知,两个峰出现在1045.3 和1022.2 eV处,分别对应于Zn 2p1/2和Zn 2p3/2,表明Zn-MOF-74中的Zn为二价[33]。
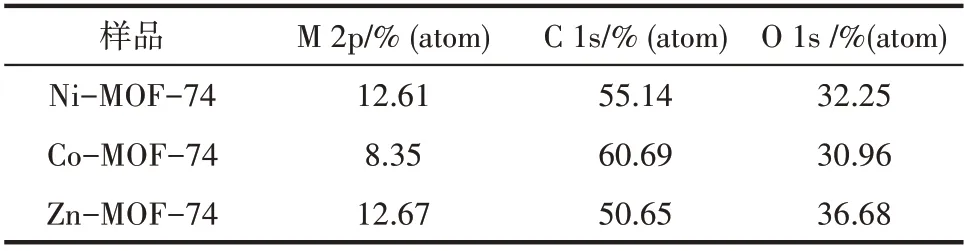
表4 XPS测定的各种元素的表面百分含量Table 4 Surface compositions determined by XPS
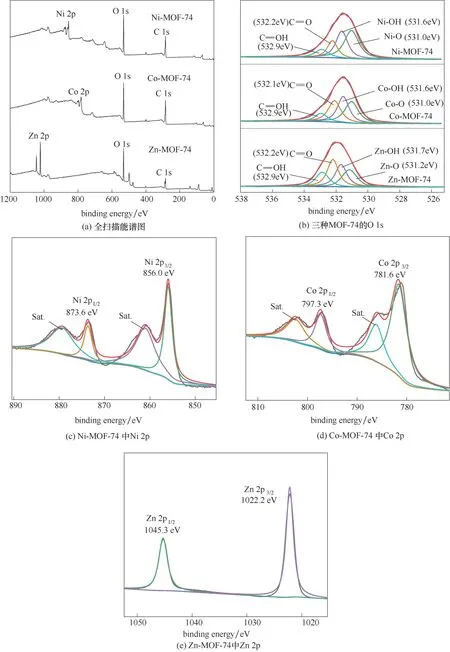
图6 M-MOF-74的XPS图Fig.6 XPS spectra of M-MOF-74
2.2 电催化合成氨性能
进行NRR 电化学测试之前,应该先选择合适的电解液。碱性电解液中,生成的NH3容易挥发,不能准确测定其浓度;酸性电解液中,HER 反应活性比NRR 更高,将影响NRR 的氨生成速率和FE。因此本文所有的电化学测试都在0.1 mol·L-1Na2SO4的中性溶液中进行。
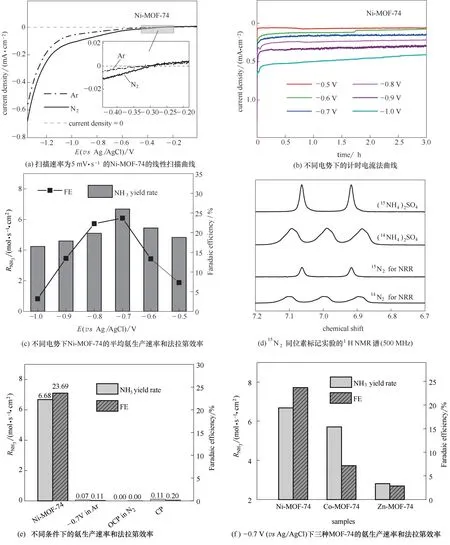
图7 M-MOF-74的电催化合成氨性能Fig.7 Performance of M-MOF-74 for electrocatalytic synthesis of ammonia
为了初步探测样品的NRR 催化活性,测试了Ni-MOF-74的LSV曲线。如图7(a)所示,在N2和Ar饱和条件下,当电势从0 V (vs Ag/AgCl) 逐渐移动到-0.3 V(vs Ag/AgCl)时,开始有较明显的阴极电流出现,说明在N2和Ar 饱和条件下都有析氢反应发生。当电势继续往左移动时,在N2饱和条件下,电流密度显著增大,说明Ni-MOF-74 开始催化N2与H2O生成NH3,即发生NRR。
图7(b)是N2饱和电解液中的计时电流法曲线,从图中可以发现,整个电催化反应过程中,各个电势下的电流密度几乎保持不变,这表明Ni-MOF-74具有很好的NRR 活性稳定性。此外还可以看到,所施加的电势越负,电流密度也越大,这是因为当电势越负时,施加给工作电极的还原反应推动力越大,促使更多的电子参与反应。反应3 h 后,采用紫外可见分光光度计分析电解液中产生的NH3(表5)和可能的副产物肼(表6),结果表明,在电解液中未检测到显著的肼含量,可以忽略肼的影响,所以可以认为NRR 反应的产物是NH3。图7(c)表示的是Ni-MOF-74 的平均氨生成速率(RNH3)和相应的FE。从图中可以看出,随着电势从-0.5 V (vs Ag/AgCl)增加到-0.7 V (vs Ag/AgCl),RNH3和FE 都升高,这是因为在该电势范围内,电势增大,电流密度也增大,从而更多的电子参与反应,并且副反应HER 增加不明显,所以增加的电子大部分参与到了NRR 中。当电势超过-0.7 V (vs Ag/AgCl)时,RNH3和FE 开始下降,这可能是由于HER 逐步占据主导地位,同时生成的H2覆盖了Ni-MOF-74上的部分活性位点,从而阻碍了N2的吸附和还原[34]。在-0.7 V (vs Ag/AgCl)时,RNH3和FE 都达到最大值,分别为6.68×10-11mol·s-1·cm-2和23.69%,高于大多数报道的水溶液体系中的NRR 催化剂的性能,例如,γ-Fe2O3(1.22×10-11mol·s-1·cm-2,1.90%)[35],N掺杂多孔碳(1.94×10-11mol·s-1·cm-2,1.42%)[18],Pd/C (2.21×10-11mol·s-1·cm-2,8.20%)[36],La2O3纳 米 板(2.23×10-11mol·s-1·cm-2,4.76%)[37],铋 纳 米 片(4.12×10-11mol·s-1·cm-2,10.46%)[38],钇掺杂的ZrO2(1.77×10-11mol·s-1·cm-2,12.30%)[39],富含氧空位的TiO2纳米片(5.88×10-11mol·s-1·cm-2,6.50%)[40]等。
为了证明所产生的NH3来自于原料N2,进行了15N2[99% [atom)15N]同位素标记实验。如图7(d)所示,在-0.7 V (vs Ag/AgCl)下连续通入15N2进行反应后,电解液的1H 核磁共振谱(1H NMR)中仅观察到代表15的双峰,而未检测到代表14的三重峰。这证实了反应生成的NH3源自所通入N2的电化学还原。此外,考虑到核磁共振谱的峰面积与氨含量直接相关,对图7(d)中14N2for NRR 的1H NMR 谱和15N2for NRR 的1H NMR 谱分别进行积分,所得面积为3.390 和3.393。通过面积可以计算得到15NH3生成速率为6.686×10-11mol·s-1·cm-2,而用分光光度法测得的15NH3生成速率为6.69×10-11mol·s-1·cm-2,误差为0.0597%,因此证明了分光光度法检测氨浓度是准确的。为了进一步验证所产生的NH3是由Ni-MOF-74电催化N2还原生成的,还进行了一系列控制实验,包括:①用Ni-MOF-74 工作电极在-0.7 V (vs Ag/AgCl)的Ar 饱和电解液中进行反应;②用Ni-MOF-74 工作电极在开路电势(OCP)下于N2饱和电解液中进行反应。实验结果如图7(e)所示,上述两种情况下几乎检测不到NH3产物,进一步说明在以Ni-MOF-74为催化剂的反应过程中,N2饱和电解液中检测到的显著的NH3并不是来源于污染源(如实验室、设备、膜等),而是来源于所通入的N2被Ni-MOF-74 催化还原。此外,还用没有负载催化剂的碳纸(只负载炭黑,标记为“CP”)作为工作电极,在-0.7 V(vs Ag/AgCl)的N2饱和电解液中进行反应。反应后所得的RNH3和FE列于图7(e)中,显然炭黑没有催化NRR作用。
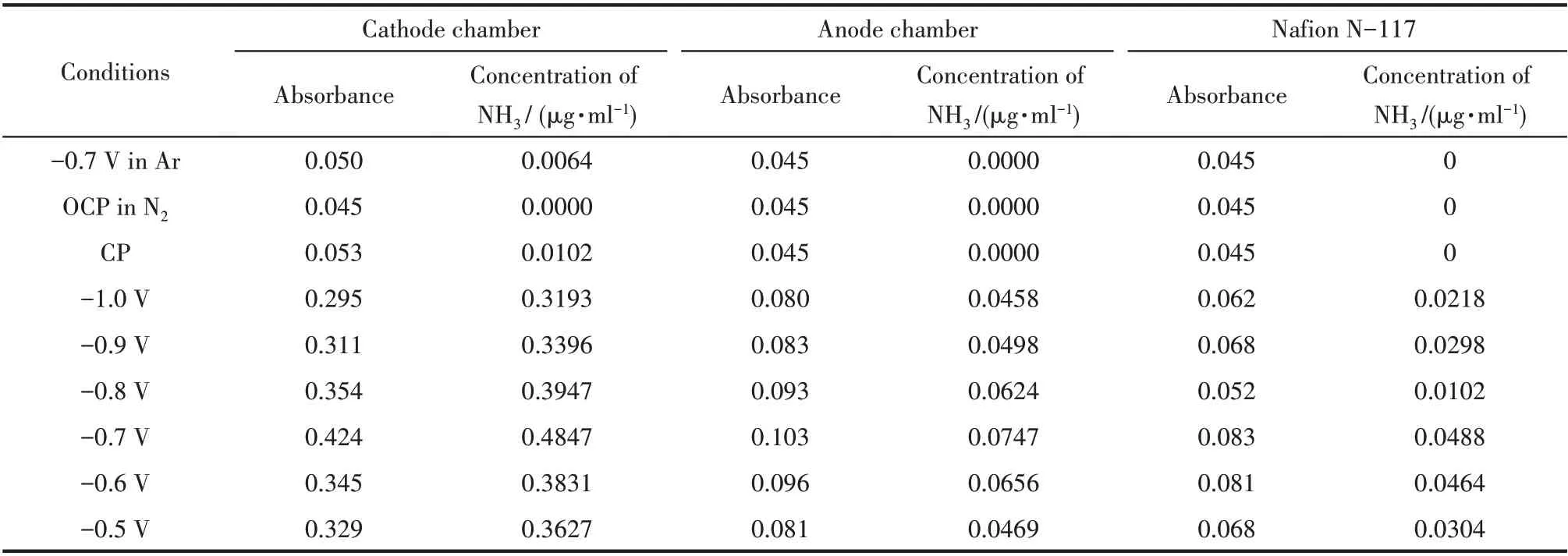
表5 Ni-MOF-74电催化反应后用次氯酸钠-水杨酸分光光度法检测电解液中的紫外-可见吸收光的吸光度Table 5 Determination absorbance of UV-Vis in electrolyte by sodium hypochlorite-salicylic acid spectrophotometry after electrocatalytic reaction for Ni-MOF-74
表6 Ni-MOF-74电催化反应后用Watt-Chrisp法检测电解液中的紫外-可见吸收光的吸光度Table 6 Determination absorbance of UV-Vis in electrolyte by Watt-Chrisp spectrophotometry after electrocatalytic reaction for Ni-MOF-74
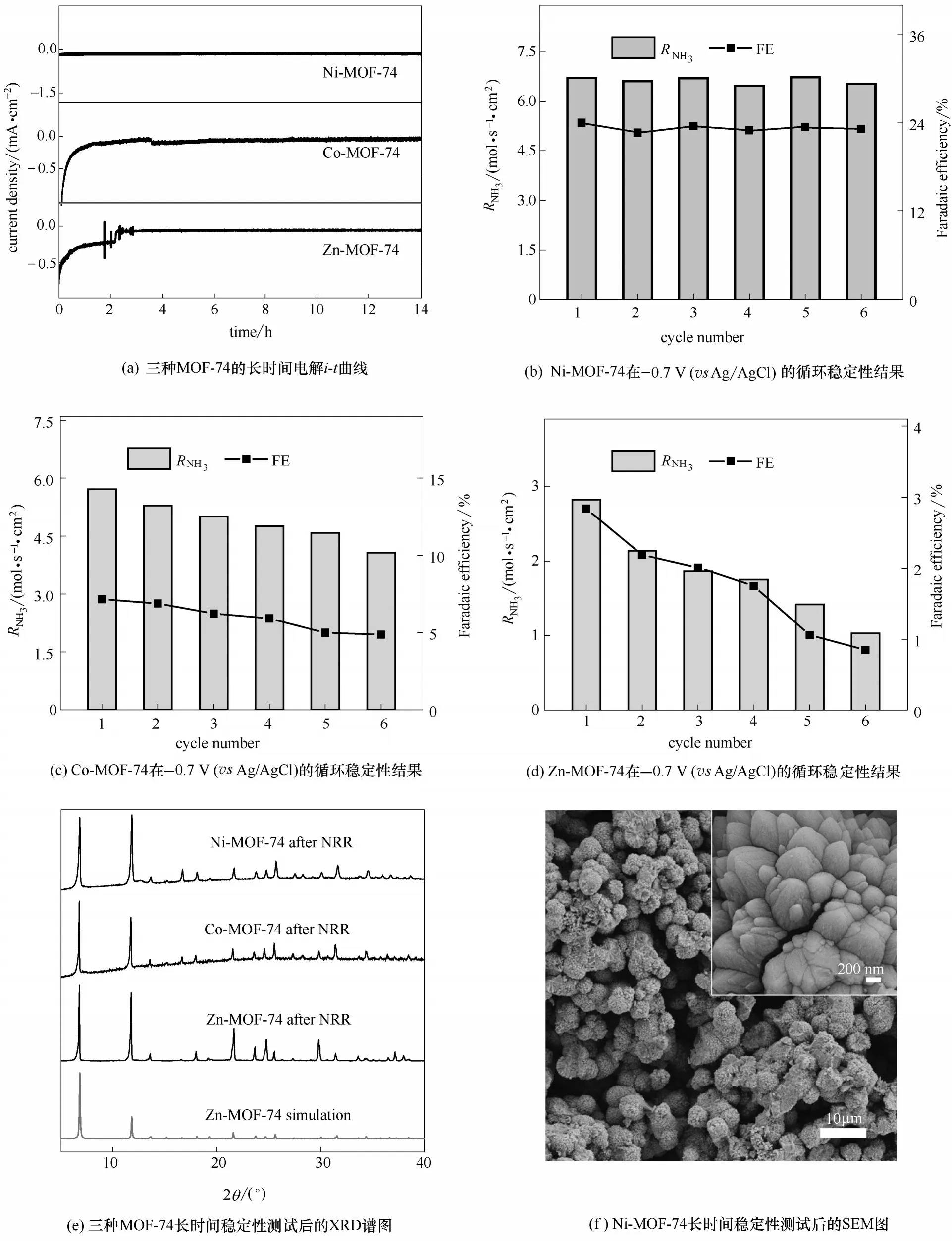

图8 三种MOF-74的稳定性测试及稳定测试后结构表征Fig.8 Stability test and structural characterization after stability test of M-MOF-74
在-0.7 V (vs Ag/AgCl)下对Co-MOF-74 和Zn-MOF-74 也进行了计时电流法测量。实验发现,该电势下,三种样品的RNH3和FE 如图7(f)所示,可以看到,Co-MOF-74 和Zn-MOF-74 的NRR 催化性能(RNH3和FE)都低于Ni-MOF-74。Ni-MOF-74 的FE为23.69%,远大于Co-MOF-74(7.16%)和Zn-MOF-74(2.86%),表明镍基MOF-74 可以极大地抑制HER副反应,从而提高NRR催化选择性。
对于实际应用,NRR 的活性稳定性是一项重要的指标。图8(a)是三种样品的长时间活性稳定性测试曲线,从图中可以发现,在-0.7 V(vs Ag/AgCl)下的N2饱和电解液中,进行了14 h 的反应,Ni-MOF-74 的电流密度只有轻微的下降,RNH3和FE 分别为6.57×10-11mol·s-1·cm-2和22.95%,与最初的值相比,RNH3和FE 仅略有下降,这说明该样品具有很好的活性稳定性。然而,Co-MOF-74 和Zn-MOF-74 在整个电催化反应过程中,电流密度存在较大波动(尤其在前5 h),且反应后的RNH3和FE 严重下降,这说明它们的稳定性比Ni-MOF-74 差。由图8(b)知Ni-MOF-74在-0.7 V(vs Ag/AgCl)下连续6次循环测试期间(每个循环测3 h)的NH3生成速率和FE 的变化很小,而Co-和Zn-MOF-74 在每次循环测试后的NH3生成速率和FE 的都不断减小[图8(c),(d)],说明Ni-MOF-74的电催化活性保持良好。三种MOF-74在长时间稳定测试后的晶体结构都没有改变[图8(e)]。Ni-MOF-74 在反应前后的形貌变化非常微小[图8(f)],而Co-和Zn-MOF-74 颗粒的形貌变化明显[图8(g), (h)],表明Co-和Zn-MOF-74 容易在反应过程中发生催化剂的脱落。
从氮气吸脱附表征分析可知,三种MOF-74 均为微孔材料。与Ni-和Zn-MOF-74 相比,Co-MOF-74 中微孔的孔径更小、数目更多,使其具有最大的BET 比表面积。高的BET 比表面积有利于N2的吸附。然而,Co-MOF-74中极小孔径的微孔可能会影响到电解质离子、生成的NH3分子的传质过程,进而影响其NRR 性能,表明NRR 催化活性与BET 比表面积不存在对应关系,说明还存在别的因素影响催化剂的催化活性。根据图5 的扫描电镜图可知,与Co-或Zn-MOF-74 相比,Ni-MOF-74 的颗粒尺寸最小,分布也最均匀,这意味着Ni-MOF-74 可能暴露更多的表面和边缘NRR 活性位点[17]。其次,从XPS表征分析得知,Ni-MOF-74 中金属-氧键的数量要比Co-或Zn-MOF-74中的多,说明Ni-MOF-74有更多的金属阳离子中心,即能提供更多的路易斯酸活性位点来催化NRR 的发生[41-42]。此外,由图9(a)可知,Ni-MOF-74 的双电层电容为6.4 mF,大于Co-MOF-74(4.9 mF)和Zn-MOF-74(3.75 mF)。双电层电容越大,意味着电化学比表面积也越大,即Ni-MOF-74 具有最大的电化学比表面积,从而暴露出最多的电化学活性位点[11,38]。在MOF-74 的物理表征中,BET 测试表明Co-MOF-74 具有比Ni-MOF-74 更大的比表面积,但电化学测试结果却相反。这是因为电化学比表面积表示用于电荷转移的电极材料的面积,即有效参与某电极反应的那一部分表面,实际发生电化学过程时,有些固体催化剂的内表面往往不能均匀地被活化,BET 比表面积是通过测量气体吸附质可接触到的面积来获得,是多层吸附的结果。与进入电极上催化剂孔隙中的电解质离子相比,BET 测试中吸附质的大小和化学特性几乎总是不同的。因此,BET 的测量值一般不同于电化学比表面积。综上所述,MOF-74中金属-氧键的数量、电化学比表面积以及它们的颗粒大小是影响催化剂催化性能的主要因素。Ni-MOF-74 具有最多的金属-氧键、最大的电化学比表面积以及最小的颗粒尺寸,从而表现出最好的催化活性。
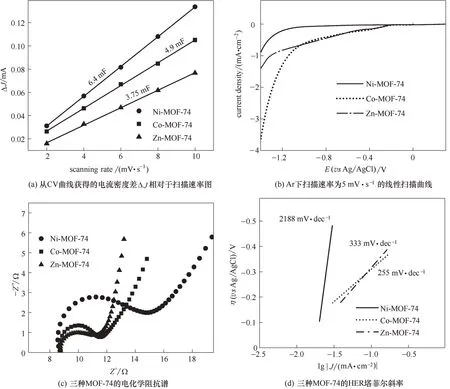
图9 M-MOF-74的电化学性能Fig.9 Electrochemical properties of M-MOF
除了催化活性外,法拉第效率对于NRR 也至关重要。实验结果表明,Ni-MOF-74 的法拉第效率为23.69%,这个值远大于Co-和Zn-MOF-74。图9(b)是三种MOF-74 在Ar 下的LSV 曲线,从图中可以发现Co-MOF-74和Zn-MOF-74在阴极电势下显示出很高的电流密度,这主要归因于HER,因为该反应很容易在阴极电势下的质子环境的中发生。相反地,Ni-MOF-74 在阴极电势下的电流密度却很小,说明Ni-MOF-74 对HER 反应迟钝,即Ni-MOF-74的HER活性相对较差。进一步测量了三种MOF-74的电化学阻抗谱(EIS),以研究它们的电荷转移电阻Rct。如图9(c)所示,与Co-和Zn-MOF-74 相比,Ni-MOF-74 有最大的Rct。Ni-MOF-74 的Rct值经软件拟合计算为3.935 Ω,比Co-MOF-74(1.819 Ω)和Zn-MOF-74(2.111 Ω)的要大。Co-和Zn-MOF-74的Rct值较小,说明它们具有较高导电性,能实现快速电荷转移,从而更有利于加速HER 副反应[17]。这就造成了Co-和Zn-MOF-74 的NRR 法拉第效率很低。相反地,Ni-MOF-74 的Rct值较高,可以有效地抑制其HER 性能。此外,根据M-MOF-74 在Ar 的线性扫描曲线,拟合得到了相应的HER 塔菲尔斜率图。较大的塔菲尔斜率意味着增加相同的电流密度需要较大的过电位,因此塔菲尔斜率越大,表明催化剂的HER 电化学活性越差。从图9(d)可知,Ni-MOF-74 的塔菲尔斜率最大,它的HER 性能最差。综上所述,Ni-MOF-74 的高Rct值,一方面可以抑制其HER 性能,另一方面可以限制催化剂表面(尤其是在活性位点附近)的电子可用性,确保优先吸附N2,从而实现更高的NRR法拉第效率[43]。
3 结 论
通过水热法成功合成了Ni、Co 和Zn 三种金属中心的MOF-74。常温常压下,在0.1 mol·L-1Na2SO4电解液中,以N2和H2O 为原料,研究了三种MOF-74电催化合成氨性能。结果表明,Ni-MOF-74 的电催化合成氨的催化性能最好,Co-MOF-74 次之,Zn-MOF-74 最差。其中,Ni-MOF-74 在-0.7 V (vs Ag/AgCl)下达到最好的催化性能,它的平均NH3生成速率和法拉第效率分别高达6.68×10-11mol·s-1·cm-2和23.69%,主要原因是Ni-MOF-74 具有最多的金属-氧键、最大的电化学比表面积以及最小的分布均匀的颗粒尺寸,同时它还能有效抑制HER 副反应。本工作为研发基于Ni 的金属有机骨架催化材料在固氮领域的应用提供了新途径。
符 号 说 明
Cdl——双电层电容,mF
Cs——比电容,其值为0.035 mF·cm-2
FE——法拉第效率,%
J——电流密度,mA·cm-2
ΔJ——电流密度差(Ja-Jc),mA·cm-2
P——压力,Pa
P0——标准大气压,Pa
Rct——电荷转移电阻,Ω
RNH3——平均氨生成速率,mol·s-1·cm-2
