大黄鱼REL 基因在鳗弧菌侵染后的表达变化分析
2020-06-21江丽华王露萍
刘 刚,江丽华,王露萍
(国家海洋设施养殖工程技术研究中心,浙江舟山 316022)
大黄鱼Larimichthys crocea 属鲈形目Perciformes、石首鱼科Sciaenidae,是福建、浙江一带重要的经济鱼类,也是我国重要的海水养殖品种,被农业部确定为6 种最具优势的出口水产品之一[1]。自上世纪90 年代以来,大黄鱼养殖产业蓬勃发展,然而,随着大黄鱼养殖规模的扩大,各种细菌性疾病发生也日益频繁,严重制约着大黄鱼养殖业的健康发展,其中由弧菌Vibrio alginolyticus 引起的弧菌病是养殖大黄鱼最常见的传染性疾病之一,流行范围广、危害最为严重,发病率和死亡率高,给大黄鱼养殖业带来严重的经济损失[2]。其中,鳗弧菌是感染大黄鱼的主要病原菌之一。
NF-kB 蛋白家族是一类重要的转录因子,能够参与到多种生命活动中,如免疫应答、细胞调亡、信号通路传导以及细胞的发育等。在脊椎动物中,NF-kB 蛋白家族存在5 个成员:RELA、RELB、REL、NF-KB1和NF-kB2。所有的NF-kB 蛋白家族成员都包含一个保守的RHD 结构域,RHD 结构域能够使不同成员间形成同源二聚体或异源二聚体[3]。
NF-kB 作为一种转录复合物,对宿主防御至关重要,其介导物为先天和适应性免疫[4]。NF-kB 参与调控众多编码蛋白的基因,这些蛋白涉及免疫功能、炎症或细胞生长控制,是典型的50 kDa 亚基(p50)和65 kDa (p65)亚基的异质二聚体[5],并且在单核细胞因子表达调控中发挥重要作用。
作为NF-kB 家族成员,REL 可参与维持B 细胞生存[6]、促进T[7]、B[8]细胞增殖和调节T 与B 细胞功能。作为转录因子,REL 基因通过多种靶基因起调节作用。REL 基因同其家族一样,同样包括了RHD 结构域和TAD 结构域,但并不含有ANK 重复结构域。
有关海水养殖动物转录因子的研究,自2004 年在牡蛎Ostrearum 中鉴定了第一个REL/NF-kB 类似物基因以来[9],相继在九孔鲍Haliotis diversicolor sypertext[10]和珠母贝Pinctada fucata[11]中报道了REL/NFkB 家族成员的存在,并证实了它们在其免疫反应中起着重要作用。大黄鱼作为重要的海水养殖鱼类,REL基因在大黄鱼先天免疫系统的作用仍未见报道,本研究旨在揭示大黄鱼REL 基因的特征,从而为了解大黄鱼先天免疫系统提供基础资料。
1 材料与方法
1.1 实验用鱼及鳗弧菌侵染实验
实验所用健康大黄鱼100 尾(约200 g/尾)取自福建沙埕港养殖基地。活鱼解剖并取脑、肌肉、心脏、鳃、肠、肝脏、脾脏和肾8 个组织,低温运输至实验室并转移到-80 ℃超低温冰箱保存备用。
鳗弧菌侵染实验,采用1 龄大黄鱼(500~700 g/尾) 共36 尾,健康无伤病,于循环水箱中暂养1 周以上,饲养期间投喂新鲜小杂鱼。随机平均分为对照组和实验组2 组,每组18 尾。实验组于腹腔内注射鳗弧菌200 μL(PBS 重悬,细胞数约为1.0×107个),对照组注射PBS 200 μL。分别于注射后6,12,24,48,72 和96 h 采样,每组每次随机挑取3 尾,解剖取肝、脾和肾3 个组织,于液氮中速冻后保存于-80 ℃超低温冰箱,用于诱导后不同时间点的组织特异性表达分析实验。
1.2 大黄鱼REL 基因cDNA 序列分析
利用在线软件(http://web.expasy.org/translate/)对REL 的氨基酸序列进行预测。通过Expasy-ProtParam(http://web.expasy.org/protparam/)测定理论分子量(MW)和等电点(pI)。利用在线工具TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)确定是否存在跨膜域。
利用在线工具SMART (http://smart.embl-heide lberg.de/)预测蛋白质的结构域。利用SWISS-MODEL(http://swissmodel.expasy.org/)对三级结构进行了预测。
同源性搜索使用NCBI 的BLASTn (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE_TYPE=BlastSearch)程序和BLASTp(https://blast.ncbi.nlm.nih.gov/blast.cgi? page=protein)进行。
利用ClustalW 对各相关物种进行多重序列比对,并使用ESPript3 (http://espript.ibcp)进行修饰(fr/ESPript/ESPript/index.php)。利用MEGA7 软件邻接法构建系统发育树。
1.3 REL 基因的分子克隆
使用Trizol Total RNA Kit(Invitrogen,USA)按照说明从检查的组织中分离RNA。通过UV-分光光度计(Eppendorf,Germany)测量RNA 浓度,并通过观察18 s 和28 s 核糖体RNA 的强度,通过1%琼脂糖凝胶分析RNA 的质量。然后按照说明书使用M-MLV RTase cDNA Synthesis Kit(TaKaRa,Japan)合成cDNA。使用Primer5.064 软件设计PCR 引物,其根据来自大黄鱼全基因组数据的REL 的CDS 序列设计。使用所需组织的cDNA 作为模板,使用热循环仪(Bio-Rad,USA)在以下条件下进行PCR 扩增:50 ℃、2 min;95 ℃、30 s,然后40 个循环95 ℃、15 s,58 ℃、45 s,95 ℃、15 s,最后在72 ℃延伸5 min。
1.4 实时荧光定量PCR 并进行统计学分析
通过qPCR 确定REL 的组织特异性分布和一定时间内mRNA 表达。使用PrimeScriptTM RT 试剂盒(Tli RNaseH Plus,TaKaRa,中国)并按照说明,以20 μL 的终体积逆转录2 μg RNA 样品。然后在含有0.8 μL引物-F(10 μmol·L-1),0.8 μL 引物-R(10 μmol·L-1),8II 的20 μL 反应混合物中进行荧光定量实验。1 μL cDNA 样品(100 ng·μL-1),0.4 μL ROXII 和9 μL ddH2O(试剂浓度参见其制造商的说明书)一式三份。用引物β-actin-R 和β-actin-F 扩增的参考基因β-actin 来规范化REL 的表达。
所有数据采用Livak 和Schmittgen(2001)方法进行分析,得到相关的mRNA 表达量。将肌肉中的mRNA 表达作为对照,与各种组织进行比较,0~96 h 时间点构成对鳗弧菌感染挑战的对照。采用SPSS Statistics 19 (IBM)进行t 检验,以确定实验组与对照组之间观察到的差异的统计学意义,以P<0.05 为具有显著性差异。
2 实验结果
2.1 REL 基因的特性描述
REL 基因由611 bp 核苷酸组成,编码204 aa,预测的pI 为6.58,理论分子量为69.153 kDa。谷氨酰胺(9.0%),天冬酰胺(8.5%),脯氨酸和丝氨酸含量相同(7.7%),这4 种是该肽链中发现的最丰富的氨基酸残基。其带负电荷的残基(Asp+Glu)的总数为65,而带正电荷的残基(Arg+Glu)的总数为62。其次,Index 指数为46.60,表明不稳定。脂肪族指数为61.87,GRAVY 为-0.868。SignalP 4.1 online tool and THMM server未预测出REL 中有任何信号肽序列。
2.2 多重序列比对和系统进化树分析
进行三维结构模型预测后,发现N 末端的DBD 在不同物种中是高度保守的,并且在所有IRF 中都发现了几个保守氨基酸,包括多个色氨酸残基。多重比对和氨基酸同一性比较表明,推导出的REL 的氨基酸序列与来自其他硬骨鱼类物种的同源物具有高度同一性。在REL 基因中,第21~27 个氨基酸处具有其家族特征性序列:“FRYKCEG”,表明其高度保守,见图1。

图1 大黄鱼与其它物种REL 基因氨基酸序列比对Fig.1 Comparison of amino acid sequences of REL gene between L.crocea and other species
使用来自多种脊椎动物的IRF 同源物的氨基酸序列构建系统发育树,对比常见硬骨鱼类。系统发育关系分析表明,大黄鱼REL 基因的编码蛋白序列同牙鲆Paralichtys olivaceus 具有一定相似性,但相似性较低,与其他物种更是差异明显,见图2。

图2 基于REL 氨基酸序列构建系统进化树(NJ 法)Fig.2 Building a phylogenetic tree based on REL amino acid sequences
2.3 鳗弧菌侵染前后,大黄鱼REL 基因的组织表达
通过使用qPCR 分析来自未受鳗弧菌侵染的大黄鱼的多种不同组织(对照组)来评估REL 的组织特异性分布,见图3。
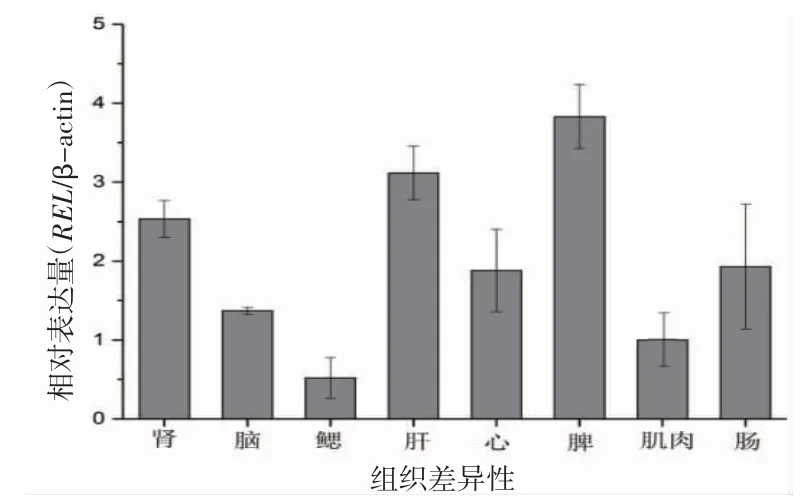
图3 鳗弧菌侵染前qRT-PCR 检测大黄鱼REL 基因的组织表达Fig.3 Detection of REL gene expression in L.crocea by qRT-PCR before V.anguillarum infection
由图3 看出,对照组中大黄鱼肾、脑、鳃、肝、心脏、脾、肌肉以及肠中均有REL 基因表达,在三大组织脾、肝、肾中高表达,在脑、肠和心脏中呈中等表达,而鳃中低表达。
我们通过分析健康大黄鱼中组织的基因表达,从鱼体中收集脾、肝、肾组织,感染鳗弧菌后,在6,12,24,48,72 和96 h 时的组织表达变化,见图4。
图4 显示,受鳗弧菌感染后,大黄鱼REL 基因在0~24 h内,脾和肾表达量逐步升高,脾的表达量在24 h 左右到达其峰值,然后在24 h 以后快速回落。肝脏中,REL 基因在0~12 h内,表达量逐渐升高,12 h 后,表达量呈下降趋势,逐渐降低。而肾脏中,REL 的表达量在0~24 h 内逐渐提高,24~48 h 内,表达量趋于稳定,48 h 后,表达量逐渐回落。

图4 大黄鱼脾、肝、肾组织受鳗弧菌感染后随时间变化的表达量Fig.4 Expression of spleen,liver and kidney tissues of large yellow croaker with time after infection with Vibrio anguillarum
3 讨论
随着鱼类养殖规模的扩大和养殖环境的恶化,近年来鱼病防治形势日趋严峻。鱼类专家从鱼体免疫机理着手,通过增强鱼体抗病、抗逆能力来提高养殖产量和质量,其中细胞因子是研究热点之一[12]。REL 基因是NF-kB 转录因子家族的成员,其n 端含有2 个c 端激活域,REL 家族成员的一个共同特征是含有1 个RHD 结构域,此结构域在不同物种之间高度保守,其功能是参与REL/NF-kB 蛋白与DNA 的结合以及蛋白的二聚体化[13]。RHD 也含有一个核定位信号,负责将蛋白从细胞质转入细胞核内。
目前,REL 基因在人类和小鼠研究中有见报道,但在其他哺乳动物、鸟类和鱼类等物种中研究案例较少。在人类研究中,REL 基因在b 细胞淋巴瘤中被扩增或突变,包括霍奇金淋巴瘤等。在多种细胞类型中,c-REL 以p50 的同二聚体或异二聚体的形式存在,很少与RELA 一起存在。含有c-REL 的二聚体与一组相关的9~10 bp DNA 序列(kB 位点)结合,调控众多细胞基因的表达,包括许多涉及淋巴细胞发育、增殖和生存的基因。虽然跨物种的c-REL 蛋白的REL 同源域序列具有高度保守性,但其c 端激活域并不保守。因此,不同物种间c-REL 蛋白的DNA 结合特异性可能非常相似,但其失活区域的性质和调控可能会有所不同[14]。对小鼠中的REL 基因研究案例较少,张辉等[15]成功构建了小鼠RelA 基因的RNA 干扰慢病毒载体,当小鼠成骨细胞RelA 基因表达被干扰,NF-kB 通路被抑制后,小鼠成骨细胞成骨相关基因ALP、OCN的表达明显上升,成骨功能增强,同时成骨基因的表达明显下降,其介导的破骨细胞骨吸收功能减弱。
除了人和小鼠之外,对REL 基因的报道还有中国明对虾Fenneropenaeus chinensis 以及草鱼Ctenopharyngodon idella、文昌鱼Branchiostoma lanceolaturm,还包括少量单细胞动物。
在中国明对虾研究中,获得的中国明对虾REL 基因的cDNA 片段所推导的氨基酸序列含有一个完整的RHD 结构域[16],这和我们在大黄鱼及其他物种中推导出的相一致,都具有完整的RHD 结构域。经过聚类分析发现它与果蝇的亲缘关系最近,而我们通过进化树发现大黄鱼除了与其同属种外,同牙鲆亲缘关系较为密切。淋巴器官是对虾重要的免疫器官,受到弧菌感染后,对虾的免疫器官出现明显上调,而大黄鱼有着较为完整的免疫器官,其先天免疫系统较为完善,肝脏和脾脏是其重要的防御器官。
王海舟[17]在草鱼NF-kB 信号通路中发现草鱼NF-kB 3 个亚基在进化中保守,且都与鱼类的亲缘性高。在受到Poly I:C 和LPS 刺激下,草鱼各组织中的c-REL 基因表达水平上调,说明它们与草鱼的抗病毒或抗菌的生理过程有关。
基因共线性与基因结构比较分析结果显示文昌鱼REL 基因与人类RELB 基因直系同源,与人类的RELA 和REL 基因是旁系同源关系。在文昌鱼REL 蛋白中,未发现NLS 的存在,TAD 结构域不是很保守,这与大黄鱼及其他物种是不同的。在进化的过程中,REL 亚家族基因的保守序列片段发生规律性的改变,并受到较强的纯化选择[3]。
实验证明鳗弧菌侵染大黄鱼后,主要组织都会引起应激反应,并进行不同程度的表达。而引起的免疫反应中,脾和肝脏表达变化幅度较大,推测二者可能是主要的参与器官。说明REL 基因在大黄鱼体内可能参与其他先天性免疫防疫系统的协同过程。大黄鱼免疫基因信息的充分解析有利于为我国大黄鱼基因组学研究提供理论支撑,有助于发现与抗病害相关的免疫基因位点,通过对这些免疫基因位点优良等位基因的聚合和选育,培育出先天免疫能力强、抗病力高的大黄鱼抗病品系。
4 结论
本文获得了长度为611 bp 的大黄鱼REL 基因cDNA 序列,共编码204 个氨基酸,未发现其信号肽序列。氨基酸序列多重比对表明大黄鱼REL 基因具有该家族特征性序列,而进化树关系显示,大黄鱼REL基因的编码蛋白序列同牙鲆亲缘关系较近。荧光定量PCR 检测结果显示健康大黄鱼REL 基因在肝、脑和鳃中高表达,脾中少量表达。经鳗弧菌感染后,脾和肝中的REL 基因表达量差异显著,应激明显,提示大黄鱼REL 基因表达与病原菌感染密切相关,并在免疫系统中扮演了一定的角色,为研究NF-kB 家族基因在其他鱼类中的作用提供了基础资料,为进一步了解硬骨鱼种的先天免疫系统提供了理论依据,并为提高海水养殖大黄鱼的抗病能力提供基础资料。
