酶解南极磷虾蛋白制备ACE 抑制肽的工艺研究
2020-06-21赵国旭乔倩倩赵玉勤
张 伦,赵国旭,乔倩倩,王 斌,赵玉勤
(浙江海洋大学食品与医药学院,浙江舟山 316022)
南极磷虾Euphausia superba 位于南大洋西南大西洋地区,是鲸鱼、企鹅和海豹的主要食物,也是商业捕鱼物种(如鲭鱼、冰鱼)的主要食物来源,南极磷虾也是一种渔业目标物种,其种类约有8 种,统称为南极磷虾,其中数量占最大优势的为南极大磷虾,一般所称南极磷虾通常指南极大磷虾。而且,目前磷虾还未经过大规模的开发,据估计其生物量为3.42~5.36 亿吨[1],具有极大的应用和开发潜力[2]。根据刘志东等文献可知南极磷虾的蛋白含量为11.9%~15.4%[3],含有全部的人体必需氨基酸,必需氨基酸的总量达到212.1 mg·g-1蛋白质[4],具有极高的利用价值和经济效益。
血管紧张素转换酶(ACE)是一种锌蛋白酶,在调节血压中起着重要作用。ACE 水解血管紧张素-I 形成有效的血管收缩剂血管紧张素II,使抗高血压血管扩张剂缓激肽失活[5]。因此,抑制血管紧张素转换酶活性被认为是有效的预防高血压。ACE 抑制剂通过抑制人体内ACE 酶的活性,钝化舒缓激肽的,减少血管紧张素Ⅱ的合成,达到使血压上升的目的[6-7]。因此,合成的血管紧张素转换酶抑制剂,如卡托普利、依那普利和赖诺普利已被用于治疗高血压,但同时在临床上会带来显著的副作用,如头痛,恶心,发热,皮疹等[8-9]。因此,目前正在开发可通过食品蛋白酶水解获得的ACE 抑制剂,其具有安全,低毒,低过敏性等优势,并且已从玉米[10]、魔芋[11]、带鱼脊骨[12]、沙丁鱼[13]等多种不同食物蛋白中获得了具有ACE 抑制活性的肽序列。以ACE抑制肽作为主要成分开发具有降血压效果的保健食品,在临床上可作为一种预防和辅助治疗高血压的新型手段[14-15]。
ACE 抑制肽在原蛋白序列中不具有活性,但是可以通过酶水解方法从原蛋白中释放出来。然而已知ACE 抑制肽没有固定或统一氨基酸序列组成,并且酶解产物中的组分也较为复杂,增加了ACE 抑制肽的制备难度。因此,从南极磷虾中制备、筛选高效的ACE 抑制肽具有显著的应用价值和理论意义,值得进一步深入研究。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
南极磷虾粉,由浙江海力生集团有限公司提供。
1.1.2 实验试剂
实验试剂如表1 所示。

表1 实验试剂Tab.1 The experimental reagents
1.1.3 实验仪器
实验仪器如表2 所示。

表2 实验仪器Tab.2 The experimental instrumernts
1.2 实验方法
1.2.1 工艺流程
南极磷虾→酶解→100 ℃灭活→冷却→离心→上清液→测定其ACE 抑制活性。
1.2.2 HPLC 法测定ACE 抑制活性[16]
1.2.2.1 试剂的配制
0.1mol·L-1硼酸缓冲液(pH 8.3,0.3 mol·L-1NaCl):
(1)称取12.37 g 硼酸固体,加热溶解后定容至100 mL 备用;
(2)称取1.907 g 硼砂(Na2B4O7·10H2O),加热溶解后定容至100 mL 备用;
(3)量取17.5 mL 硼砂溶液和32.5 mL 硼酸溶液混匀,HCl 或者NaOH 调节pH 至8.3,然后再加入1.753 2 g NaCl,定容至100 mL 即可;
1 mmol·L-1马尿酸标准液:称取适量的马尿酸标准品,以超纯水为溶剂,配制成1 mmol·L-1马尿酸标准液,置于4 ℃冰箱,备用;
0.1U·mL-1ACE 溶液:将0.1 U ACE 溶于1 mL 0.1 mol·L-1硼酸缓冲液(pH 8.3,0.3 mol·L-1NaCl)中,即可得到0.1 U·mL-1ACE 溶液,-20 ℃保存备用;
5 mmol·L-1HHL 溶液:称取适量的HHL,以0.1 mol·L-1硼酸缓冲液(pH 8.3,含0.3 mol·L-1NaCl)为溶剂,配成5 mmol·L-1的HHL 溶液,-20℃保存备用;
活性肽溶液:称取适量的活性肽粉末,以0.1 mol·L-1硼酸缓冲液(pH 8.3,含0.3 mol·L-1NaCl)为溶剂配制成一系列浓度的活性肽溶液;
卡托普利溶液:称取适量卡托普利,以0.1 mol·L-1硼酸缓冲液(pH 8.3,含0.3 mol·L-1NaCl)为溶剂配制成一定浓度的卡托普利溶液。
1.2.2.2 检测原理
在体外37 ℃条件下,ACE 能催化其底物类似物马尿酰-组氨酰-亮氨酸(HHL)产生马尿酸(HA),HA在228 nm 处有特征吸收峰。当有ACE 抑制剂(ACEI)存在时,ACE 活性受到抑制,HA 的生成量会减少,可通过判断HA 的生成量来评价ACE 抑制活性的大小。
HPLC 法测定时,通过计算加入ACEI 前后马尿酸的峰面积差值来确定ACE 抑制率。
1.2.2.3 色谱条件
色谱柱:ZORBAX SB-C18 分析型色谱柱(填料粒径5 μm 4.6 × 250 mm);检测波长:228 nm,流速:1.0 mL·min-1;
流动相A:乙腈(含0.1%三氟乙酸),流动相B:超纯水(含0.1%三氟乙酸),采用等度洗脱方式,流动相A与流动相B 的流动相体积比为25:75;
柱温:25 ℃;自动进样,进样量:10 μL。
1.2.2.4 检测方法
参考吴建平等[16]的方法采用HPLC 法测定ACE 抑制活性,所有实验均在1.5 mL EP 管中进行。将180 μL HHL溶液和30 μL 样品溶液置于1.5 mL EP 管中,于37 ℃水浴中预热5 min,加入15 μL 0.1 U·mL-1的ACE 溶液于37 ℃恒温水浴反应1 h,反应完成后加入225 μL 1mol·L-1HCl 溶液停止反应,即可得到抑制剂反应液。反应液通过0.45 μm 的滤膜,置于进样瓶中,加入进样系统。同时用30 μL 硼酸缓冲盐溶液(0.1 mol·L-1,pH 8.3,含0.3 mol·L-1NaCl)替代抑制剂溶液作空白对照组。
ACE 抑制活性计算公式如下:
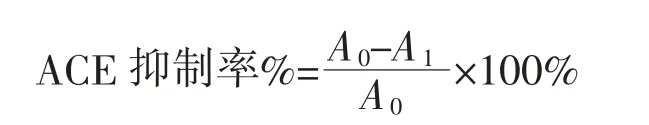
式中:A0为空白组中马尿酸的峰面积(mAU·s);A1为抑制剂组中马尿酸的峰面积(mAU·s);
IC50指的是在一定条件下抑制ACE 酶活性一半时所需要的抑制剂的浓度。并且得出的抑制率与制剂浓度之间并不存在一个线性关系,因此必须通过做出有关抑制剂浓度与抑制率关系的曲线图,再从图中查出IC50,并对得出的结果都进行了3 次重复测量。
1.2.2.5 方法验证
(1)马尿酸与HHL 保留时间验证
将马尿酸标准品和HHL 溶液按照上述色谱条件和方法进样,确定二者保留时间。
(2)马尿酸标准曲线和线性回归
将1 mmol·L-1马尿酸标准液用超纯水稀释成系列梯度浓度的马尿酸溶液:0.5、0.1、0.05、0.01 以及0.005 mmol·L-1,经0.45μm 滤膜过滤后依照3.2.2.4 的色谱方法进样,并以马尿酸峰面积y 对马尿酸标准溶液的浓度x 进行线性回归。
(3)卡托普利ACE 抑制活性的测定
将用硼酸缓冲液配制成的不同浓度的卡托普利溶液(0.01、0.03、0.05、0.07、0.10、0.13、0.15 μmol·L-1),ACE,HHL,HCl 溶液按照上述方法和色谱条件加入到进样系统中。
1.2.3 酶解蛋白筛选
以5 种单酶:胰蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶和胃蛋白酶在各自最佳酶解条件下进行酶解,测定反应液的ACE 抑制活性来确定最适酶解蛋白,如表3。
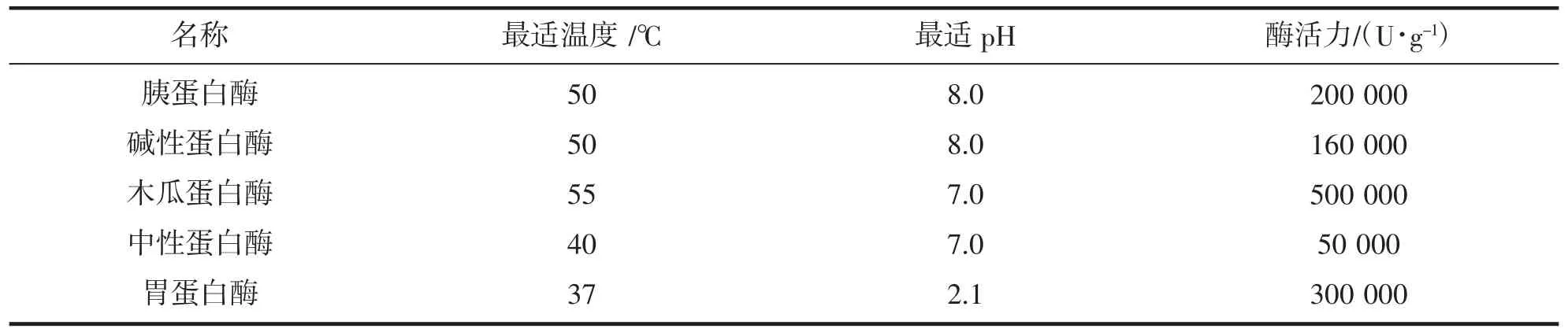
表3 5 种蛋白酶的酶活力及最适温度和pHTab.3 The enzyme activity,optimum temperature and pH of the five enzymes
1.2.4 酶解工艺优化
以1.0 mg·mL-1酶解物的ACE 抑制活性为指标筛选出最佳蛋白酶后,根据响应模型试验设计原理,确定时间(X1)、温度(X2)、pH(X3)、加酶量(X4)以及料液比(X5)4 个因素为影响1.0 mg·mL-1酶解物的ACE 抑制活性的因素,并且依据二次回归中心组合设计5 因素3 水平的实验。采用软件Design Expert 8.0.6 对酶解工艺进行数据处理。响应面试验因素水平设计如表4。

表4 Box-Behnken 试验因素水平表Tab.4 Factors and levels in Box-Behnken experimental design
2 结果与分析
2.1 ACE 抑制活性的测定
2.1.1 马尿酸和HHL 的色谱分离
取1 mmol·L-1的马尿酸标准液、5 mmol·L-1HHL 溶液以及0.5 mmol·L-1马尿酸和5 mmol·L-1HHL 的混合液,经0.45 μm 滤膜过滤后依照1.2.2.4 的色谱方法进样,结果如图1。
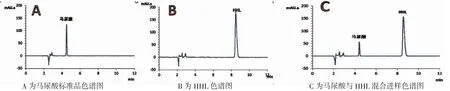
图1 马尿酸与HHL 色谱图Fig.1 The chromatogram about HA and HHL
图1 显示:马尿酸的保留时间为4.43 min,HHL 的保留时间为8.59 min,峰型较好;马尿酸和HHL 混合物色谱图看出二者的出峰时间稳定,在上述色谱条件下能有效地分离开,不影响马尿酸的生成量。
2.1.2 马尿酸标准曲线的绘制
马尿酸标准液处理后在HPLC 系统上进样分析,以马尿酸的含量即峰面积(mAU·s)对浓度进行线性回归,绘制标准曲线,结果见图2。
图2 可以看出:马尿酸的峰面积y(mAU·s)与马尿酸的浓度x(m mol·L-1)的线性回归方程为:y=6 052x-4.942 9,R2=0.999 8,说明马尿酸的峰面积和其浓度呈现出较好的线性关系。因此可以采用此方法测定样品中马尿酸的峰面积,从而测定样品的ACE 抑制活性。

图2 马尿酸标准曲线Fig.2 The linear relation of HA concentration and peak area
2.1.3 卡托普利ACE 抑制率的测定
根据1.2.2.3 和1.2.2.4 的色谱条件和方法下,通过对卡托普利进行ACE 抑制活性的测定,并分析,结果见图3。
从图3 可知:卡托普利的IC50值为18 nM,这与文献[16] 中所报道的卡托普利的体外IC50为7.5×10-10~2.2×10-8mol·L-1相符,进一步证明了该测定方法的可信度和准确性,可采用该方法进行下一步实验。


图3 卡托普利对ACE 的抑制活性Fig.3 Effect of Captopril on ACE inhibitory activity
在1.2.2.3 和1.2.2.4 的色谱条件和方法下,进行ACE 抑制活性的测定,色谱结果见图4。图4a 为空白样品的对照图,该图显示ACE 与底物HHL 反应生成马尿酸的量;图4b 为卡托普利对照图,显示加入卡托普利后马尿酸的生成量,图中马尿酸的峰面积较小,说明卡托普利有效地抑制了ACE 的活性,阻止了其与底物反应;图4c 为降压肽样品图,该图显示加入降压肽后马尿酸的生成量减少,峰面积较小,说明降压肽能抑制ACE 的活性。综合图3 可以看出:样品和卡托普利都有较好的ACE 抑制活性;相同样品浓度下,加入卡托普利后的峰面积比加入降压肽后的峰面积小,说明同等条件下卡托普利比样品的抑制活性略好,但肽与卡托普利相比具有溶解性好,起效快,可直接进入细胞等优点,并且少了临床上的些副作用,因此采用南极磷虾ACE 抑制肽继续进行研究。

图4 ACE 抑制活性色谱图Fig.4 The chromatogram of ACE inhibitory activity
2.2 最佳蛋白酶的筛选
将南极磷虾粉分别用胰蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和胃蛋白酶在各自的最佳水解条件下进行酶解,即在相同的酶解时间和料液比条件下按照图2 进行酶解。根据1.0 mg·mL-1酶解物的ACE 抑制率为指标筛选最佳酶解蛋白,结果见图5。
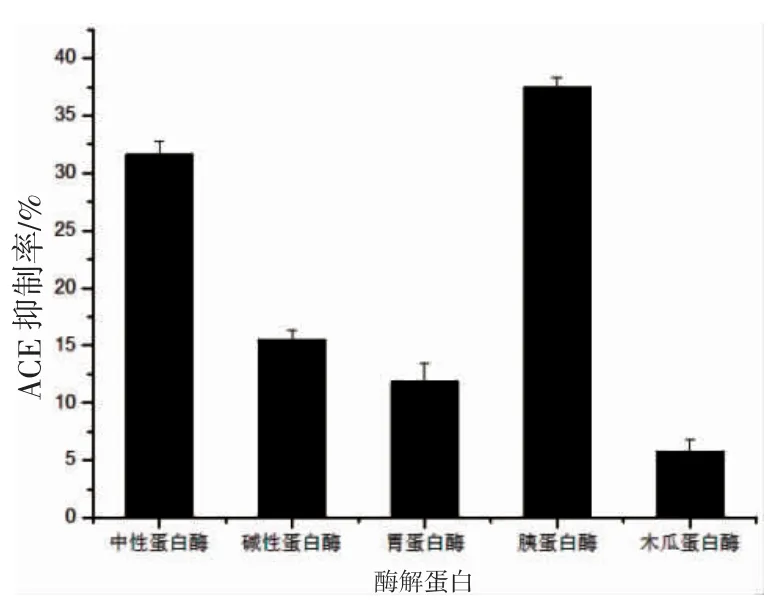
图5 5 种酶解产物对ACE 抑制率的影响Fig.5 Effect of five hydrolysates on ACE inhibition rate
图5 结果显示:5 种蛋白酶在各自最佳酶解条件下进行酶解,测定反应液的ACE 抑制活性,木瓜蛋白酶其酶解产物的ACE 抑制率最低,说明其酶解生成的多肽大多不具有抑制ACE酶活的作用;胃蛋白酶和碱性蛋白酶水解后的抑制活性相近也略低;中性蛋白酶的ACE 抑制活性较好达到了30%以上;胰蛋白酶水解南极磷虾的ACE 抑制活性最好,在1.0 mg·mL-1的酶解物的ACE 抑制率可达37%这说明酶解的多肽具有抑制ADC 酶活的作用,因此之后的研究选择胰蛋白酶为最优酶解蛋白进行下一步的工艺优化。
2.3 酶解工艺优化研究
2.3.1 响应面实验结果
采用Design-Expert 8.0.6 软件对表4 中数据进行回归拟合,得到ACE 抑制率对酶解时间、温度、pH、加酶量和料液比的二次多项回归模型为:Y=33.30+0.18 X1-0.60 X2-3.50 X3+0.45 X4-5.20 X5+4.97 X1X2-3.29 X1X3-2.07 X1X4-2.16 X1X5+3.55 X2X3-5.32 X2X4+3.65X2X5+1.14 X3X4+7.46 X3X5+8.98 X4X5-6.82X12-4.27X22-9.39 X32-3.47 X42-8.65 X52。
2.3.2 响应面回归分析
酶解工艺响应面实验结果如表5 所示,对模型的行方差分析,结果如表6 显示:模型差异性显著(P=0.033 9<0.05),失拟项(Lack of Fit,P=0.516 6>0.1)差异性不显著,说明所得的回归方程误差较小,拟合较好,因此可以采用该模型和方法进行对南极鳞虾酶解产物进行分析、预测ACE 抑制率与各条件之间的关系。
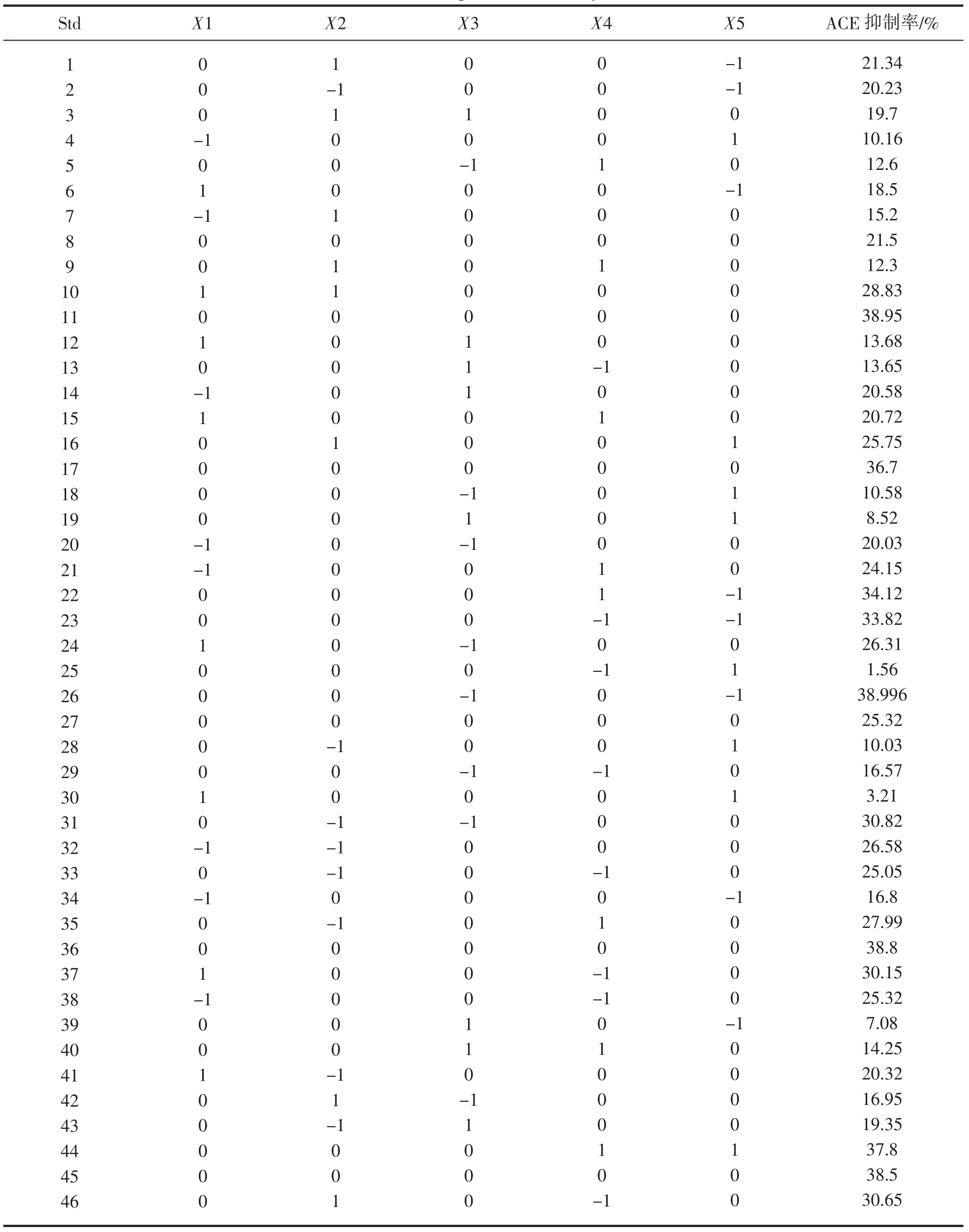
表5 Box-Behnken 设计及试验结果Tab.5 Box-Behnken experimental analysis and results

表6 二次回归方程模型方差分析结果Tab.6 Variance analysis for the quadratic regression model
从回归模型系数显著性检验结果的表中可以看出,模型的一次项E(料液比)较显著;二次项A2、C2与E2均显著,其中C2和E2极为显著;交互项DE 显著。结果表明各考察因素对酶解工艺参数的影响具有交互作用,而不是简单的线性关系,故该模型可行度高。从分析结果可以看出,各条件对ACE 抑制率的影响排序为:料液比>pH>温度>加酶量>时间。
根据回归方程绘制出响应面图,该图是基于响应值在不同实验条件交互影响而构成的一个三维空间曲面,可以预测和检验变量的响应值以及确定变量的相互关系。分析当温度、料液比、酶解时间、加酶量和pH 其中有3 个因素固定时,另外2 个因素及其交互作用对ACE 抑制率的影响。根据回归方程做出模型的响应曲面及其等高线见图6(A~J)。
根据二次回归方程所得响应曲面图(图6),用于分析时间、pH、加酶量、料液比及温度对ACE 抑制率的影响情况。由图6 可以看出:随着料液比例的增加,ACE 抑制活性也随着增大,但当料液比例增加到一定的程度后,ACE 抑制活性有下降的趋势;pH 得在一定程度范围内增大时,ACE 抑制活性有一定的提升,但是超过这个范围后,ACE 抑制率不增反降了;温度和加酶量的影响亦是如此,超过一定范围,ACE 抑制率便有下降的趋势;酶解时间对ACE 抑制活性没有明显的影响。各因素相互之间都有显著性,均呈现先升后降的变化趋势,从响应曲面的陡峭程度可以看出,料液比的影响最为显著,这与回归方程分析的结果一致,可信度较高。
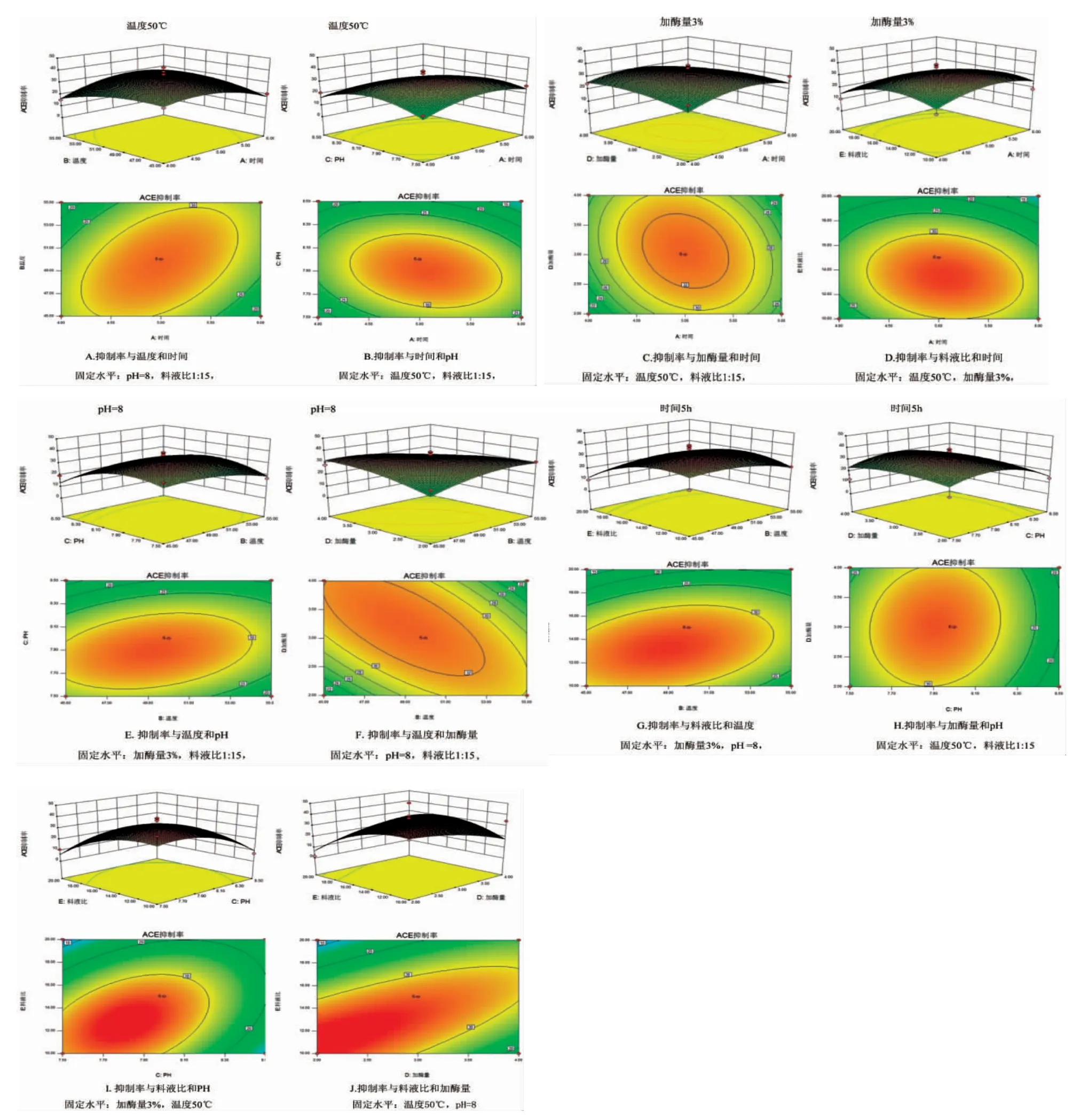
图6 各因素交互作用的响应面Fig.6 Response surface for the effect of cross-interaction between different factors
等高线图的形状可以反映出两因素交互作用的强弱和显著程度,等高线图如果为椭圆,则表明这2 个因素交互影响明显,如果为圆形,则表示二者交互不明显。从图3~6 可以看出:其中图A、B、D、及E~J 等高线图呈椭圆状,说明两因素之间影响明显,而图C 中等高线形状趋于圆形,说明在其他三因素固定时,加酶量和时间交互影响不显著,响应曲面也趋于平缓。
对所得方程进行逐步回归及实验条件考量,可得到酶解的最优工艺条件:pH 8.0,加酶量2.1%,料液比为1:10.1,温度为50 ℃,时间为5.95 h,酶解物浓度在1.0 mg·mL-1时ACE 抑制率为38.819 3%。
3 结论
本研究以南极磷虾作为实验原材料,以ACE 抑制活性为指标,通过对碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶和胃蛋白酶5 种酶进行筛选,得出胰蛋白酶为最佳酶种;采用响应面分析的方法通过Box-Behnken 中心组合设计原理,选择温度、时间、加酶量、料液比和pH 作为试验因子进行五因素三水平试验,优化酶解工艺,采用Design-Expert 8.0.6 软件得到ACE 抑制率对酶解时间、温度、pH、加酶量和料液比的二次多项回归模型为:Y=33.30+0.18 X1-0.60 X2-3.50X3+0.45 X4-5.20 X5+4.97 X1X2-3.29 X1X3-2.07 X1X4-2.16 X1X5+3.55 X2X3-5.32 X2X4+3.65X2X5+1.14 X3X4+7.46 X3X5+8.98 X4X5-6.82X12-4.27X22-9.39 X32-3.47 X42-8.65 X52,分析数据可知各条件对ACE 抑制率的影响排序为:料液比>pH>温度>加酶量>时间,得出最佳酶解工艺为:pH 8.0,加酶量2.1%,料液比为1:10,温度为50 ℃,时间为5.95 h,酶解物浓度在1.0 mg·mL-1时ACE 抑制率为38.819 3%。
从南极磷虾中分离ACE 抑制肽,并对其酶解工艺进行了优化,为南极磷虾的高值化利用、功能性食品和新型降压药物的研发提供了基础。
