增氧微咸水对小白菜光响应特征及产量的影响
2020-06-20王怡琛王全九
孙 燕,王怡琛,王全九,2
增氧微咸水对小白菜光响应特征及产量的影响
孙 燕1,王怡琛1,王全九1,2※
(1. 西安理工大学省部共建西北旱区生态水利国家重点实验室,西安 710048;2. 中国科学院水利部水土保持研究所,黄土高原土壤侵蚀与旱地农业国家重点实验室,杨凌 712100)
为了探讨水培条件下微咸水溶解氧浓度对小白菜光响应特征及产量的影响,测定了5种增氧水平下小白菜的光合响应过程,并采用直角双曲线模型、非直角双曲线模型、直角双曲线修正模型和指数模型分别对小白菜光响应曲线进行拟合比较,筛选出最优模型并利用最优模型对小白菜的光合特征参数进行了计算。试验结果表明,经误差分析,不同增氧水平下4种模型的光响应曲线拟合结果存在差异,非直角双曲线模型对所有处理的模拟精度均最高,是分析增氧微咸水水培条件下小白菜光响应曲线的最优模型。光响应曲线参数显示,18.5 mg/L的微咸水溶解氧浓度处理下小白菜的暗呼吸速率、表观量子效率、最大净光合速率均显著高于其他微咸水增氧处理。此外,18.5 mg/L的微咸水溶解氧浓度处理下小白菜的净光合速率和地上部鲜质量也显著高于其他微咸水增氧处理。因此,利用微咸水培养小白菜较为适宜的溶解氧浓度约为18.5 mg/L,该增氧处理有利于增强小白菜的耐荫性和忍受高光强的能力,增大小白菜叶片的可利用光强范围,提高叶片的生理活性,并促进小白菜叶片光合作用的高效运行,进而实现小白菜高产。
光合作用;微咸水;溶解氧;小白菜;光合特征;光响应模型
0 引 言
中国西北地区淡水资源短缺、用水效率低下,严重制约了工农业可持续发展[1]。为了保障农业的可持续发展,当务之急是解决淡水资源匮乏、水资源利用效率低等问题,从而构建节水型社会。中国西北旱区有着丰富的地下微咸水资源[2],合理开发利用微咸水可以缓解淡水资源匮乏所带来的用水压力。但是,由于微咸水中含有一定盐分,进行农田灌溉的同时也增加了土壤盐分,易引起土壤的次生盐碱化,直接威胁土地质量。因此,调控灌溉水质量、提高灌溉水生产效率、更加安全高效地利用微咸水进行灌溉是农业可持续发展的必然要求。活化灌溉水是利用磁化、去电子和增氧等方法对灌溉水进行处理,改善灌溉水的表面张力、溶氧量等理化性质,从而提高灌溉水的活性,增强灌溉水的生理功效。由于设备简便、耗能低、投入少、无污染且效率高等优势,活化灌溉水已受到学者们的广泛关注[3]。因此将微咸水灌溉与灌溉水活化技术相结合,发展更加安全高效的活化微咸水灌溉技术,能够缓解淡水资源紧缺的矛盾,有效实现农业节约用水。
植物光合作用是地球上有机物和能量的来源,是农作物把太阳能转化为动物及人类赖以生存的食物及氧气的最重要的物理化学过程[4]。为定量研究植物光合速率对光照强度的响应,许多学者通过建立了光响应模型,例如直角双曲线模型、非直角双曲线模型、直角双曲线修正模型和指数模型等[5-6],光响应曲线的模拟可得出多个基础生理参数(包括表观量子效率、最大净光合速率、光补偿点、光饱和点以及暗呼吸速率),这些参数能直接或间接反映出植物的生理生态学过程[7-8]。因此,一些学者针对不同类型植物,如玉米、大豆、棉花、咖啡等进行了光响应曲线模型的比较研究[9-12],但针对微咸水培养下,关于不同增氧水平与小白菜光响应曲线的关系及模型的适用性研究报道比较少。本试验对不同增氧水平微咸水培养小白菜的光响应特征进行了分析,探究促进小白菜生长的最适宜增氧水平,分别采用直角双曲线模型、非直角双曲线模型、直角双曲线修正模型和指数模型对不同增氧水平下小白菜叶片的光响应曲线进行拟合,确定不同增氧水平微咸水培养条件下最优的小白菜光响应模型,并通过最优模型计算小白菜的表观量子效率、最大净光合速率、光补偿点、光饱和点、暗呼吸速率等指标,以期为活化水处理技术改善微咸水灌溉效益提供一定的理论基础。
1 材料与方法
1.1 试验设计
试验在西安理工大学人工气候温室中开展,设置温度为20 ℃,湿度为40%,光照为自然光源。本试验为无土栽培试验。首先选取饱满的小白菜种子放置在培养基中进行培养,5~7 d后长出3~5 cm的幼苗;选取长势一致的小白菜幼苗,每桶一株种植在底面积20 cm2、高15 cm盛满培养液的圆柱形塑料桶中,塑料桶四周用锡箔纸包裹为小白菜根部生长提供避光环境,小白菜幼苗的茎部用海绵包裹固定在塑料桶盖的中央,如图1所示。
供试培养液由荷格伦特(Hoagland)营养液和氯化钠(含量≥99.5%,分析纯AR)配置而成,矿化度设置为3 g/L。荷格伦特(Hoagland)营养液配方如表1所示[13]。在小白菜移栽后先采用1/4浓度营养液培养6 d,继而采用1/2浓度营养液培养6 d,随后采用全浓度营养液培养至小白菜收获。培养液每48 h更换一次,培养液更换之前对微咸水进行不同水平增氧处理:处理1为常规微咸水不增氧处理,其溶解氧浓度约为9.5 mg/L;处理2~处理5为增氧处理,其中处理2的微咸水溶解氧浓度增至约为12.5 mg/L,处理3的微咸水溶解氧浓度增至约为15.5 mg/L,处理4的微咸水溶解氧浓度增至约为18.5 mg/L,处理5的微咸水溶解氧浓度增至约为22.5 mg/L。每个处理设置6个重复,其中不增氧处理为对照(CK)。增氧处理采用微纳米气泡快速发生装置,增氧过程中采用HQ40型便携式溶氧仪监测微咸水溶解氧浓度变化。
图1 种植小白菜示意图
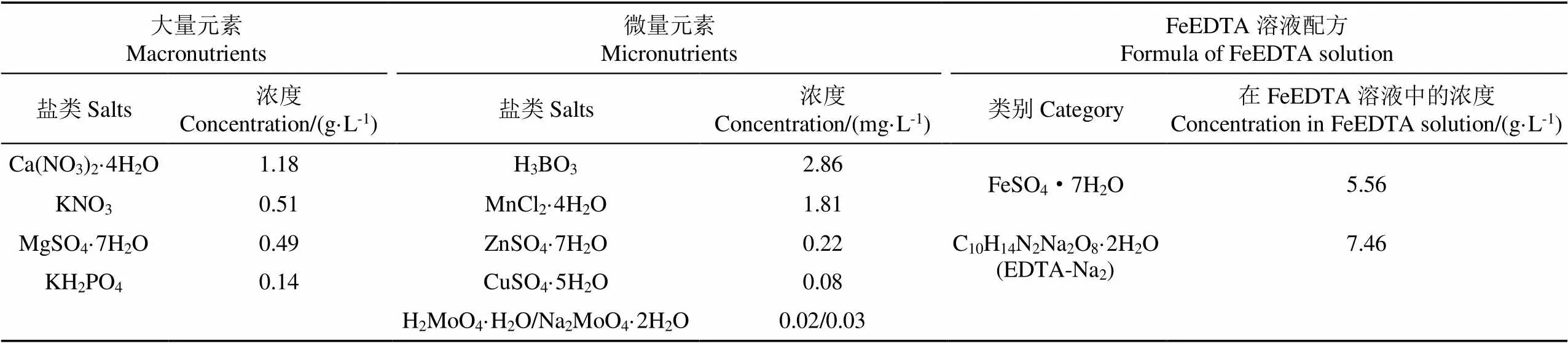
表1 荷格伦特(Hoagland)营养液的配方[13]
注:每升培养液中加入2 mL FeEDTA溶液。
Note: 2 mL of FeEDTA solution was added to each liter of culture solution.
1.2 生育期确定
2019年3月20日小白菜播种,2019年5月9日小白菜收获,全生育期共50 d。各生育期的确定标准如下:发芽期:播种7 d后,小白菜从播种到子叶展平,种子胚生长成幼芽。幼苗期:播种15 d后,从第一片真叶生出至生出5~8片真叶。营养生长期:自幼苗期之后即进入营养生长旺盛期。休眠期:自营养生长旺盛期之后,植株停止生长,处于休眠的状态。
1.3 测定内容与方法
光响应曲线测定:在小白菜的营养生长旺盛期,采用LC-pro型便携式光合仪进行光响应曲线测定。选择晴朗的天气,观测时间为09:00-11:00,每个处理随机选取3株长势良好、上部完全展开的小白菜叶片进行观测,每个叶片重复观测3次,取平均值。用LC-pro型便携式光合仪自带的红蓝光源测定不同光合有效辐射()梯度下的小白菜叶片净光合速率。光照范围设置14个光强梯度,由于测量过程中需要进行光诱导,因此按照2 000、1 600、1 400、1 200、1 000、800、600、400、200、100、80、50、20、0mol/(m2·s)的顺序进行测定,自动记录数据。通过光响应曲线的测定来确定小白菜的表观量子效率()、最大净光合速率(Pmax)、光补偿点(I)、光饱和点(I)和暗呼吸速率(R)等指标。
小白菜地上部分鲜质量测定:在小白菜进入休眠期(播种后50 d)全部收获,分别称取每个处理中6个重复的小白菜单株地上部分鲜质量,取平均值。
1.4 光响应曲线模型
本文采用4种模型对小白菜光响应曲线进行模拟分析,具体模型公式如下:
1)直角双曲线模型
直角双曲线模型[14]具体表示为
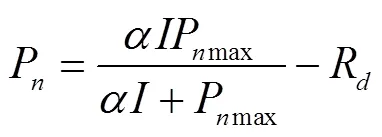
式中P为净光合速率,mol/(m2·s);为表观量子效率;Pmax为最大净光合速率,mol/(m2·s);R为暗呼吸速率,mol/(m2·s);为光合有效辐射,mol/(m2·s)。光补偿点(I)可用下式计算
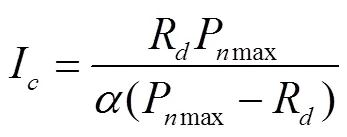
直线y=Pmax与直线-R相交,交点所对应轴的数值即光饱和点(I)。
2)直角双曲线修正模型
直角双曲线修正模型[15]表示为
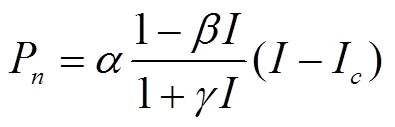
式中I为光补偿点,为光抑制系数,是独立于的系数。
暗呼吸速率(R)为
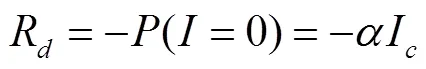
光饱和点(I)为

最大净光合速率Pmax为
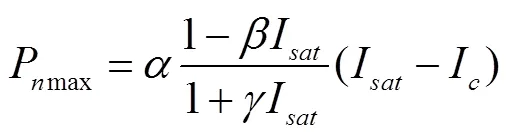
=0处的量子效率定义为内禀量子效率(0)
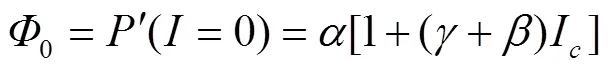
I=I处的量子效率(Φ)[16]
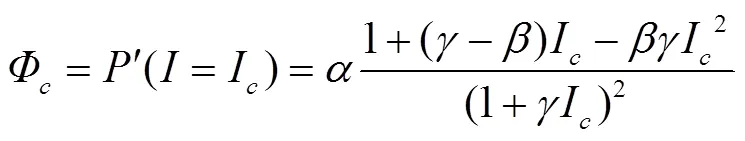
式中Φ代表植物在光补偿点处的表观量子效率。光响应曲线上=0和=I两点连线斜率的绝对值(Φ0)
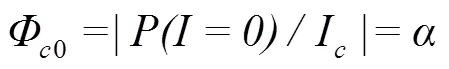
3)非直角双曲线模型
非直角双曲线模型[14]表示为
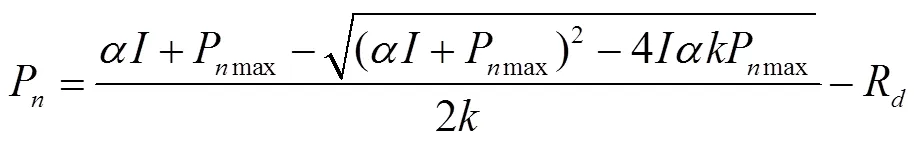
式中为非直角双曲线的曲角。若模型拟合较好,可采用下面的公式计算光补偿点(I)
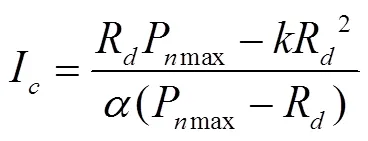
直线y=Pmax与直线-R相交,交点所对应轴的数值即光饱和点(I)。
4)指数模型
指数模型[14]表示为
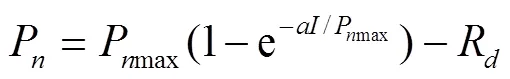
估算I时,假设P为0.99Pmax所对应的光强为饱和光强。
由于直角双曲线模型、非直角双曲线模型和指数模型均是单调递增函数,故无法准确求出饱和光强(I)。因此需要通过直线方程拟合弱光下(≤200mol/(m2·s))所测得的光响应数据,获得表观量子效率(),然后求解方程Pmax=-R,进而求得饱和光强[17]。
1.5 数据处理
采用Excel 2016进行数据分析,采用SPSS 19.0软件进行统计分析,其中方差分析为单因素方差,各处理利用LSD法进行显著性检验,显著水平为0.05;采用Origin 9.0软件对数据进行绘图。利用均方根误差(RMSE)、平均绝对误差(MAE)和决定系数(2)3个指标衡量模型拟合的精确性。RMSE和MAE越小、2越接近于1,说明模型模拟结果精度越高,反之,则模拟精度越差[18]。公式如下
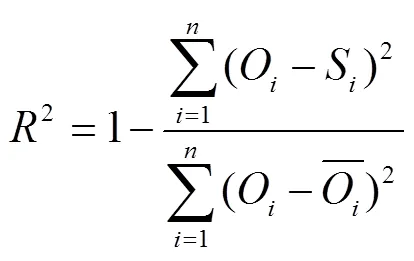
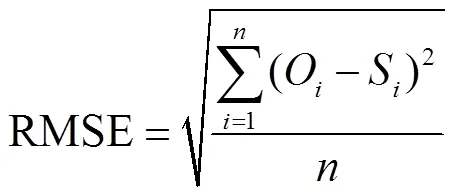

式中为观测值;为模拟值;为观测值的平均值;为样本数。
2 结果与分析
2.1 光响应曲线适宜模型确定
为了定量分析微咸水溶解氧浓度对小白菜光合特征的影响,确定适宜的光响应曲线模型,分别采用直角双曲线模型、非直角双曲线模型、直角双曲线修正模型和指数模型对不同溶解氧浓度下小白菜叶片的光响应曲线进行拟合分析。图2为4种模型对小白菜净光合速率的拟合曲线。
由图2分析可知,不同处理的净光合速率(P)均随光合有效辐射()增大而增大,且直角双曲线模型、非直角双曲线模型、指数模型均是单调递增的函数,因此这3种模型均能够方便地估算出小白菜的最大净光合速率(Pmax)、光补偿点(I)、表观量子效率()以及暗呼吸速率(R)。而直角双曲线修正模型符合净光合速率(P)随光合有效辐射()的增大呈现先增大后减小的规律,由于本试验测得的数据均是净光合速率(P)随光合有效辐射()单调递增的,因此直角双曲线修正模型并不适用于该试验中小白菜叶片的光响应曲线拟合。对比表2中直角双曲线模型、非直角双曲线模型和指数模型的拟合结果表明,不同增氧水平处理中的非直角双曲线模型决定系数2较直角双曲线模型和指数模型更接近于1,且RMSE与MAE值较小,说明非直角双曲线模型的模拟精度更高,是拟合增氧微咸水培养条件下小白菜光响应曲线的最优模型。
2.2 光响应曲线特征参数变化特点
采用非直角双曲线模型计算获得了微咸水不同增氧水平条件下小白菜的表观量子效率()、最大净光合速率(Pmax)、光补偿点(I)、光饱和点(I)、暗呼吸速率(R)等光合特征参数,如表3所示。
表观量子效率()反映了植物在弱光下吸收、转换和利用光能能力的指标[19]。溶解氧浓度为18.5 mg/L时的表观量子效率()显著高于其他增氧处理(< 0.05),表明在该增氧水平条件下,小白菜在弱光下的光合能力最强,对弱光的利用能力比较强,分别较9.5、12.5、15.5和22.5 mg/L处理增加了17.9%、30.7%、40.7%和55.1%。

图2 不同微咸水溶解氧浓度下4种模型对小白菜光响应曲线的拟合效果比较
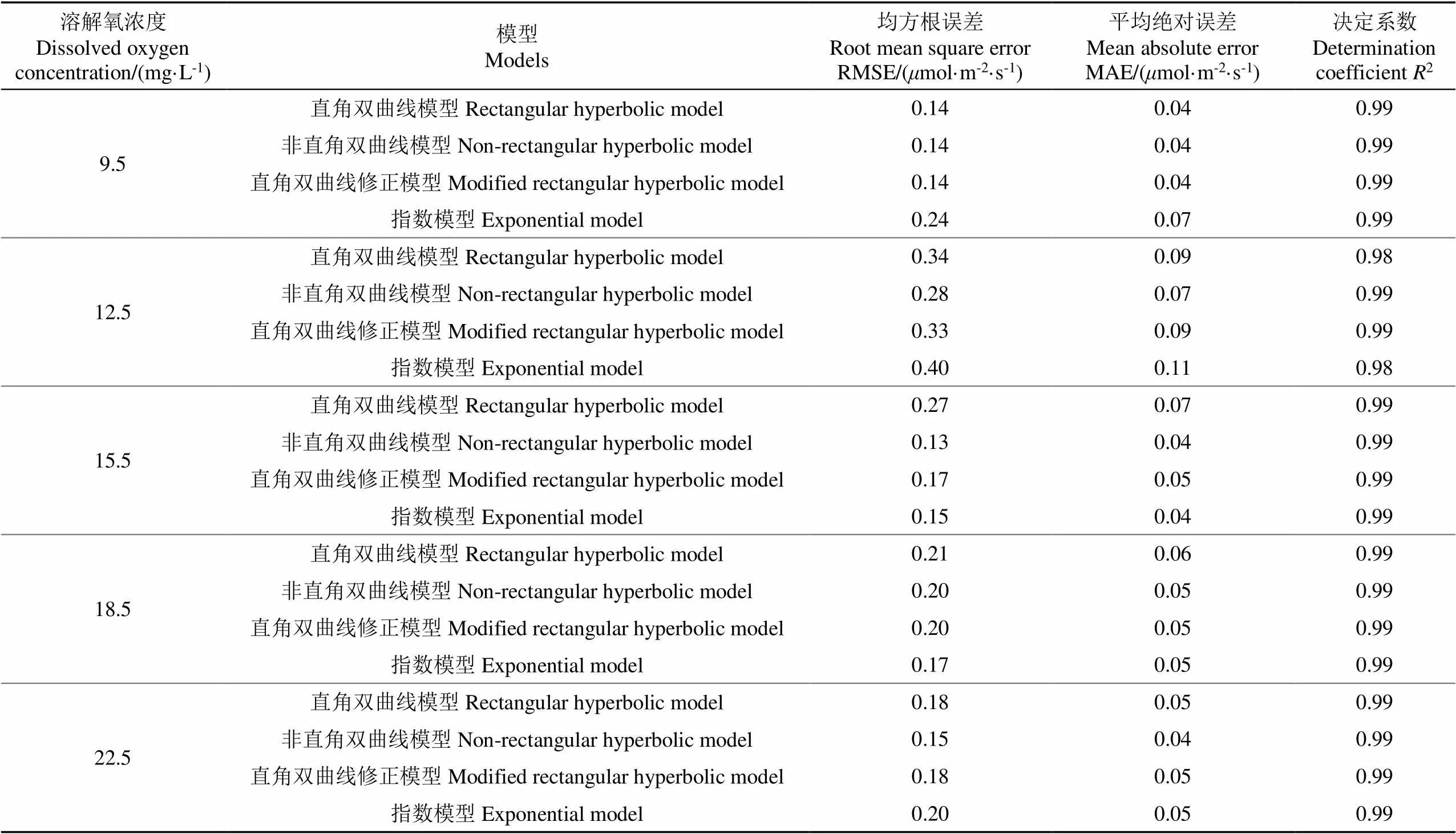
表2 不同微咸水溶解氧浓度下4种模型对光响应曲线的模拟精度比较分析
植物叶片的光补偿点与光饱和点反映了植物对光照条件的要求,是判断植物有无耐荫性和对强光的利用能力的一个重要指标。一般来说,光补偿点和饱和光强均较低是典型的耐荫植物,能充分地利用弱光进行光合作用;光补偿点和光饱和点均较高的是典型阳性植物,必须在无庇荫处才能生长良好。光补偿点越低,植物利用低光强的能力越强[20]。当溶解氧浓度为9.5和18.5 mg/L时I均显著小于其他增氧处理,表明在微咸水培养条件下,9.5和18.5 mg/L的增氧水平均增强了小白菜的耐荫性,能够使小白菜在较弱的光强下正常生长。光饱和点(I)越高,植物利用强光的能力越强。溶解氧浓度为15.5、18.5和22.5 mg/L处理下的光饱和点(I)均显著高于其他增氧处理(< 0.05),表明在这些增氧水平下小白菜的光合作用不易受到强光的抑制,能够忍受强光的能力较强。此外,光补偿点较低、饱和光强较高的植物对光环境的适应性较强,既能充分利用弱光又能在光强较高环境中生长良好;而光补偿点较高、饱和光强较低的植物对光照的适应性较窄。因此,用△来表示小白菜叶片可利用光照强度的范围,当微咸水溶解氧浓度为15.5和18.5 mg/L时,小白菜叶片的可利用光强的范围较大,对光环境的适应性较强。当微咸水溶解氧浓度为12.5 mg/L时,小白菜对可利用的光强范围最小,对光照的适应性较窄。因此,结合I、I以及△综合分析可知,能够同时提高小白菜利用弱光和强光能力的较为适宜的微咸水溶解氧浓度为18.5 mg/L。
植物的暗呼吸速率是指植物在无光照条件下的呼吸速率,植物在暗呼吸时释放的能量大部分以热的形式散失,小部分用于植物的生理活动[21-22]。因此在一定程度上,R越大,说明植物叶片的生理活性越高。随微咸水溶解氧浓度的提高,暗呼吸速率呈现先增大后减小的变化趋势,当溶解氧浓度为18.5 mg/L时,小白菜暗呼吸速率达到最大值,且显著高于其他增氧处理(< 0.05)。分别较9.5、12.5、15.5和22.5 mg/L处理增大了55.9%、35.5%、11.0%和28.2%,表明在利用18.5 mg/L的增氧水平进行培养时,小白菜叶片的生理活性最高。随着溶解氧浓度的增加,最大净光合速率Pmax大体呈现出先增大后减小的变化趋势。当溶解氧浓度为18.5 mg/L时,小白菜的Pmax达到了最大值,分别较9.5、12.5、15.5和22.5 mg/L处理显著提高了43.6%、88.5%、43.9%和70.9%(< 0.05)。
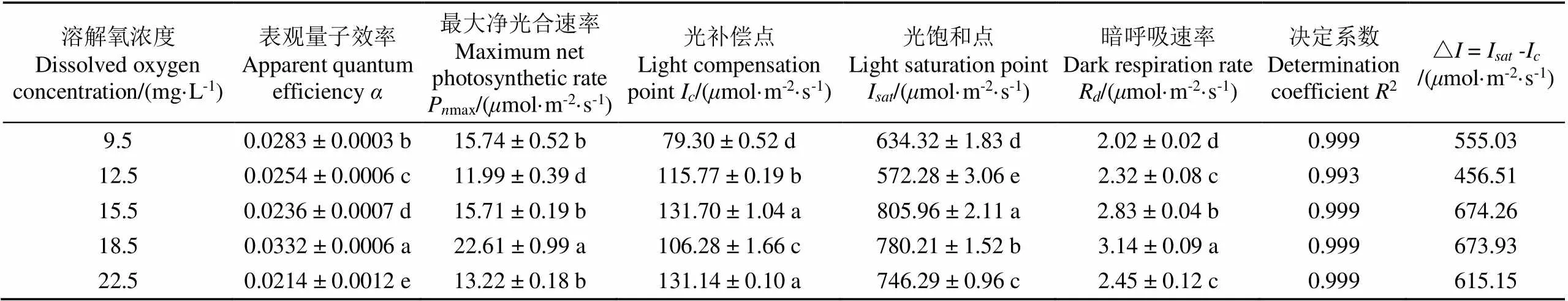
表3 不同微咸水溶解氧浓度下小白菜光响应曲线参数
注:同一列不同小写字母表示不同处理间差异显著(< 0.05),下同。
Note: The different lowercase letters in a column indicate significant differences among different treatments (< 0.05), the same below.
2.3 光响应曲线变化特征
不同增氧水平微咸水培养条件下的小白菜光响应曲线如图3所示。由图3可知,随着光合有效辐射的增强,小白菜净光合速率呈现非线性增加趋势。当光合有效辐射达到600mol/(m2·s)时,小白菜净光合速率增速减缓,当溶解氧浓度为18.5 mg/L时,小白菜的净光合速率达到最大值。相同光合有效辐射强度下,各处理的净光合速率变化规律为18.5 > 15.5 > 22.5 > 12.5 mg/L,其中当光合有效辐射大于800mol/(m2·s)时,9.5和15.5 mg/L处理的净光合速率相差不大。这与小白菜地上部分的鲜质量变化趋势基本一致。由此可见,当微咸水溶解氧浓度在一定范围内时,对微咸水进行增氧处理有利于增强小白菜叶片对光合有效辐射的响应。净光合速率指标与小白菜地上部鲜质量之间存在较好的相关性[23],不同微咸水增氧处理下的净光合速率可以有效反映小白菜地上部分产量的变化规律。
2.4 小白菜地上部分鲜质量
微咸水不同增氧水平处理下小白菜的地上部分鲜质量结果(表4)表明,各处理地上部鲜质量从大到小依次为:18.5、15.5、9.5、22.5、12.5 mg/L的变化趋势。与其他增氧处理相比,18.5 mg/L处理的小白菜增产达显著水平(< 0.05),分别较9.5、12.5、15.5和22.5 mg/L处理显著增加了37.3%、74.9%、33.9%和47.0%。由此可见,相比于对照,不同的微咸水增氧水平均有利于小白菜产量的增加,其中18.5 mg/L的微咸水溶解氧浓度对小白菜的增长幅度最大,而微咸水溶解氧浓度进一步增加则会抑制小白菜生长。
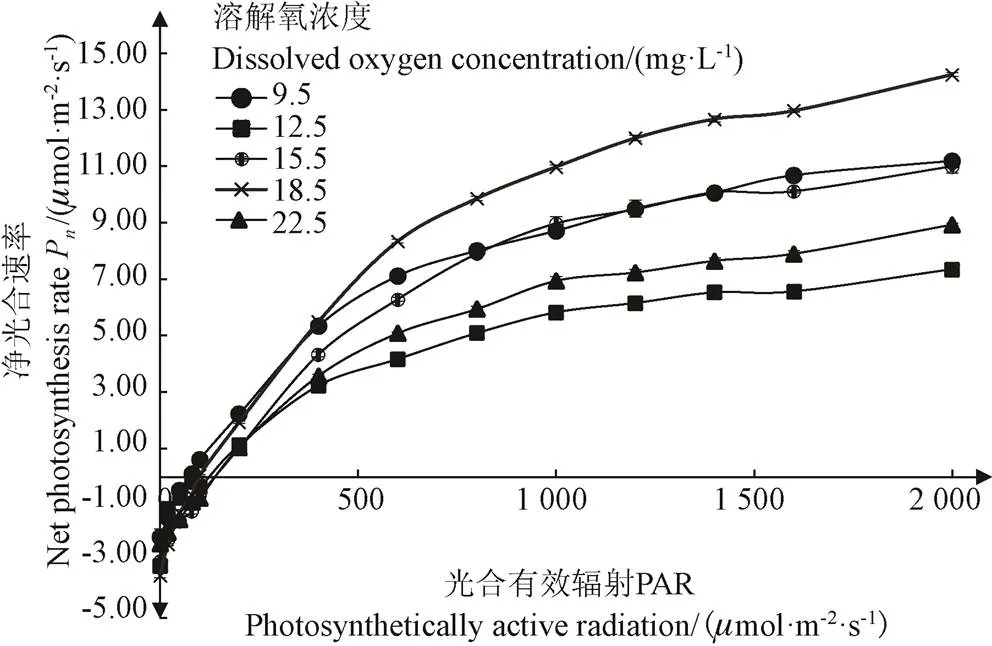
图3 不同微咸水溶解氧浓度处理下小白菜叶片光响应曲线

表4 不同微咸水溶解氧浓度处理下小白菜地上部分鲜质量
3 讨 论
盐胁迫是制约植物生长发育的主要非生物胁迫之一,当植物生境的盐浓度超过一定范围时,植物体内发生的渗透会导致植物体内活性氧的产生与清除代谢紊乱,造成细胞氧化损伤,进而对膜系统造成伤害,影响植物的正常生长发育[24]。利用外源物质诱导植物产生抗逆性是提高植物抵御外界不良环境的有效方法。羟基自由基(·OH)是生物体内的一种活性氧分子,也是细胞应答逆境胁迫的一个重要内源信号分子,在植物抵抗逆境胁迫起着重要作用,且表现为保护和毒害的双重作用[25]。已有研究表明微纳米气泡在破裂瞬间,由于气液界面的改变会激发羟基自由基(·OH)的产生,具有很高的氧化还原电位和强氧化作用[26-28]。植物生长环境中由于外源·OH的产生会诱导植物产生抗性反应,可以通过激活植物体内的细胞保护酶系统来抵制过多活性氧对植物机体产生的伤害[29]。但是·OH在参与调解植物生理代谢和抗性反应中具有明显的浓度效应[25],即低浓度的·OH会诱导植物对逆境胁迫的抗性反应,提高植物的抗逆性,而高浓度的·OH则会加速植物细胞的氧化损伤和细胞壁结构蛋白交联,甚至诱导细胞程序性死亡。
光响应曲线参数显示(表4),相比于对照(9.5 mg/L),12.5 mg/L增氧处理条件下的I较高,I较低,表明小白菜叶片的耐荫性和忍受高光强的能力都比较差。即小白菜在较弱的光照条件下难以正常生长,在强光照射下又易出现光抑制现象,可利用光照强度的范围较窄。进一步结合小白菜地上部鲜质量数据分析可知(表2),12.5 mg/L处理的小白菜地上部鲜质量显著低于9.5 mg/L处理(< 0.05),而9.5和15.5 mg/L处理之间的差异并不显著(> 0.05)。植物能够在一定程度的盐胁迫条件下正常生长,除了和植物本身的基因遗传有关以外,还与植物在逆境胁迫下体内存在活性氧清除机制有关[30]。微咸水经增氧处理后,微纳米气泡破裂所产生的·OH会诱导小白菜体内抗氧化酶活性的提高来缓解外源·OH对细胞产生的氧化性毒害。但微纳米气泡所激发产生的·OH浓度决定了植物细胞内抗氧化酶等物质对活性氧的清除程度[31]。因此,猜测与对照相似,15.5 mg/L增氧处理所激发的外源·OH浓度所诱导小白菜产生的抗性反应可能同样会使小白菜体内的活性氧产生和清除过程处于一个稳定平衡的状态。而12.5 mg/L增氧处理所激发的外源·OH浓度所诱导小白菜产生的抗性反应使活性氧得不到及时清除,小白菜体内的活性氧产生和清除过程失去平衡,进而对细胞膜系统造成了一定程度的伤害,影响小白菜叶片光响应曲线参数、净光合速率和产量的提高。
在微咸水培养条件下,18.5 mg/L的增氧水平能够通过提高小白菜叶片的耐荫性和增强叶片忍受高光强的能力,增大叶片对可利用光的光强范围,增强叶片的生理活性,进而促进小白菜叶片光合作用的高效运行,实现小白菜高产。该处理所激发的外源·OH浓度能够诱导小白菜产生的抗性反应增强,进而使得植物体内消除活性氧的能力增强。此外,适宜的外源·OH浓度很可能会进一步诱导小白菜体内渗透调节物质(如脯氨酸和可溶性糖)含量的增加,能够提高细胞的渗透调节能力,从而提高小白菜的耐盐能力[32]。然而,当微咸水的溶解氧浓度进一步增加时,反而会降低小白菜叶片的光合特征参数,尤其会减弱小白菜叶片对弱光的利用能力,降低最大净光合速率和叶片的生理活性,最终导致小白菜产量下降。当增氧处理所激发的外源·OH超过一定浓度时,会降低其对抗氧化酶的促进作用。此外,较高的外源·OH浓度会使根区环境变成强氧化性[33],不利于根部对养分的吸收,进而也会影响光合作用的有效运行。
4 结 论
1)经过对直角双曲线模型、直角双曲线修正模型、非直角双曲线模型和指数模型4种常用模型的模拟与比较,结果表明,非直角双曲线模型决定系数2较直角双曲线模型和指数模型更接近于1,且RMSE与MAE值较小,对小白菜光响应曲线的模拟精度最高,更接近小白菜实际的光合特征,是适合增氧微咸水培养条件下小白菜的最优光响应模型。
2)当微咸水溶解氧浓度为18.5 mg/L时,通过增强小白菜叶片的耐荫性和忍受高光强的能力,增大小白菜叶片可利用光强的范围,提高叶片的生理活性,来促进小白菜叶片光合作用的高效运行,进而实现小白菜高产。因此,结合本试验所得结果,在实际的农业生产中,利用微咸水培养小白菜较为适宜的溶解氧浓度约为18.5 mg/L。
[1] 李曦. 中国西北地区农业水资源可持续利用对策研究[D]. 武汉:华中农业大学,2003. Li Xi. Countermeasure Study on Sustainable Exploitation of Agricultural Water Resources in Northwest China[D]. Wuhan: Huazhong Agricultural University, 2003. (in Chinese with English abstract)
[2] 牛君仿,冯俊霞,路杨,等. 咸水安全利用农田调控技术措施研究进展[J]. 中国生态农业学报,2016,24(8):1005-1015. Niu Junfang, Feng Junxia, Lu Yang, et al. Advances in agricultural practices for attenuating salt stress under saline water irrigation[J]. Chinese Journal of Eco-Agriculture, 2016, 24(8): 1005-1015. (in Chinese with English abstract)
[3] 王全九,孙燕,宁松瑞,等. 活化灌溉水对土壤理化性质和作物生长影响途径剖析[J]. 地球科学进展,2019,34(6):660-670. Wang Quanjiu, Sun Yan, Ning Songrui, et al. Effects of activated irrigation water on soil physicochemical properties and crop growth and analysis of the probable pathway[J]. Advance in Earth Sciences, 2019, 34(6): 660-670. (in Chinese with English abstract)
[4] 朱世秋,张琳雪,陈周,等. 高压电场对植物电特性的影响及促进光合作用的室内试验[J]. 农业工程学报,2016,32(17):168-173. Zhu Shiqiu, Zhang Linxue, Chen Zhou, et al. Laboratory test on effects of high voltage electricity on electrostatic properties and promoting photosynthesis of plants[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(17): 168-173. (in Chinese with English abstract)
[5] 叶子飘,于强. 一个光合作用光响应新模型与传统模型的比较[J]. 沈阳农业大学学报,2007,38 (6):771-775. Ye Zipiao, Yu Qiang. Comparison of a new model of light response of photosynthesis with traditional models[J]. Journal of Shenyang Agricultural University, 2007, 38 (6): 771-775. (in Chinese with English abstract)
[6] Dos Santos Junior U M, Carvalho Gonçalves J F, Fearnside P M. Measuring the impact of flooding on Amazonian trees: photosynthetic response models for ten species flooded by hydroelectric dams[J]. Trees, 2013, 27(1): 193-210.
[7] 郎莹,张光灿,张征坤,等. 不同土壤水分下山杏光合作用光响应过程及其模拟[J]. 生态学报,2011,31(16):4499-4508. Lang Ying, Zhang Guangcan, Zhang Zhengkun, et al. Light response of photosynthesis and its simulation in leaves ofL. under different soil water conditions[J]. Acta Ecologica Sinica, 2011, 31(16): 4499-4508. (in Chinese with English abstract)
[8] 李佳,刘济明,文爱华,等.米槁幼苗光合作用及光响应曲线模拟对干旱胁迫的响应[J]. 生态学报,2019,39(3):913-922. Li Jia, Liu Jiming, Wen Aihua, et al. Simulated photosynthetic responses of Cinnamomum migao during drought stress evaluated using light-response models[J]. Acta Ecologica Sinica, 2019, 39(3): 913-922. (in Chinese with English abstract)
[9] 李发永,劳东青,孙三民,等. 滴灌对间作枣棉光合特性与水分利用的影响[J]. 农业机械学报,2016,47(12):119-129. Li Fayong, Lao Dongqing, Sun Sanmin, et al. Effects of drip irrigation on photosynthetic characteristics and water use efficiency of jujube-cotton intercropping system[J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(12): 119-129. (in Chinese with English abstract)
[10] 刘强,李凤日,谢龙飞. 人工长白落叶松冠层光合作用-光响应曲线最优模型[J]. 应用生态学报,2016,27(8):2420-2428. Liu Qiang, Li Fengri, Xie Longfei. Optimal model of photosynthesis-light response curve in canopy of plantedtree[J]. Chinese Journal of Applied Ecology, 2016, 27(8): 2420-2428. (in Chinese with English abstract)
[11] 张玲玲. 5种植物光响应曲线最适拟合模型筛选[J]. 西南林业大学学报,2017,37(1):20-25. Zhang Lingling. Light response curves of 5 plants and screening the optimal model[J]. Journal of Southwest Forestry University, 2017, 37(1): 20-25. (in Chinese with English abstract)
[12] Bote A D, Zana Z, Ocho F L, et al. Analysis of coffee (L.) performance in relation to radiation level and rate of nitrogen supply Ⅱ. Uptake and distribution of nitrogen, leaf photosynthesis and first bean yields[J]. European Journal of Agronomy, 2018, 92: 107-114.
[13] Hoagland D R, Arnon D I. The water culture method for growing plants without soil[R]. California Experimental Agriculture Station Circular, 1938, 347: 1-39.
[14] Thornley J H M. Mathematical Models in Plant Physiology[M]. Pittsburgh: Academic Press, 1976.
[15] Ye Z P. A new model for relationship between irradiance and the rate of photosynthesis in Oryza sativa[J]. Photosynthetica (Prague), 2007, 45(4): 637-640.
[16] Aspinwall M J, King J S, Mckeand S E, et al. Leaf-level gas-exchange uniformity and photosynthetic capacity among loblolly pine (L.) genotypes of contrasting inherent genetic variation[J]. Tree Physiology, 2011, 31(1): 78-91.
[17] 孙赫,赵春梅,代忠迪,等. 光合-光响应模型的研究进展[J],林业科技情报,2016,(4):15-17. Sun He, Zhao Chunmei, Dai Zhongdi, et al. Current research situation for the photosynthetic light response model[J]. Forestry Science and Technology Information, 2016(4): 15-17. (in Chinese with English abstract)
[18] 马莉,王全九. 不同灌溉定额下春小麦光合光响应特征研究[J]. 农业机械学报,2018,49(6):271-277. Ma Li, Wang Quanjiu. Photosynthetic and light response characteristics of spring wheat under different irrigation schedules[J]. Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(6): 271-277. (in Chinese with English abstract)
[19] 段萌,杨伟才,毛晓敏. 覆膜和水分亏缺对春小麦光合特性影响及模型比较[J]. 农业机械学报,2018,49(1):219-227. Duan Meng, Yang Weicai, Mao Xiaomin. Effects of water deficit on photosynthetic characteristics of spring wheat under plastic mulching and comparison of light response curve models[J]. Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(1): 219-227. (in Chinese with English abstract)
[20] Larcher W. Physiological Plant Ecology[M]. Beijing: Academic Press, 1980.
[21] 张淑勇,周泽福,夏江宝,等. 不同土壤水分条件下小叶扶芳藤叶片光合作用对光的响应[J]. 西北植物学报,2007,27(12):2514-2521. Zhang Shuyong, Zhou Zefu, Xia Jiangbao, et al. The responses ofSieb. leaf photosynthesis to light in different soil moisture[J]. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(12): 2514-2521. (in Chinese with English abstract)
[22] Coley P D. Herbivory and defensive characteristics of tree species in a low land tropical forest[J]. Ecological Monographs, 1983, 53(2): 209-233.
[23] 张建福,朱永生,蔡秋华,等. 再生稻净光合速率与产量及其构成因素的相关性分析[J]. 中国水稻科学,2011,25(1):103-106. Zhang Jianfu, Zhu Yongsheng, Cai Qiuhua, et al. Analysis on correlationship of net photosynthetic rate with yield and its components of ratooning rice[J]. Chinese Journal of Rice Science, 2011, 25(1): 103-106. (in Chinese with English abstract)
[24] 杨波,何俊瑜,任艳芳,等. 过氧化氢对镉胁迫下水稻种子萌发的缓解效应[J]. 植物生理学报,2018,54(6):1111-1118. Yang Bo, He Junyu, Ren Yanfang, et al. Alleviating effect of hydrogen peroxide on seed germination of rice under cadmium stresss[J]. Plant Physiology Journal, 2018, 54(6): 1111-1118. (in Chinese with English abstract)
[25] Muller K, Linkies A, Vreeburg R A M, et al. In vivo cell wall loosening by hydroxyl radicals during cress seed germination and elongation growth[J]. Plant Physiology, 2009, 150: 1855−1865.
[26] Fan W, Zhou Z, Wang W, et al. Environmentally friendly approach for advanced treatment of municipal secondary effluent by integration of micro-nano bubbles and photocatalysis[J]. Journal of Cleaner Production, 2019, 237: 117828.
[27] Li P, Takahsshi M, Chiba K. Enhanced free-radical generation by shrinking microbubbles using a copper catalyst[J]. Chemosphere, 2009, 77(8): 1157-1160.
[28] Wang Z, Yi K, Lin Q Y, et al. Free radical sensors based on inner-cutting graphene field-effect transistors[J]. Nature Communications, 2019, 10(1): 1544.
[29] Winterbourn C C. Reconciling the chemistry and biology of reactive oxygen species[J]. Nature Chemical Biology, 2008, 4: 278-286.
[30] 赵可夫,邹琦,李德全,等. 盐分和水分胁迫对盐生和非盐生植物细胞膜脂过氧化作用的效应[J]. 植物学报,1993,35(7):519-525. Zhao Kefu, Zou Qi, Li Dequan, et al. The effect of salt and water stress on membrane lipid peroxidation in leaf cells of halophyte and non-halophyte[J]. Journal of Integrative Plant Biology, 1993, 35(7): 519-525. (in Chinese with English abstract)
[31] Mccord J M. The evolution of free radicals and oxidative stress[J]. American Journal of Medicine, 2000, 108(8): 652-659.
[32] Wrzaczek M, Brosché M, Kangasjärvi J. ROS signaling loops-Production, perception, regulation[J]. Current Opinion in Plant Biology, 2013, 16: 575-582.
[33] Takahashi M, Chiba K, Li P. Free-radical generation from collapsing microbubbles in the absence of a dynamic stimulus[J]. Journal of Physical Chemistry B, 2007, 111(6): 1343-1347.
Effects of oxygenated brackish water on light response characteristics and yield of pakchoi (L.)
Sun Yan1, Wang Yichen1, Wang Quanjiu1,2※
(1.,,710048,; 2.,,,712100,)
In arid and semiarid areas, brackish water irrigation can be a great potential approach to alleviate the shortage of fresh water resources in agriculture. However, the irrigation of agricultural land with brackish waters can also reduce crops production due to salt stress, while lead to soil degradation, such as secondary salinization. To accurately evaluate soil salinity, various methods have been developed to safely utilize brackish water for farmland irrigation system. The oxygenated treatment technology can be expected to improve the adverse effects of salt content on soil structure and crop growth, due to easy operation, low energy consumption, cost-saving, friendly environment and high efficiency. In this study, the pakchoi was taken as the research object under the combination of the brackish water irrigation and oxygenation technology. A mathematical model was proposed to investigate the impact of dissolved oxygen in brackish water on light-response characteristics and pakchoi yield under the condition of hydroponics. Four light-response models, including rectangular hyperbolic, non-rectangular hyperbolic, modified rectangular hyperbolic and exponential model, were used to analyze the photosynthetic characteristics of pakchoi leaves. Five levels of dissolved oxygen concentrations were measured, 9.5 (CK), 12.5, 15.5, 18.5, 22.5mg/L. In the light-response model, the optimal parameters of the photosynthetic characteristics were obtained under the different dissolved oxygen concentration of brackish waters. The results showed that there was significant difference between the fitting light-response curves in four light-response models at the five levels of dissolved oxygen concentration in brackish water during the error tests. The optimal accuracy can be obtained in the non-rectangular hyperbolic model for all treatments. Specifically, the photosynthetic parameters indicated that the maximum net photosynthetic rate (Pmax), apparent quantum efficiency (), and dark respiration rate (R) under 18.5 mg/L treatment were significantly higher than those under other treatments. In 18.5 mg/L dissolved oxygen concentration, the net photosynthetic rate and fresh quality for the aboveground part of pakchoi were also significantly higher than those in other levels. Therefore, the 18.5 mg/L dissolved oxygen concentration can be optimal level for pakchoi cultivating with brackish water. The reason is that the dissolved oxygen in brackish water can enhance the shade tolerance and the ability to endure high light intensity of pakchoi, as well the available range of light intensity. In addition, the oxygenated treatment can also improve the physiological activity and efficient photosynthesis of pakchoi leaves, and thereby to achieve the high yield of pakchoi. The findings can provide a theoretical basis for the safe and efficient utilization of brackish water, while the alleviation of oxygen stress in crop roots for brackish water irrigation in arid areas.
photosynthesis; brackish water; dissolved oxygen; pakchoi; photosynthetic characteristic; light response model
孙燕,王怡琛,王全九. 增氧微咸水对小白菜光响应特征及产量的影响[J]. 农业工程学报,2020,36(9):116-123.doi:10.11975/j.issn.1002-6819.2020.09.013 http://www.tcsae.org
Sun Yan, Wang Yichen, Wang Quanjiu. Effects of oxygenated brackish water on light response characteristics and yield of pakchoi (L.)[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(9): 116-123. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.09.013 http://www.tcsae.org
2020-01-03
2020-02-28
国家自然科学基金重点项目(41830754);国家自然科学基金面上项目(51679190);陕西省自然科学基础研究计划一般项目(青年)(2019JQ-732)
孙燕,博士后,主要从事盐碱地改良与植物生理生态研究。Email:sunyan199058@126.com
王全九,教授,博士生导师,主要从事土壤物理与养分运移研究。Email:wquanjiu@163.com
10.11975/j.issn.1002-6819.2020.09.013
S121
A
1002-6819(2020)-09-0116-08
