载阿霉素混合胶束的制备及制剂工艺优化
2020-06-20韩利峰欧阳惠枝林亚娟王晓颖
韩利峰,欧阳惠枝,张 雪,林亚娟,徐 伟,王晓颖
(福建中医药大学药学院,福建 福州 350122)
聚合物胶束(polymeric micelles,PMs)由两亲性高分子聚合物在水性环境中自组装形成,其由亲水性外壳和疏水性内核组成且具有纳米级粒径结构的载体[1-2],能将疏水性药物包载于其疏水内核中,以增加水难溶性药物的溶解度[3]。阿霉素(DOX)又称多柔比星,通过插入DNA双链结构及抑制拓扑异构酶Ⅱ(TOP2)的功能,破坏DNA结构,产生细胞毒性作用[4]。但其溶解度低且无靶向性,易被糖蛋白外排引起多药耐药性,并且在临床应用中易引发严重的毒副反应[5-6]。本课题组前期以维生素E聚乙二醇琥珀酸酯(TPGS)、羧甲基壳聚糖(CMCS)、甘草次酸(GA)和大黄酸(R)为原料,分别合成了TPGS-甘草次酸偶联物(TG偶联物)和TPGS修饰的羧甲基壳聚糖-大黄酸偶联物(TCR偶联物),本研究以TG偶联物和TCR偶联物的混合物(TCR-TG)作为载体材料,制备载DOX的纳米胶束(DOX/TCR-TG胶束),并进行了制备工艺优化,为克服DOX临床应用缺陷寻找解决办法。
1 实验材料
1.1 试剂与材料 TG偶联物、TCR偶联物(自制);盐酸阿霉素(DOX·HCl,大连美伦生物技术有限公司);甲醇(色谱纯)、葡萄糖(分析纯)、甘露醇(分析纯),国药集团化学试剂有限公司;MWCO 14000透析袋(上海绿鸟科技发展有限公司)。
1.2 仪器 NICOMPTM 380ZLS动态激光粒径测定仪(美国Santa Bbarbara公司);MS105DU十万分之一电子天平(梅特勒-托利多仪器有限公司);TU-1901双光束紫外可见分光光度计(北京谱析通用仪器有限责任公司);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);ALPHA1-2 LD冷冻干燥机(德国Christ公司)。
2 方 法
2.1 DOX含量测定方法的建立 采用紫外-分光光度法对DOX/TCR-TG胶束中DOX的含量进行测定。
2.1.1 检测波长的确定 分别取DOX·HCl、TPGS、GA和R适量,用甲醇溶解稀释至合适浓度,在波长200~800 nm范围内进行扫描,确定DOX含量测定的检测波长。
2.1.2 线性关系考察 精密称取2 mg的DOX·HCl,用甲醇定容于10 mL容量瓶中,得0.2 mg/mL的DOX储备液,将此溶液稀释为 10、15、20、25、30 和 40 μg/mL的系列浓度,以甲醇为空白溶液,在检测波长处测定其吸光度值,以吸光度A对浓度C(μg/mL)进行线性回归。
2.1.3 精密度试验 取 15、20、40 μg/mL 的 DOX·HCl溶液,以甲醇为空白溶液,测定其吸光度值,计算RSD值。
2.1.4 回收率试验 精密称取TCR-TG载体材料6 mg,用1 mL水溶解,取100 μL置于5 mL容量瓶中,加入 0.2 mg/mL DOX·HCl储备液,甲醇稀释至刻度,分别配制成15、20、40 μg/mL 的 DOX·HCl溶液,每个浓度3份,在检测波长处测定吸光度值,计算回收率。
2.2 载药胶束制备及工艺考察
2.2.1 DOX·HCl脱盐 精密称取适量 DOX·HCl,用适量DMSO溶解后,磁力搅拌下加入三乙胺(DOX·HCl∶TEA=1∶3,n/n),搅拌过夜,即得脱盐后 30 mg/mL DOX的DMSO溶液。
2.2.2 DOX/TCR-TG胶束制备 采用透析法制备,称取TCR偶联物和TG偶联物的混合载体材料18 mg,加超纯水3 mL,冰水浴探头超声10 min,缓慢滴加浓度为30 mg/mL DOX的DMSO溶液352.9 μL到TCR-TG混合载体溶液中,剧烈搅拌20 min后,冰水浴探头超声30 min,置透析袋中,蒸馏水为透析介质,透析12 h。结束透析后,冰水浴探头超声20 min,用0.8 μm微孔滤膜过滤,冷冻干燥即得DOX/TCR-TG胶束。
2.2.3 TG偶联物和TCR偶联物混合比例考察 按照 TG 偶联物与 TCR 偶联物质量比为 3∶1、2∶1、1∶1、1∶2 和 1∶3 称取混合偶联物共 18 mg,按照“2.2.2”项下方法制备DOX/TCR-TG胶束,滴加400 μL DOX的DMSO溶液(30 mg/mL),考察TG偶联物和TCR偶联物的不同混合比例对TCR-TG混合载体载药的影响。
2.2.4 药物与载体的质量比(药载比,m/m)的考察称取 “2.2.3”项下筛选得到的最佳混合比例载体材料,按照“2.2.2”项下方法,改变DOX的质量来考察药载比为 1∶1、1∶1.3、1∶1.5、1∶1.7 和 1∶2 时,对载药的影响。
2.3 DOX/TCR-TG胶束冻干制剂的制备 采用冷冻干燥技术将胶束冻干成固体,以利于胶束长期储存。以载药胶束冻干后外观、再分散性、粒径及分布、载药量和包封率为评价指标,对其冻干制剂进行研究。
2.3.1 载药胶束冻干制剂的制备 以“2.2”项下筛选的最佳比例按透析法制备DOX/TCR-TG胶束。结束透析后,冰水浴探头超声20 min,加入适量冻干保护剂,用0.8 μm滤膜过滤,冷冻干燥即得。
2.3.2 冻干保护剂考察 以甘露醇和葡萄糖为冻干保护剂,其用量均为0.1%、0.2%和 0.4%(m/v),按“2.3.1”项下方法制备,考察上述冻干保护剂对DOX/TCR-TG胶束的外观、再分散性、粒径及分布、载药量和包封率的影响。
2.4 载药量和包封率的测定 采用紫外-可见分光光度法测定DOX/TCR-TG胶束的载药量(drug loading capacity,DL)及其包封率(entrapment efficiency,EE)。精密称取 4 mg DOX/TCR-TG 胶束,加2 mL纯水溶解,取250 μL用甲醇稀释至5 mL容量瓶,按“2.1”项下方法测定DOX吸光度值,并计算DOX的浓度,根据下列公式计算DOX/TCR-TG胶束的DL和EE。
上式中,m1为载入胶束中的DOX的量,m2为DOX的投药量,m为DOX/TCR-TG胶束的质量。
2.5 DOX/TCR-TG胶束的粒径及分布 称取4 mg DOX/TCR-TG胶束,冰水浴探头超声10 min,配制成1 mg/mL的胶束水溶液,用0.8 μm滤膜过滤,常温下用激光粒度仪(DLS)测定胶束的粒径及分布。
2.6 DOX/TCR-TG胶束的形态学研究 使用透射电子显微镜(TEM)观察载药纳米胶束的形貌。取适量DOX/TCR-TG胶束溶液,滴于铜网上,用滤纸吸去多余的溶液,2%的磷钨酸溶液负染,室温干燥,于透射电镜下观察拍照。
3 结 果
3.1 DOX含量测定方法的建立
3.1.1 DOX含量检测波长的确定 对DOX·HCl、TPGS、GA和R进行紫外全波长扫描,以甲醇为空白对照,确定在498 nm为DOX的测定波长,在该波长下其他各成分对DOX测定无干扰,见图1。
3.1.2 DOX标准曲线及线性范围 吸光度A对浓度C(μg/mL)进行线性回归,绘制标准曲线。线性回归方程为 A=0.020 7C-0.022 2(r=0.999 5),在 15~40 μg/mL浓度范围内线性关系良好。
3.1.3 精密度和回收率 高、中和低3个浓度的精密度与回收率均符合方法学要求,其中日内精密度RSD值分别为0.72%、0.39%和0.73%;日间精密度分别为1.06%、1.42%和1.18%;回收率分别是(100.11±0.98)%、(101.98±2.61)%和(99.70±1.91)%。
3.2 TG偶联物与TCR偶联物混合比例的影响TG偶联物与TCR偶联物混合比例对包载DOX的影响,见表1。TG偶联物与TCR偶联物混合比为2∶1、1∶1 和 1∶2 时,载药量和包封率均较其他比例的高,粒径相差不大,且混合比为1∶2时,Zeta电位值为(-20.07±2.76)mV,稳定性更好,故确定 TG 偶联物与TCR偶联物的混合投料比为1∶2。
表1 TG偶联物与TCR偶联物比例对载药能力的影响
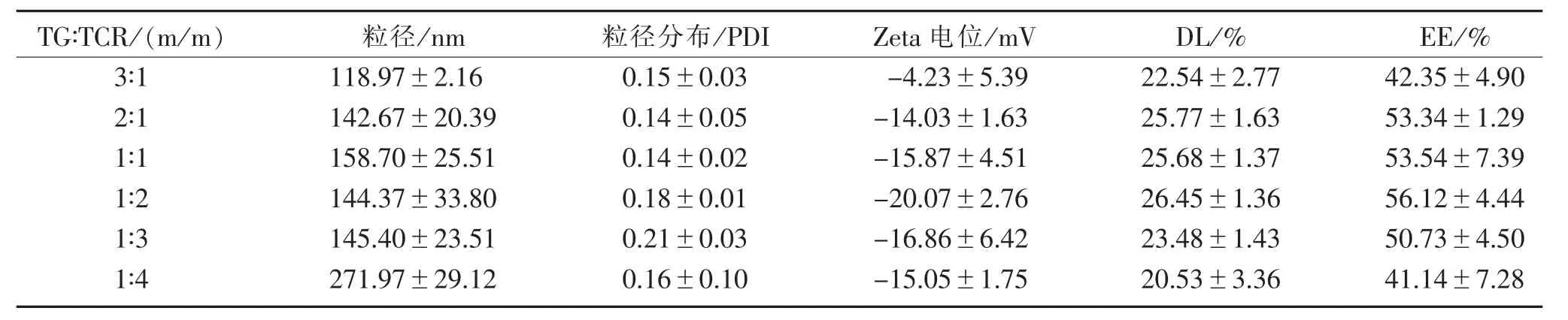
表1 TG偶联物与TCR偶联物比例对载药能力的影响
TG∶TCR/(m /m)3∶1 2∶1 1∶1 1∶2 1∶3 1∶4粒径/nm 118.97±2.16 142.67±20.39 158.70±25.51 144.37±33.80 145.40±23.51 271.97±29.12粒径分布/PDI 0.15±0.03 0.14±0.05 0.14±0.02 0.18±0.01 0.21±0.03 0.16±0.10 Zeta 电位 /mV-4.23±5.39-14.03±1.63-15.87±4.51-20.07±2.76-16.86±6.42-15.05±1.75 DL/%22.54±2.77 25.77±1.63 25.68±1.37 26.45±1.36 23.48±1.43 20.53±3.36 EE/%42.35±4.90 53.34±1.29 53.54±7.39 56.12±4.44 50.73±4.50 41.14±7.28
3.3 药载比的影响 药物与载体材料的投料比对混合聚合物胶束包载DOX能力的影响见表2。由表可知,当药载比为1∶1时,载药量最高,但其粒径较大,Zeta电位绝对值最小,故稳定性较差。而药载比为 1∶1.7 时,其粒径为(121.3±8.49)nm,且包封率达到(62.59±6.39)%,故综合考虑粒径及分布、Zeta电位、载药量和包封率,最终确定药物与载体的投料比为 1∶1.7。
表2 药载比对载药能力的影响
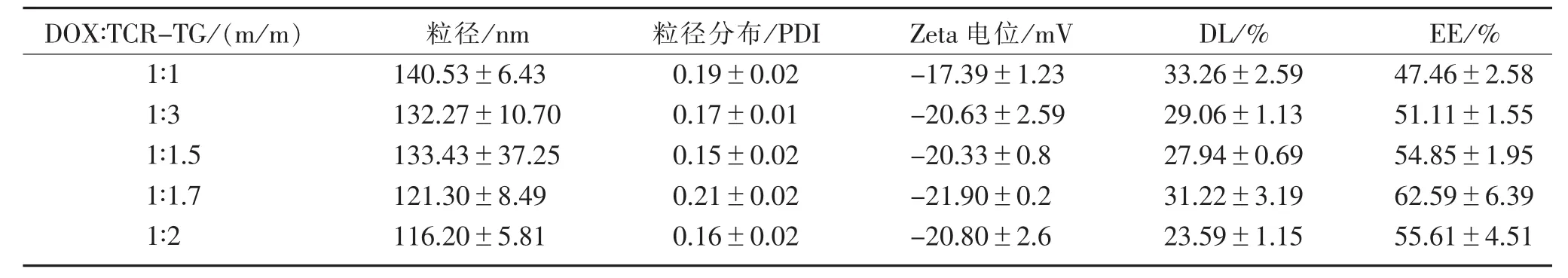
表2 药载比对载药能力的影响
DOX∶TCR-TG/(m/m)1∶1 1∶3 1∶1.5 1∶1.7 1∶2粒径/nm 140.53±6.43 132.27±10.70 133.43±37.25 121.30±8.49 116.20±5.81粒径分布/PDI 0.19±0.02 0.17±0.01 0.15±0.02 0.21±0.02 0.16±0.02 Zeta 电位 /mV-17.39±1.23-20.63±2.59-20.33±0.8-21.90±0.2-20.80±2.6 DL/%33.26±2.59 29.06±1.13 27.94±0.69 31.22±3.19 23.59±1.15 EE/%47.46±2.58 51.11±1.55 54.85±1.95 62.59±6.39 55.61±4.51
3.4 不同冻干保护剂的影响 冻干保护剂对DOX/TCR-TG胶束冻干制剂研究结果见表3。DOX/TCRTG冻干制剂均具有良好的复溶性,复溶后均为红色澄清透明液体。综合考虑各考察指标,最终选用0.1%甘露醇为冻干保护剂,虽然粒径稍大,但其分布均匀,包封率、载药量最好。
表3 不同冻干保护剂的影响

表3 不同冻干保护剂的影响
冻干保护剂无保护剂0.1%甘露醇0.2%甘露醇0.4%甘露醇0.1%葡萄糖0.2%葡萄糖0.4%葡萄糖粒径/nm 133.77±9.15 160.57±21.72 137.97±7.15 136.70±1.22 137.57±1.27 128.20±2.43 131.17±6.37粒径分布/PDI 0.14±0.01 0.11±0.04 0.11±0.01 0.09±0.03 0.10±0.03 0.12±0.01 0.10±0.02 Zeta 电位 /mV-18.41±2.64-17.65±1.45-12.69±3.03-16.19±7.52-13.72±2.83-14.59±5.93-17.17±4.61 DL/%30.05±6.61 30.70±0.56 26.86±1.17 19.74±1.57 29.36±1.51 28.43±1.17 20.30±2.87 EE/%45.40±0.11 73.08±3.65 53.68±3.78 72.88±5.55 69.71±4.67 69.14±4.93 54.52±6.31
3.5 DOX/TCR-TG胶束粒径及形态学 DOX/TCRTG载药胶束的粒径分布如图2所示,TEM形态学特征图如图3所示,由图可见胶束粒径分布均匀,形态结构圆整。
4 讨 论
透析法是将两亲性聚合物和药物共同溶解于与水互溶的混合溶剂中,然后倒入透析袋中,置于水中透析除去混合溶剂,待溶剂除去完全,透析袋中便是包载药物的胶束水溶液。透析法具有操作简单、载药效率高等特点,故本研究采用透析法制DOX/TCR-TG混合胶束。
通过对DOX/TCR-TG胶束的粒径及分布、载药量和包封率的综合评价,最终确定TG偶联物和TCR偶联物的最佳混合比例为1:2,DOX与TCR-TG载体的最佳药载比为1:1.7,所制备载药胶束粒径较小,分布均匀,载药量和包封率均较高,为后续深入研究该胶束递药系统奠定了良好的基础。
本文所用载体材料TG偶联物中甘草次酸具有肝靶向性,有利于引导DOX到达肝部治疗肝癌;TG偶联物和TCR偶联物中的TPGS具有P-糖蛋白抑制功能,有利于克服DOX在应用中多药耐药现象的发生;并且该两种偶联物混合后对DOX有良好的增溶作用,克服了DOX水溶性差的缺点。综上,该混合胶束对DOX的包载和递送作用具有较好的临床应用前景,其体内、外研究将进一步深入研究。
