Eu-MOF荧光猝灭法检测甲硝唑*
2020-06-19刘宇霞诸葛文凤彭金云
刘宇霞,诸葛文凤,彭金云
(1 广西民族师范学院物理与电子工程学院,广西 崇左 532200;2 广西民族师范学院化学化工学院,广西 崇左 532200;3 河南中医药大学药学院,河南 郑州 450046)
甲硝唑(Metronidazole,MNZ)是硝基咪唑衍生物,可以抑制细胞DNA的合成,干扰细胞新陈代谢,起到快速杀灭厌氧细菌和厌氧微生物的作用[1]。在临床上,MNZ广泛用于治疗肠道和肠外阿米巴病、阴道滴虫病、厌氧菌感染等,具有毒性小、疗效好的特点[2]。MNZ逾量会损害胃肠系统、皮肤及其附件、中枢及外周神经系统,甚至出现心脏毒性反应[3]。另一方面,因其具有良好的抑菌效果,甲硝唑作为饲料添加剂曾在畜牧养殖业中被广泛应用[4],但是相关毒理研究显示甲硝唑具有潜在的致癌性。为保证食品安全,建立一种快速、灵敏的MNZ定量分析方法对药物质量控制和食品安全监测具有重要的意义。目前,MNZ的国家标准测定方法是滴定法,除此之外,其检测方法还有高效液相色谱法(HPLC)[5]、电化学法(EC)[6-7]、气相色谱-质谱联用法(GC-MS)[8]。但是,HPLC法的样品前处理复杂;EC稳定性不好,准确度不高;GC-MS设备昂贵、操作复杂等问题,所以建立一种操作简单、成本低的MNZ检测方法是有必要的。
荧光分光光度法具有灵敏度高、专属性强、样品需要量少、操作便捷、设备费用低等特点,在分析领域成为一种重要的分析技术。目前,荧光分光光度法应用于食品分析[9]、环境监测[10]、药物含量测定[11]等领域。稀土金属有机骨架材料(MOFs),与传统的有机材料相比,具有发光位点丰富、比表面积大及孔隙丰富、合成方法简单等独特的性能优势。近年来,关于MOFs材料在荧光分析技术中的应用报道越来越多,如在硝基苯类化合物[12]、沙门氏菌[13]、重金属离子[14]、葡萄糖[15]检测等。目前还未见报道Eu-MOF作为荧光探针用于检测MNZ。本文以Eu-MOF作为荧光探针,利用MNZ对荧光探针的淬灭作用,建立了一种快速、灵敏、结果可靠的MNZ检测方法。
1 实 验
1.1 材料与仪器
甲硝唑(99%)、硝酸铕(Eu(NO3)3·6H2O)、对苯二甲酸(H2BDC)购于上海阿拉丁试剂网;氢氧化钠(NaOH)、聚乙二醇6000、甲醇来自成都市科隆化学品有限公司。甲硝唑片来源远大医药(中国)有限公司,产品批号:190707。实验用水为二次重蒸水。
RF-5301pc荧光分光光度计,日本岛津公司;XH-200A微波合成仪,北京祥鹄科技发展有限公司。
1.2 实验方法
Eu-MOF的合成:参考文献[16]合成。具体步骤如下:将NaOH (66.3 mg)、H2BDC (112.4 mg)和Eu(NO3)3·6H2O(220.9 mg)加入到15 mL水/甲醇(17:3)溶液中,超声分散30 min使其溶解。将混合物置于微波辅助合成仪内在600 W、130 ℃微波加热1 h,反应结束后冷却至室温,产物用水和乙醇洗涤数次,100 ℃真空干燥24 h,得到白色Eu-MOF粉末。
Eu-MOF溶液的制备:取4 mg Eu-MOF材料,80 mg聚乙二醇,分散在100 mL甲醇中,超声30 min,得到Eu-MOF荧光探针溶液。
MNZ实际样品溶液的配置:精密称取20片,研磨,称取一片的量(相当于甲硝唑0.2 g),加适量的水超声溶解,定容至50 mL,过滤;取滤液10 mL定容至100 mL,MNZ浓度为2.34×10-3mol/L,存储在4 ℃冰箱备用。
荧光检测实验:在10 mL比色管中加入3 mL Eu-MOF荧光探针溶液,一定体积的MNZ标准溶液(1×10-3mol/L),加水定容至刻度,摇匀,激发波长323 nm,激发狭缝宽度3 nm,发射狭缝宽5 nm,测定体系荧光强度(F)。以同样的方法配置不加MNZ的空白溶液,测定体系荧光强度(F0)。
2 结果与讨论
2.1 Eu-MOF与MNZ的荧光特性

图1 Eu-MOF(a)、Eu-MOF+MNZ(b)、MNZ(c)的荧光光谱图Fig.1 Fluorescence spectra of Eu-MOF (a), Eu-MOF+ MNZ (b), MNZ (c)
如图1所示,Eu-MOF材料在616 nm处具有很强的荧光吸收,MNZ标准溶液没有荧光吸收,一定量的MNZ加入Eu-MOF荧光探针溶液中,MNZ对Eu-MOF的荧光猝灭效应很明显。因此,以Eu-MOF荧光探针对MNZ的选择性检测具有重要的意义。
2.2 Eu-MOF用量优化
Eu-MOF荧光探针溶液的用量是影响检测体系的一个重要因素,对此考察了不同Eu-MOF溶液的用量对检测体系荧光强度F0/F的影响。如图2所示,随着Eu-MOF用量的增加,F0/F比值逐渐增大,当Eu-MOF的用量增到3 mL时,F0/F比值达到最大值,用量继续增加F0/F比值反而减小。因此,该方法Eu-MOF溶液的最佳用量为3 mL。
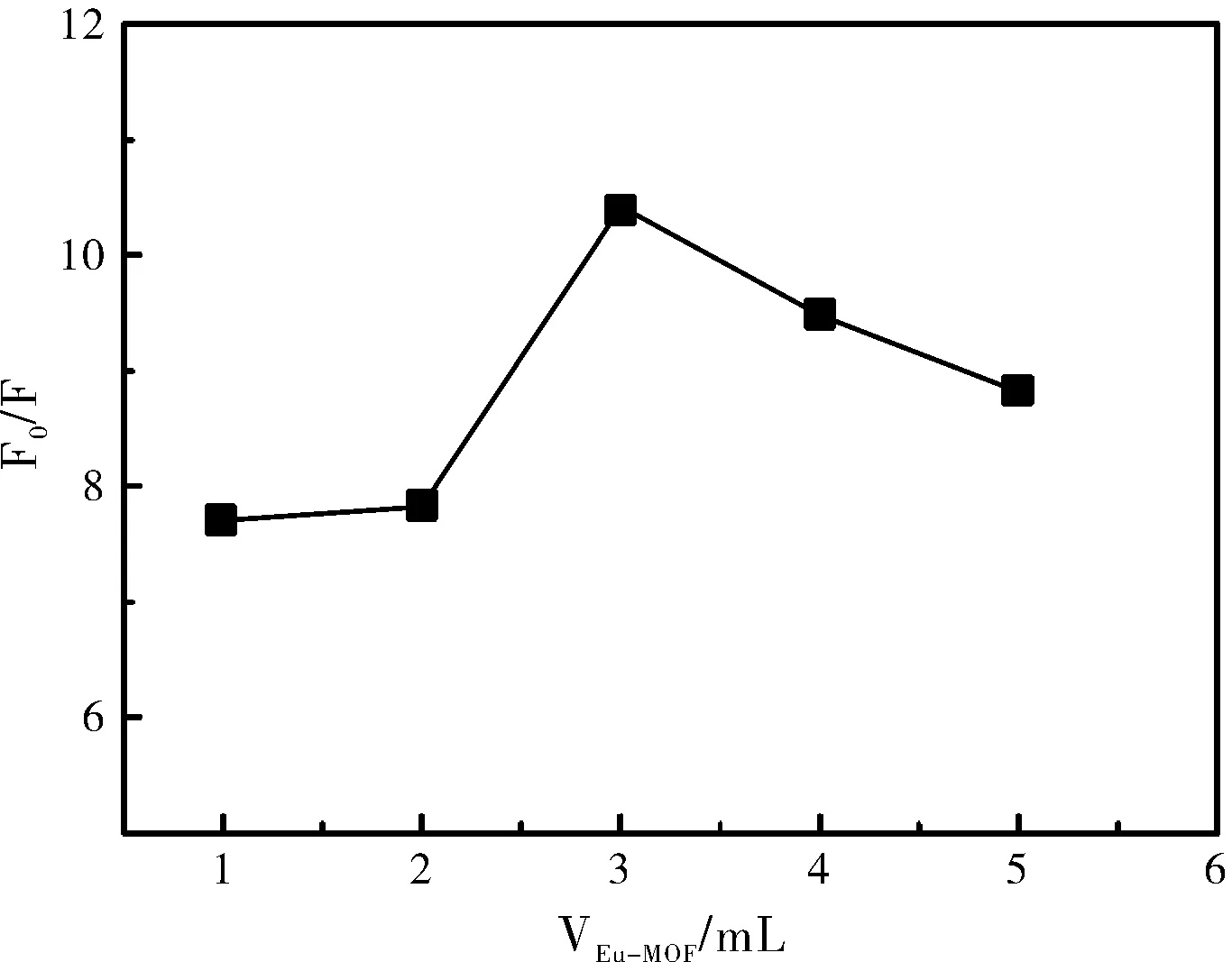
图2 Eu-MOF用量对Eu-MOF-MNZ体系的影响Fig.2 Effect of the volume of Eu-MOF on fluorescence intensity of Eu-MOF-MNZ
2.3 稳定性实验
在室温下,每隔20 min测定空白溶液和含有5.0×10-5mol/L MNZ的Eu-MOF荧光探针溶液的荧光强度,考察反应时间对荧光强度的影响。如图3所示,MNZ与Eu-MOF材料反应迅速,并且在160 min内能保持荧光信号稳定。

图3 反应时间对Eu-MOF-MNZ体系荧光强度的影响Fig.3 Effect of the reaction time on fluorescence intensity of Eu-MOF-MNZ
2.4 建立标准曲线
在优化实验条件下,准确移取不同浓度MNZ标准液加到含有一定Eu-MOF的溶液中。在323 nm激发波长下扫发射光谱,发射光谱如图4所示。随着MNZ浓度增大,Eu-MOF荧光猝灭增加,并且F0/F与MNZ浓度(C)呈良好的线性关系,在0.1~50.0 μmol/L浓度范围内,线性方程为F0/F=14430.04C+1.04,R1=0.9962;在50.0~100.0 μmol/L浓度范围内,线性方程为F0/F=30239.44C+0.24,R2=0.9997。
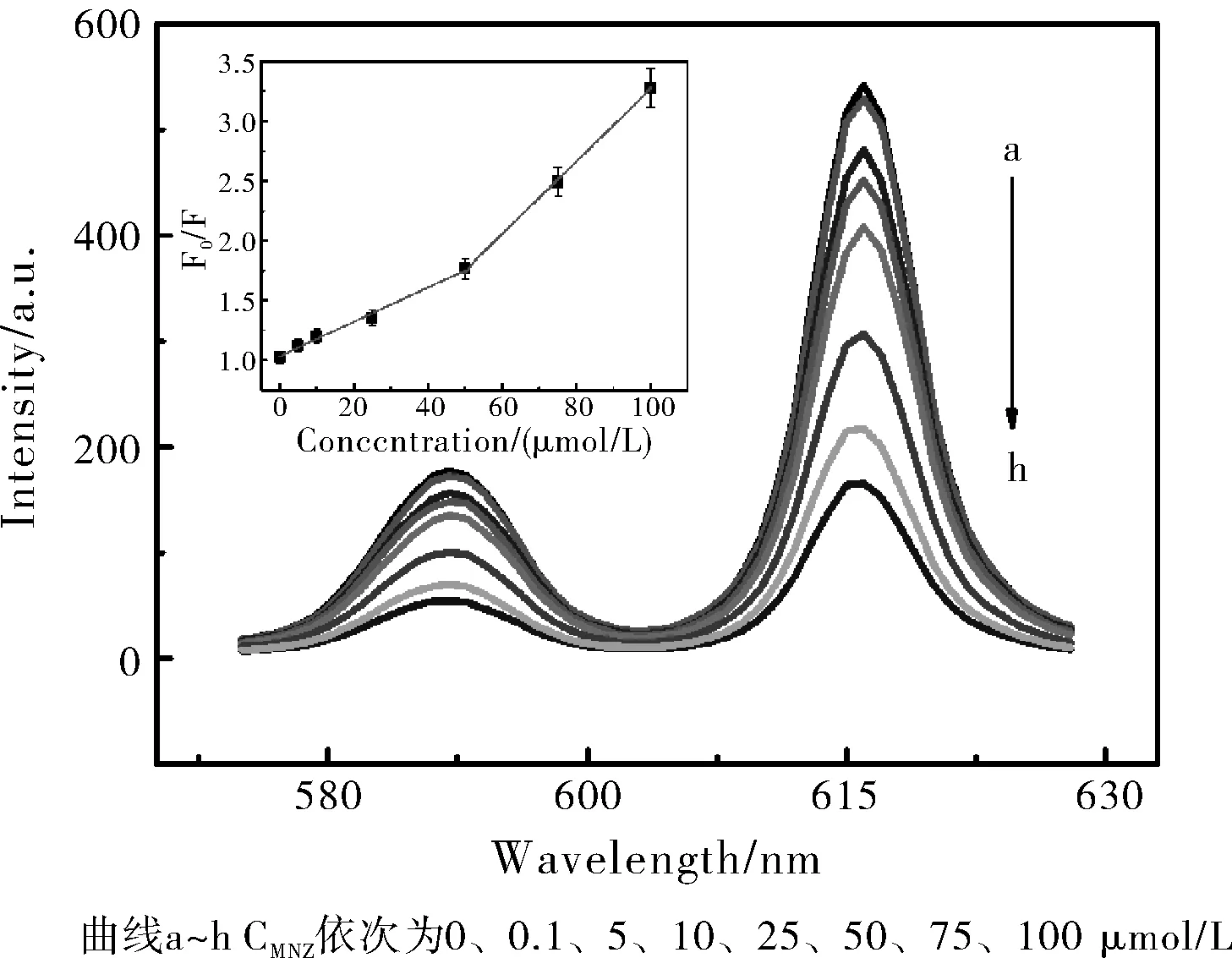
图4 Eu-MOF溶液中加入不同浓度MNZ的荧光光谱图Fig.4 Fluorescence spectra of Eu-MOF in the presence of MNZ
2.5 共存离子的干扰
以1.0×10-5mol/L的MNZ为测试对象,加入共存组分,允许测定值的相对误差小于或等于±5%,进行组分干扰试验。在200倍的葡萄糖、蔗糖、麦芽糖、糊精、甘氨酸、L-半胱氨酸、尿素、K+、Mg2+、Ca2+、Cl-、Br-存在下不影响MNZ的测定,表明该方法具有良好的抗干扰能力,能应用于实际样品中的MNZ分析。
2.6 实际样品检测
荧光分光光度法测定甲硝唑药片中MNZ含量的结果与参考方法(UV-Vis法)[17]测定结果见表1。结果表明本工作建立的方法与UV-Vis法测定的结果吻合。
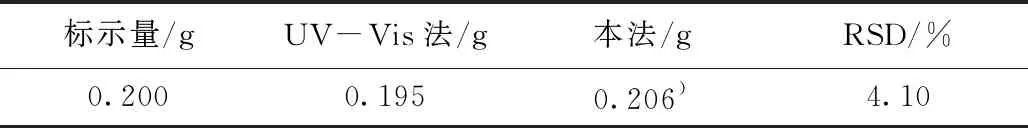
表1 甲硝唑片中MNZ的含量测定(n=5)Table 1 Detection of MNZ in the Metronidazole tablets
3 结 论
本文采用微波法制备Eu-MOF材料,并建立了以Eu-MOF溶液为荧光探针对MNZ定量分析的荧光检测法。该方法具有成本低,操作简单,响应快速,灵敏度高等优势,可用于甲硝唑实际样品中MNZ含量测定,结果令人满意。
