白细胞介素33对人肝癌Hep3B细胞与Huh-7细胞的增殖、迁移和侵袭的影响▲
2020-06-19邱丽芳韦忠恒黄赞松张倬彬赵立峰覃小珊
邱丽芳 韦忠恒 黄赞松 张倬彬 赵立峰 覃小珊
(1 右江民族医学院研究生学院, 广西百色市 533000,电子邮箱:871975831@qq.com;右江民族医学院附属医院2 肿瘤科,3 消化内科,广西百色市 533000)
原发性肝癌是全球导致癌性死亡的第二大癌症,肝癌治疗难的主要原因在于肿瘤的转移与复发[1]。人白细胞介素(interleukin,IL)-33为一类处于肿瘤微环境中的细胞因子,其属于IL-1家族,是一种由受损或坏死的内皮细胞和上皮细胞释放的细胞内源性“警报素”[2]。Wei等[3]发现,IL-33 水平与HBsAg阴性的肝癌患者的患病风险呈负相关,说明它可能是肝癌患者的保护性因素。IL-33的自身受体为致癌性抑制基因2,两者相互结合后搭建相应信号途径,从而影响炎性反应、肿瘤免疫与细胞免疫[4-6]。最近的研究显示,IL-33/致癌性抑制基因2信号通路通过诱导多种细胞因子表达,在多种癌症的发生和进展中扮演着重要角色,包括肿瘤细胞增殖、局部侵袭、远处转移、免疫原性等[7],但其在肝癌中的生物学功能及其潜在作用机制尚未完全阐明。本实验旨在分析外源性 IL-33对人肝癌Hep3B细胞、Huh-7细胞的增殖、转移与侵袭的影响,探讨其可能的内在机制。
1 材料与方法
1.1 主要试剂及药物 人肝癌Hep3B细胞株、Huh-7细胞株均来源于上海生命科学研究院细胞所;IL-33、二甲基亚砜(dimethyl sulfoxide,DMSO)由Sigma公司生产(批号:SRP4193、RNBG8041),胎牛血清由Gibco公司生产(批号: 42F7180K),杜氏改良伊格尔培养基(Dulbecco′s modified eagle medium,DMEM)由HyClone公司生产(批号: SH30022.01);胰酶(批号:89040101100 )、抗生素(嘌呤霉素,规格:2 μg/mL,批号:87020101100)均由Invitrogen公司生产;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒由上海生工公司生产(批号:A600799-0005);基质胶及Transwell小室购自Corning 公司(批号:3413)。
1.2 主要仪器 荧光倒置显微镜购自奥林巴斯公司(型号:CKX41);CO2恒温培养箱由美国Thermo公司生产(型号:3111);超净工作台(型号:BSC-1300-II-A2)与离心机(型号:TD6)购自山东博科生物产业有限公司; 液氮贮存罐购自乐山亚西机器厂;酶标仪购自BioTek公司(型号:ELx800)。
1.3 实验方法
1.3.1 细胞培养:将Hep3B细胞和Huh-7细胞分别置于含10%胎牛血清的DMEM培养基中,在37℃、湿度为100%、5% CO2的孵箱内培养48 h,取处于对数生长期、生长状态良好的Hep3B细胞和Huh-7细胞用于后续实验。
1.3.2 MTT实验:Hep3B细胞、Huh-7细胞均按照实验组(IL-33浓度为20 ng/L组、40 ng/L组、60 ng/L组)及对照组进行实验。取Hep3B细胞、Huh-7细胞,用0.25%胰酶1 mL消化3 min,计数后接种于96孔板,接种密度为1×104个/孔,37℃培养24 h后将培养液倒掉,各实验组分别加入3 mL相应浓度的IL-33,对照组不加入IL-33(加入等量溶剂)。于37℃、5% CO2培养箱孵育24 h。将MTT溶液(浓度为5 mg/mL)添加至孔板内,0.02 mL/孔。在原培养条件下继续培养4 h后,将孔中上清液倒掉,各孔添加0.15 mL的DMSO,置于振荡仪上振荡10 min,使结晶体彻底溶解,使用酶标仪检测波长为490 nm时每个孔的吸光度值,每组重复3次,取平均值,记录结果。
1.3.3 细胞划痕实验:Hep3B细胞与Huh-7细胞均按照实验组及对照组进行实验。取Hep3B细胞与Huh-7细胞,使用0.25%胰酶1 mL消化3 min,得到单细胞悬液后,接种于6孔培养板,接种密度为6×105个/孔,于37℃、5% CO2培养箱中继续培养24 h,此时悬浮细胞几乎全部融合。然后对孔内细胞液进行垂直划痕,用磷酸缓冲盐溶液洗涤细胞3次,约2 min/次,使得划下细胞被清除。添加3 mL无血清DMEM培养基,此时点记作0 h时,实验组再加入终浓度为60 ng/L的IL-33 0.18 ng(总体积为3 mL),将等量培养液添加至对照组,培养条件同上。0 h及培养24 h后取样、拍照、测量划痕宽度并记录,其中使用Adobe Illustrator CS6软件测量划痕宽度,计算迁移率,迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,实验重复3次,取平均值。
1.3.4 细胞侵袭实验:Hep3B细胞与Huh-7细胞均按照实验组及对照组进行实验。将Transwell小室放于24孔板中,依次放入0.3 mL无血清培养基以及0.06 mL基质胶,充分混合,取0.1 mL混合液进行人工基底膜的制备,在无菌环境下过夜处理。实验前重新成胶,取Hep3B细胞与Huh-7细胞,使用0.25%胰酶1 mL消化3 min后,用无血清培养基冲洗3次(约2 min/次),同时进行细胞计数,随后实验组加入0.18 ng IL-33(总体积为3 mL,终浓度为60 ng/L),对照组不采取任何处理,37℃培养24 h后逐一取细胞悬液0.15 mL,分别接种于已成胶的Transwell小室内。另取完整培养基,内含DMEM+10%胎牛血清+双抗0.6 mL添加至下室,于37℃培养箱内常规孵育1 d。将Transwell小室取出,使用磷酸缓冲盐溶液冲洗2次,约2 min/次,之后使用多聚甲醛固定20 min,再用结晶紫染色液实施染色处理,时间约为20 min,由磷酸缓冲盐溶液冲洗2次,约2 min/次,制片,通过显微镜查看膜下层肿瘤细胞,同时各组随机确定5个视野进行细胞计数,每组重复3次,取平均值,同时拍照。
1.4 统计学分析 使用SPSS 24.0软件进行统计分析。计量资料以(x±s)表示,两组间比较采用独立样本t检验;多组比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞增殖活性 20 ng/L组、40 ng/L组、60 ng/L组的Hep3B细胞和Huh-7细胞增殖活性均高于对照组(均P<0.05),60 ng/L组的Hep3B细胞和Huh-7细胞增殖活性高于20 ng/L组、40 ng/L组(均P<0.05),但20 ng/L组与40 ng/L组差异无统计学意义(P>0.05)。 见表1。
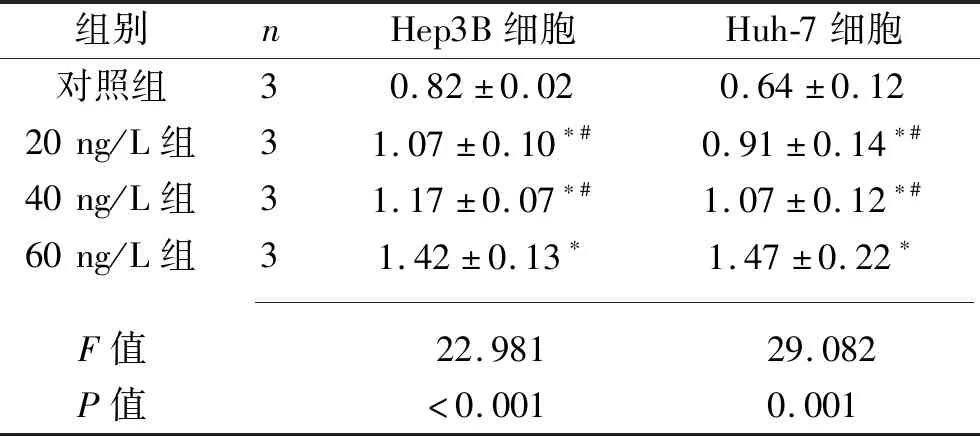
表1 4组Hep3B细胞和Huh-7细胞的吸光度值(x±s)
注:与对照组比较,*P<0.05;与60 ng/L组比较,#P<0.05。
2.2 各组细胞迁移率 实验组Hep3B细胞和Huh-7细胞的迁移率均低于对照组(均P<0.05),见表2及图1。
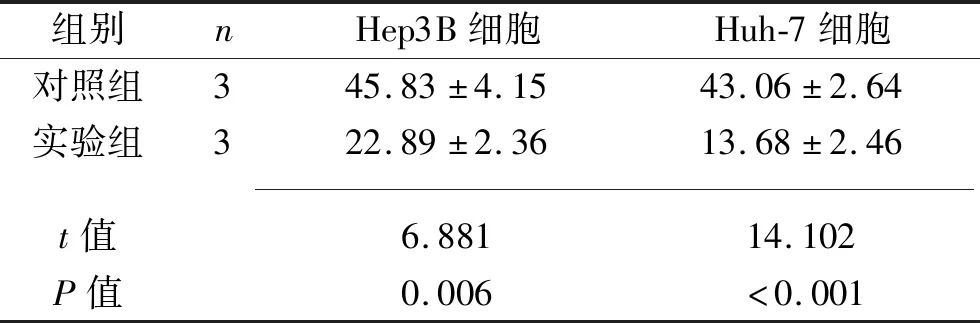
表2 两组人肝癌Hep3B细胞和Huh-7细胞的迁移率比较(x±s,%)

图1 两组人肝癌Hep3B细胞和Huh-7细胞不同时间点的划痕宽度
2.3 各组细胞的侵袭能力 实验组人肝癌Hep3B细胞与Huh-7细胞穿过 Transwell 小室的数量少于对照组(均P<0.05),见表3及图2。

表3 两组人肝癌Hep3B细胞和Huh-7细胞的侵袭力比较(x±s,个/高倍视野)
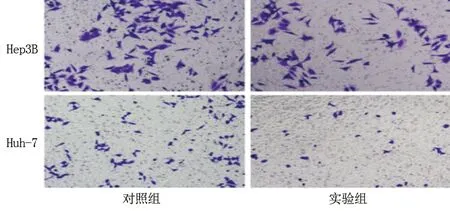
图2 两组人Hep3B细胞和Huh-7细胞的侵袭能力(结晶紫染色,×200)
3 讨 论
肿瘤中的炎症细胞或免疫细胞,可以通过产生促肿瘤细胞因子和其他因子来影响肿瘤细胞的生长、侵袭和转移。在肿瘤微环境中,IL-33被证实具有转录因子和细胞因子双重功能[2]。最近几年,越来越多研究表明IL-33在恶性实体瘤中具有促肿瘤作用,表现为促进肿瘤细胞增殖、迁移、侵袭和肿瘤血管增生,抑制肿瘤细胞凋亡等。例如,Wang等[8]通过转染IL-33表达载体,分析其生长和侵袭情况,发现IL-33的激活促进了非小细胞肺癌细胞的生长和转移;Yu等[9]发现,IL-33具有促进胃癌细胞侵袭与迁移的作用,并呈剂量依赖性;Wu等[10]发现,IL-33通过与其受体致癌性抑制基因2结合和激活c-Jun氨基末端激酶信号通路促进肾癌细胞增殖,且在肾癌组织中的IL-33表达增高,与疾病分期、预后相关;此外,IL-33在人大肠癌组织中的表达上调,其通过重塑肿瘤微环境和诱导肿瘤血管生成,对结肠癌形成与肝转移具有促进作用,且呈剂量依赖性[11-12]。然而,也有学者发现,IL-33在实体瘤中表现为抗肿瘤作用,例如Chen等[13]发现 IL-33可抑制结肠癌细胞增殖并诱导其凋亡,表现出明显的抗肿瘤作用。由此可见,IL-33在不同的生物学环境或不同的肿瘤中的作用不同且较为复杂。研究表明,肝癌患者血清IL-33表达水平较健康人群升高,已发生转移的肝癌患者IL-33的表达水平高于未发生转移的肝癌患者[14-15]。但目前国内外涉及IL-33与肝癌相关性的研究不多,了解IL-33在肝癌细胞的生长和转移中的作用,将有助于充分发挥其在抗癌治疗中的潜力。
本课题组在前期研究中发现,IL-33在肝癌组织中的表达明显低于癌旁组织[16]。本实验进一步探讨IL-33对人肝癌Hep3B细胞和Huh-7细胞增殖、迁移、侵袭等生物学行为的影响。结果显示,20 ng/L组、40 ng/L组、60 ng/L组的Hep3B细胞和Huh-7细胞增殖活性均高于对照组(均P<0.05),提示不同浓度外源性IL-33 均可促进人肝癌Hep3B细胞和Huh-7细胞增殖;60 ng/L组的Hep3B细胞和Huh-7细胞增殖活性高于20 ng/L组、40 ng/L组(均P<0.05),但20 ng/L组与40 ng/L组差异无统计学意义(P>0.05),提示适当提高IL-33浓度可增强其促进肝癌细胞增殖的作用。细胞划痕实验及侵袭实验结果显示,与对照组比较,实验组的人肝癌Hep3B细胞和Huh-7细胞迁移率及侵袭能力均降低(均P<0.05),这表明外源性的IL-33可抑制人肝癌Hep3B细胞和Huh-7细胞的迁移与侵袭行为。本研究结果表明,IL-33可对肝癌细胞增殖施以促进作用,同时还能够使此类细胞的侵袭与迁移行为减弱,提示其在肝癌中表现出促癌及抑癌双重作用,与目前国内外关于IL-33对多数实体瘤作用的研究结果[10,17-18]相似。针对IL-33具有促癌和抑癌双重作用的特点,部分研究者认为 IL-33促进肿瘤的增殖、侵袭和转移是通过激活核因子κB 信号通路,诱导金属蛋白酶及血管内皮生长因子表达的增加,以诱导肿瘤血管的生成,提升肿瘤细胞的侵袭与生长水平[19]。 此外,核因子κB的亚基P65还可以诱导上皮间质转化,改变细胞性质和细胞形态,导致各细胞间黏附力减弱甚至消失,由此使癌细胞迁移增强[20]。另有学者认为,IL-33的抗肿瘤作用是通过诱导核因子κB通路的活化,使得自然杀伤细胞以及CD8+T淋巴细胞亚群CD69水平上调,从而导致这两类细胞活化,对免疫反应施以调控,进而达到抗肿瘤目的[21]。 除此之外,IL-33 还通过刺激细胞毒性T细胞1产生干扰素γ,进而刺激自然杀伤T淋巴细胞,调节Th1 型免疫活动,共同发挥抗肿瘤作用[22]。可见,在不同的肿瘤微环境中,IL-33对肿瘤细胞产生的作用是不同的,无论是作为促癌基因还是抑癌基因,IL-33对于肝癌的增值、侵袭与迁移均存在一定影响性。
综上所述, IL-33可促进人肝癌Hep3B细胞和Huh-7细胞增殖,同时又可抑制其迁移、侵袭。IL-33可能在肝癌形成与发展中起到关键性作用,但其在体内的作用并未阐明。肿瘤的发生发展是在一个相互影响、相互作用的有机整体环境下进行的,故后续我们将进行一系列体内实验,进一步探索IL-33 在体内对肝癌细胞生物学行为的影响,以期寻找靶向治疗肝癌的靶点。
