大豆肽的硅藻土脱色工艺优化
2020-06-19李成辉王洪彩李明月
王 松,李成辉,王洪彩,李明月,刘 彤,刘 军
(1. 山东禹王生态食业有限公司,山东 德州 251200; 2.东北农业大学 食品学院,哈尔滨 150030)
大豆肽是豆粕或大豆分离蛋白(SPI)经水解或微生物发酵获得的不完全水解蛋白产物,是低相对分子质量肽的混合物。近年来研究[1]表明,大豆肽能改善大豆蛋白的物理功能性质(如溶解性提高,黏性降低,抗凝胶性增强等),且具有良好的抗氧化、调节血脂水平、降血压、提高免疫、抗癌、增强运动员肌肉和恢复疲劳等特性。因此,大豆肽产品能应用于乳制品、肉类、饮料以及婴儿食品中,在食品蛋白质辅料加工方面有着特殊意义[2]。但因为原料中含有微量的呈色物质(如皂苷、色素和异黄酮等),以及豆粕中糖类在高温下的焦糖化反应,大豆肽呈现灰黄色,这会影响食品色泽,降低消费者购买欲,从而局限了其在食品工业中的应用。
工业常用的大豆肽脱色方法是吸附脱色法,包括阴离子交换树脂脱色、活性炭脱色、白土脱色等。其中,最常用的脱色剂是活性炭,脱色率为50%以上[3]。但活性炭对大分子物质的吸附力不够,对疏水性物质吸附效果差;且价格较高及不易再生,提高了生产成本。与活性炭相比,硅藻土除了具有良好的吸附功能,还具有资源丰富、价格低廉等优势。硅藻土在饮料、啤酒、白糖等食品的生产工艺中被作为脱色剂广泛应用[4-6],但还没有应用在大豆肽脱色工艺中的报道。
然而,硅藻土在吸附呈色物质的同时也会吸附氨基酸,使大豆肽中的氨基酸含量下降,影响产品品质。因此,在脱色的同时,保证大豆肽中氨基酸的低损耗是硅藻土脱色工艺的关键。不同氨基酸分子中含有的氨基(—NH)和羧基(—COOH)数目不同,所以其等电点各不相同。硅藻土的表面电荷也会根据溶液的酸碱度变化而不同,在酸性条件下,硅藻土的羟基会被质子化,表面带正电荷,此时的硅藻土与表面带正电荷的氨基酸相互排斥,与带负电荷的氨基酸相互吸引;反之,当溶液pH大于7时,硅藻土排斥带负电荷的氨基酸[6]。因此,通过调控溶液的pH可以在一定程度上控制氨基酸的损耗率。
本研究选用硅藻土为脱色剂,针对大豆肽颜色深的问题,研究pH、温度、时间及硅藻土添加量对大豆肽脱色的影响,在不改变原始大豆肽生产工艺的同时,创建新的大豆肽脱色工艺。
1 材料与方法
1.1 试验材料
大豆分离蛋白粉(蛋白质含量92%),中性蛋白酶(酶活≥20万U/g),碱性蛋白酶(酶活≥40万U/g),硅藻土(食品级),无水CuSO4、HCl、KNaC4H4O6·4H2O、NaOH均为分析纯,标准蛋白溶液(5.0 mg/mL)。
712E型可见光分光光度计,恒温水浴锅,超低温冷冻储存箱,电子天平,FE28酸度计。
1.2 试验方法
1.2.1 大豆肽的制备
大豆分离蛋白粉用去离子水稀释至10%,调节pH到6.7,加入0.02%中性蛋白酶作用15 min后,85℃灭菌。将灭菌的溶液置于55℃水浴加热,待溶液达到55℃,将0.3%碱性蛋白酶和0.18%中性蛋白酶同时加入溶液中,酶解50 min。然后将溶液于90℃水浴中灭酶15 min,4 000 r/min离心10 min,取上清液,即为大豆肽溶液,待用。
1.2.2 大豆肽的脱色
取100 mL大豆肽溶液,加入一定量硅藻土,用1 mol/L氢氧化钠溶液和1 mol/L盐酸溶液调节pH,置于一定温度的恒温水浴中,磁力搅拌一定时间后,取出用纱布过滤,得到大豆肽脱色液。
1.2.3 脱色率的计算
以去离子水为参照,在400 nm波长下测定未经脱色的大豆肽溶液和大豆肽脱色液的吸光度,按下式计算脱色率[7]。
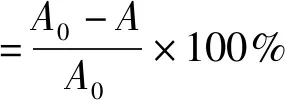
式中:A0为未脱色的大豆肽溶液的吸光度;A为大豆肽脱色液的吸光度。
1.2.4 蛋白质损耗率的计算
1.2.4.1 蛋白质含量测定
采用双缩脲法测定蛋白质含量。1.5 g无水硫酸铜和6.0 g酒石酸钾钠溶解于500 mL水中,边搅拌边加入300 mL 10% NaOH溶液,再加入去离子水定容至1 L,配制成双缩脲试剂,避光保存于塑料瓶中[8]。
取12支试管均分为两组,每组分别加入0、0.2、0.4、0.6、0.8、1.0 mL质量浓度为5.0 mg/mL的标准蛋白溶液。用蒸馏水补充至1 mL,再分别加入4 mL双缩脲试剂,振荡混匀后,在室温(20~25℃)下放置30 min。以不加标准蛋白溶液的试样为参照,在540 nm波长下测定吸光度。以蛋白质含量为横坐标,吸光度为纵坐标绘制标准曲线。根据标准曲线以及样品溶液的吸光度计算样品的蛋白质含量[9]。
1.2.4.2 蛋白质损耗率的计算
按照下式计算蛋白质损耗率[10]。
蛋白质损耗率=m/M×100%
式中:m为大豆肽脱色液中减少的蛋白质的质量,g;M为未脱色的大豆肽溶液中蛋白质的质量,g。
2 结果与分析
2.1 单因素试验
2.1.1 pH对脱色效果的影响
5份100 mL大豆肽溶液,分别加入15 g/L硅藻土,将pH分别调为4.0、5.0、6.0、7.0和8.0,在50℃恒温水浴30 min,取出后过滤得脱色液,计算脱色率与蛋白质损耗率,结果见图1。

图1 pH对大豆肽脱色率及蛋白质损耗率的影响
从图1可以看出,随着pH的增加,脱色率逐渐减小,说明在此范围内pH越高脱色效果越差。硅藻土属于极性吸附,酸性条件下,硅藻土表面电荷由负电荷转变为正电荷,此时对带有负电荷的颜色物质和杂质有强吸附性,且随着pH的降低,表面电位增大,吸附量也随之变大。并且,本试验采用的硅藻土具有饱和度随pH减小而增大的特性,即饱和度越大,吸附量也越大[11]。
当溶液pH为4.0~6.0时,蛋白质损耗率显著增加。这主要取决于大豆肽溶液中氨基酸的种类和含量。不同氨基酸等电点不同,根据20种氨基酸的等电点特征分析,发现大多数氨基酸的等电点在pH 5~7之间,只有天冬氨酸和谷氨酸等电点低于4,赖氨酸、组氨酸和精氨酸等电点高于7。当溶液的pH低于某些氨基酸的等电点时,这些氨基酸带正电荷,会更容易被带负电荷的硅藻土吸附;而当酸度达到一定程度,硅藻土带正电荷且大多数氨基酸也带正电荷,它们会互相排斥,蛋白质的损耗率降低;当酸度过高时,蛋白质发生变性。因此,选择pH 4.0~6.0作为正交试验的因素水平。
2.1.2 硅藻土添加量对脱色效果的影响
5份100 mL大豆肽溶液,分别按5、10、15、20、25 g/L加入硅藻土,调节pH至6.0,置于50℃恒温水浴30 min,取出后过滤得脱色液,计算脱色率与蛋白质损耗率,结果见图2。

图2 硅藻土添加量对大豆肽脱色率及蛋白质损耗率的影响
从图2可以看出:当硅藻土添加量为5~15 g/L时,脱色率随硅藻土添加量的增加而提高;当硅藻土添加量高于15 g/L,脱色率开始减小。这是因为在一定程度上提高溶液中硅藻土的浓度,硅藻土吸附色素的活性点增加,相对脱色能力增强[12]。但是,当硅藻土的吸附量高于颜色物质总量时,硅藻土本身产生的微量颜色物质会提高吸光度,使脱色率下降。当硅藻土添加量超过15 g/L,蛋白质损耗率显著提高。综合考虑,选择硅藻土添加量10~20 g/L作为正交试验的因素水平。
2.1.3 温度对脱色效果的影响
5份100 mL大豆肽溶液,各加入15 g/L硅藻土,调节pH至6.0,分别在30、40、50、60、70℃下恒温水浴30 min,取出后过滤得脱色液,计算脱色率与蛋白质损耗率,结果见图3。

图3 温度对大豆肽脱色率及蛋白质损耗率的影响
从图3可以看出:温度在30~50℃之间时,温度越高脱色率越大;当高于50℃时,脱色效果随温度升高逐渐降低。这主要是因为温度升高,分子的运动加快,硅藻土与颜色物质的分子活性随之提升,脱色剂的吸附能力增大;当温度过高时,颜色物质的分子活性大于硅藻土吸附力,使有色分子从硅藻土的吸附中脱离出来,溶液颜色变深[13],并且过高的温度会使某些氨基酸发生脱氨反应,破坏大豆肽的营养价值。随温度的升高,蛋白质损耗率也在逐步增大。因此,选择温度40~60℃作为正交试验的因素水平。
2.1.4 时间对脱色效果的影响
5份100 mL大豆肽溶液,各加入15 g/L硅藻土,调节pH至6.0,在50℃下分别恒温水浴10、20、30、40、50 min,取出后过滤得脱色液,计算脱色率与蛋白质损耗率,结果见图4。

图4 时间对大豆肽脱色率及蛋白质损耗率的影响
从图4可以看出,随时间的延长脱色率逐渐提升。主要是由于硅藻土需一定时间达到饱和吸附量,延长时间,可以让硅藻土充分吸附颜色物质;但当吸附量达到饱和后,如继续延长时间易造成色素解吸,色度回升[12]。另外,时间延长也会造成蛋白质损耗率的增加。因此,选择时间30~50 min作为正交试验的因素水平。
2.2 正交试验
在单因素试验的基础上,选择硅藻土添加量、温度、时间和pH为因素,以脱色率为指标,进行正交试验。正交试验因素水平见表1,正交试验设计及结果见表2。
由表2可知,影响硅藻土对大豆肽脱色效果的因素主次顺序为pH>时间>温度>硅藻土添加量,最佳因素水平组合为A2B2C2D3,即pH 5.0、硅藻土添加量15 g/L、温度50℃、时间50 min。

表1 正交试验因素水平
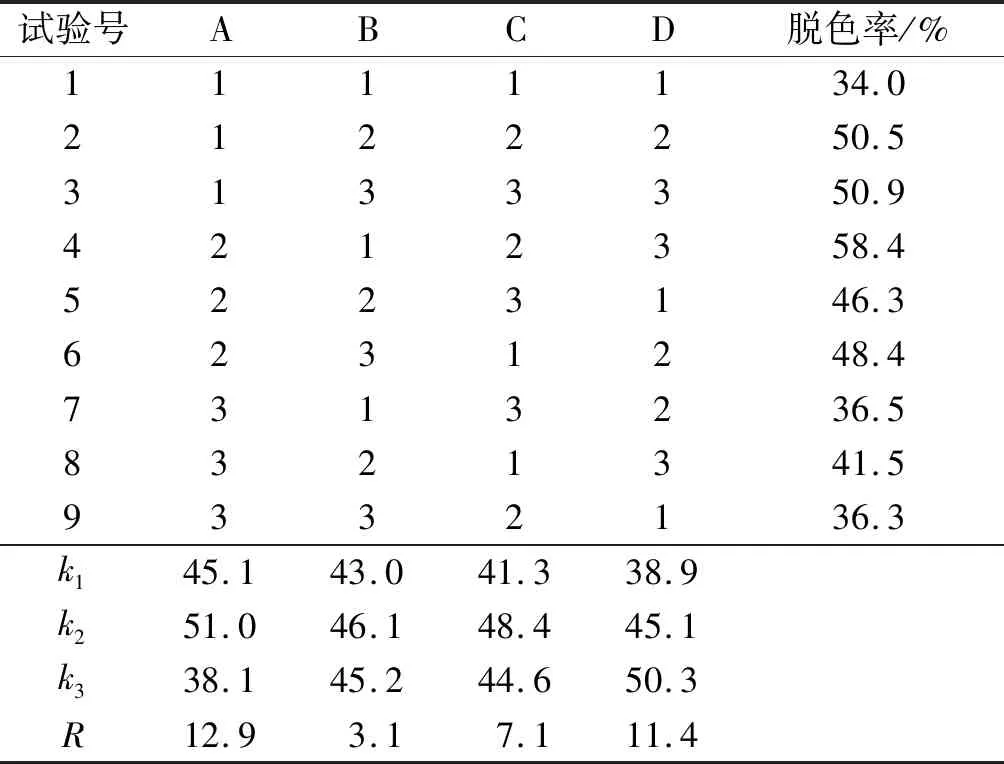
表2 正交试验设计及结果
2.3 验证试验
在最佳脱色条件下进行验证试验,大豆肽脱色率达到60.5%,蛋白质损耗率为4.2%。脱色大豆肽的蛋白质含量达到87.8%,颜色为乳白色。
3 结 论
大豆肽的硅藻土脱色最佳工艺条件为:硅藻土添加量15 g/L,温度50℃,时间50 min,pH 5.0。在最佳工艺条件下,脱色率达到60.5%,蛋白质损耗率仅为4.2%。脱色后大豆肽的蛋白质含量达到87.8%,颜色由灰黄色变为乳白色。该工艺可以满足对大豆肽脱色效果的要求,保证脱色后大豆肽的营养价值。
