响应面优化酶解法制备岩豆抗氧化肽工艺
2020-06-19屠瀚超阳晓晶罗松明
屠瀚超,阳晓晶,罗松明
(1.四川农业大学 食品学院,四川 雅安 625014; 2.千禾味业食品股份有限公司,四川 眉山 620010)
岩豆(MillettiadielsianaHarms ex Diels)是香花崖豆藤(MillettiadielsianaHarms)的种子。香花崖豆藤是豆科崖豆藤属的植物,为攀缘藤本或木本植物,多以藤茎入药,其中药名为昆明鸡血藤。香花崖豆藤主要分布于我国四川、贵州、云南等地,在四川万源、长宁等地有大规模种植[1]。岩豆中的蛋白质含量丰富,且不含胆固醇,可以提高食品营养价值,预防心血管疾病[2]。
目前国内外对岩豆方面的成分开发利用研究较少,主要集中在香花崖豆藤的化学成分[3-5]、岩豆凝集素[6-7]等方面,对岩豆抗氧化肽的研究几乎没有。利用蛋白酶酶解蛋白质制得活性肽具有反应条件温和、省时高效的优点[8],还可以很好地保留小肽的营养价值,甚至可以去除部分致敏原[9],同时制得的多肽具有较好的抗氧化活性,是当前大规模制备抗氧化活性肽的主要手段。目前利用响应面优化并结合酶解法制备岩豆抗氧化肽工艺的研究鲜见报道。本研究在单因素试验的基础上,通过响应面法优化岩豆盐溶蛋白酶解制备抗氧化肽的工艺条件,为研究岩豆抗氧化肽的活性、分离纯化及生产提供一定的依据,以提高岩豆的综合利用水平及产业附加值。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
岩豆,采购于四川省达州市万源县。
胃蛋白酶(酶活力3 000 U/g)、1,1-二苯基-2-三硝基苯肼(DPPH),索莱宝生物公司;木瓜蛋白酶(酶活力300 000 U/g)、中性蛋白酶(酶活力50 000 U/g)、菠萝蛋白酶(酶活力800 000 U/g),上海瑞永科技有限公司;其他试剂均为分析纯。
1.1.2 仪器与设备
Milli-Q Reference 超纯水装置,美国 Millipore 公司;UV-2802紫外可见分光光度计;PHS-3C pH 计;D-37520高速冷冻离心机,美国Thermo Fisher 公司。
1.2 试验方法
1.2.1 岩豆盐溶蛋白提取工艺
岩豆→去皮→粉碎→石油醚脱脂10 h→加入0.1 mol/L的NaCl溶液(料液比1∶50)→磁力搅拌30 min(恒温38℃)→离心(8 000 r/min, 15 min)→取上清液→调节pH至4.3→离心(8 000 r/min,15 min)→取沉淀冷冻干燥→岩豆盐溶蛋白。
1.2.2 岩豆水溶蛋白的提取工艺
岩豆→去皮→粉碎→石油醚脱脂10 h→加入超纯水(料液比1∶50)→磁力搅拌40 min(恒温50℃)→离心(8 000 r/min, 15 min)→取上清液→调节pH至4.5→离心(8 000 r/min,15 min)→取沉淀冷冻干燥→岩豆水溶蛋白。
1.2.3 岩豆盐溶蛋白的酶解
酶液的配制:酶试剂→加入相应pH的缓冲液(浓度为20 U/mL)→预热15 min→酶液。
酶解:岩豆盐溶蛋白 → 加超纯水溶解 → 加入酶液进行酶解 →每隔30 min 振荡摇匀1次→一定时间后沸水浴处理10 min灭酶→7 000 r/min离心10 min→上清液→酶解液。
同时设置1组空白对照组(不加酶)。
1.2.4 蛋白酶的筛选
以胃蛋白酶、中性蛋白酶、木瓜蛋白酶和菠萝蛋白酶为筛选对象,选择底物质量浓度0.8 mg/mL、酶添加量1 500 U/g,酶解温度和pH 在各自最适条件(表1)下进行酶解反应,并分别在5、15、30、60、120、180、240、300、360 min 时取样测定DPPH自由基清除率,以DPPH自由基清除率为指标,筛选出酶解最优酶。

表1 蛋白酶酶解条件
1.2.5 DPPH自由基清除率的测定
参照Xie等[10]的方法略有改进。将DPPH溶于95%乙醇中配制成浓度为0.2 mmol/L的DPPH溶液。取2 mL酶解液和2 mL的DPPH溶液进行混合,摇匀后放置室温下30 min,在517 nm处测定吸光值(A样品),空白组以等体积95%乙醇溶液替换DPPH,在517 nm处测定其吸光值(A空白),对照组以等体积相应pH的缓冲液代替样品溶液,在517 nm测定吸光值(A对照),按下式计算DPPH自由基清除率。
1.2.6 多肽得率的测定
多肽得率=N1/N2×100%
式中:N1为多肽含量;N2为底物总蛋白含量。
2 结果与分析
2.1 酶解底物的选择
分别采用1.2.1、1.2.2制备岩豆盐溶蛋白与水溶蛋白,对其DPPH自由基清除能力及蛋白提取率进行比较,结果见图1。
由图1可知,岩豆水溶蛋白的提取率(21.32%)高于盐溶蛋白(11.79%),但是用超纯水配制成相同浓度的蛋白液后(未添加酶液),盐溶蛋白的DPPH 自由基清除率(24.01%)高于水溶蛋白(18.22%),且差异显著。故选取岩豆盐溶蛋白为后续试验原料。

注: 不同大小写字母表示差异显著(P<0.05)。下同。
图1 岩豆水溶蛋白与盐溶蛋白DPPH自由基清除能力及蛋白提取率的比较
2.2 蛋白酶的筛选
按照1.2.4的方法采用4种蛋白酶进行岩豆盐溶蛋白的酶解,随着酶解时间的延长,4种蛋白酶处理后所得酶解液的DPPH自由基清除能力比较如图2所示。
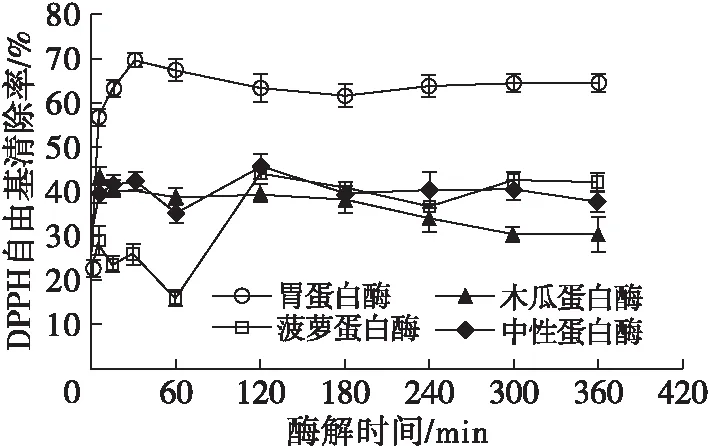
图2 4种蛋白酶处理后酶解液的DPPH自由基清除能力比较
由图2可知,岩豆盐溶蛋白在经过4种蛋白酶处理后,DPPH自由基清除率大体上均呈现出先上升后下降最后趋于稳定的趋势,说明延长酶解时间对酶解产物提高DPPH自由基清除能力效果不显著。利用胃蛋白酶酶解岩豆盐溶蛋白得到的酶解液对DPPH自由基具有较高清除能力,在30 min时达到69.84%。经菠萝蛋白酶和中性蛋白酶处理120 min后,酶解液的DPPH自由基清除率分别达到44.23%和45.70%。胃蛋白酶9个时间点的DPPH自由基清除率均显著高于其他3种酶处理。可能是因为胃蛋白酶在对岩豆盐溶蛋白进行剪切时,能够识别具有一定特异性的氨基酸序列[12],酶解后得到具有较强抗氧化能力的小肽。同时,酶解液的DPPH自由基清除率均高于未加酶的空白组(24.01%),说明酶解法确实有利于抗氧化肽的制备。因此,选择胃蛋白酶为酶解优化的酶制剂。
(4)尽量采用自繁自养的养殖模式,严禁从疫区引进种猪、副产品以及设备设施。如果不确定为疫区或非疫区,要对设备设施进行彻底消毒,对引进的种猪进行严格的检疫,确认无病后才可以混群饲养[5]。
2.3 单因素试验
2.3.1 酶解时间对酶解效果的影响
固定酶解pH 2.0、酶添加量1 500 U/g(以底物质量计,下同)、底物质量浓度0.8 mg/mL、酶解温度35℃条件下,考察酶解时间对酶解效果的影响,结果见图3。

图3 酶解时间对酶解效果的影响
由图3可知,随着酶解时间的延长,DPPH自由基清除率逐渐增大,在30 min达到最高值(59.41%),继续延长酶解时间,DPPH自由基清除率出现下降趋势。可能是随着酶解时间的延长,原本具有较高活性的肽被酶解成活性较低的小肽或氨基酸[13],使得抗氧化肽活性下降,之后溶液中多肽和氨基酸的浓度达到饱和,酶解反应停止,抗氧化活性逐渐趋于稳定。因此,选取30 min为最适酶解时间。
2.3.2 酶解温度对酶解效果的影响
固定酶解pH 2.0、酶添加量1 500 U/g、底物质量浓度0.8 mg/mL、酶解时间30 min条件下,考察酶解温度对酶解效果的影响,结果见图4。

图4 酶解温度对酶解效果的影响
由图4可知,当酶解温度由25℃升高至35℃时,岩豆盐溶蛋白酶解液的DPPH自由基清除率显著增加,继续升高酶解温度,DPPH自由基清除率显著下降。可能是由于温度的升高,使得胃蛋白酶的结构发生了一定的改变,从而影响了酶解效果,也可能是由于温度的升高改变了岩豆抗氧化肽的结构,使其活性下降。当酶解温度为35℃时,DPPH 自由基清除率达到最大值(62.67%)。因此,选择35℃为最适酶解温度。
2.3.3 酶添加量对酶解效果的影响
固定酶解pH 2.0、酶解温度35℃、底物质量浓度0.8 mg/mL、酶解时间30 min条件下,考察酶添加量对酶解效果的影响,结果见图5。
由图5可知,随酶添加量的增大,DPPH自由基清除率呈上升趋势,在酶添加量达到1 500 U/g时,DPPH自由基清除率达到最大值(64.91%)。当酶添加量超过1 500 U/g后,DPPH 自由基清除率下降,随后趋于稳定,可能是因为胃蛋白酶的有效成分与底物蛋白的特异性结合位点达到饱和[14],酶解效率变化不显著,同时由于过多的胃蛋白酶参与酶解,使得抗氧化活性较强的肽段被酶解为活性较弱的小肽,造成了DPPH自由基清除率的下降。因此,选取1 500 U/g为最适酶添加量。

图5 酶添加量对酶解效果的影响
2.3.4 底物质量浓度对酶解效果的影响
固定酶解pH 2.0、酶添加量1 500 U/g、酶解温度35℃、酶解时间30 min条件下,考察底物质量浓度对酶解效果的影响,结果见图6。
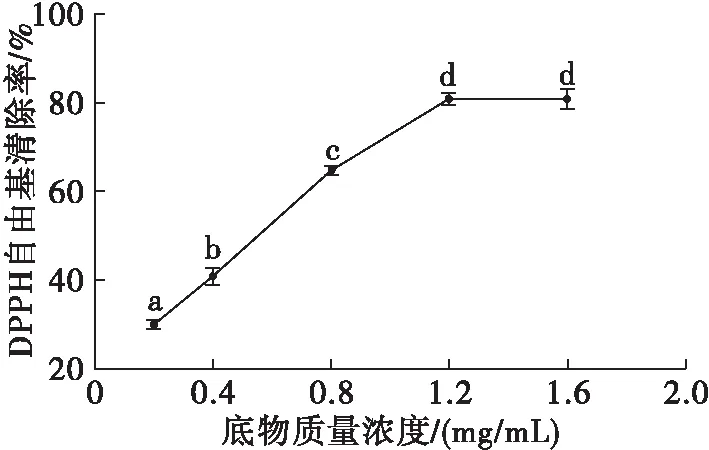
图6 底物质量浓度对酶解效果的影响
由图6可知,DPPH自由基清除率随底物质量浓度的增大而增大,在底物质量浓度为1.2 mg/mL时取得最大值(81.24%),但是在后续试验中发现在底物质量浓度大于0.8 mg/mL时改变酶添加量,对DPPH自由基清除率的影响不显著,无法确定最适酶添加量。并且在底物质量浓度大于1.2 mg/mL时,DPPH溶液与酶解液混合后溶液变得浑浊,影响吸光值的测定。可能是由于酶解底物浓度过高,造成酶解液中含有的有效抗氧化活性成分达到饱和析出[15],从而使DPPH自由基清除率虽然有提升但是对酶添加量的变化不敏感。因此,选择0.8 mg/mL为最适底物质量浓度。
2.4 响应面试验
2.4.1 响应面试验设计及结果
在单因素试验结果的基础上,固定底物质量浓度0.8 mg/mL、酶解pH 2.0,采用Design Expert 8.0.6软件,根据Box-Behnken中心组合设计原理,以酶解温度(A)、酶添加量(B)、酶解时间(C)为考察因素,以DPPH自由基清除率(Y)为响应值,设计三因素三水平的响应面试验,进行二次多元回归方程拟合及其优化分析。响应面试验因素水平见表2,响应面试验设计及结果见表3。

表2 响应面试验因素水平

表3 响应面试验设计及结果
利用Design Expert 8.0.6软件对表3数据进行多元回归拟合,响应值与各因素之间的二次多元回归方程式如下:
Y=69.63-2.10A+5.27B+0.055C-0.93AB+1.20AC+2.21BC-11.30A2-13.79B2-11.43C2
对该模型进行方差分析,结果如表4所示。
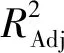

表4 回归方程方差分析
注:**表示差异极显著(P<0.01); *表示差异显著(P<0.05)。
2.4.2 模型验证试验
通过Design Expert软件,以最大DPPH自由基清除率为指标分析响应面试验结果,获得酶解岩豆盐溶蛋白制备抗氧化肽的最优酶解条件为酶解温度34.07℃、酶添加量1 098.14 U/g、酶解时间35.43 min,此时DPPH自由基清除率为70.25%。为方便验证同时结合实际情况,将参数修正为酶解温度34℃、酶添加量1 100 U/g、酶解时间36 min。在最优条件下做3次平行试验,测得此条件下DPPH自由基清除率为70.41%,接近于理论值,表明该模型可较好地预测各因素与响应值之间的影响关系,并测得该条件下多肽得率为53.63%。
3 结 论
以岩豆盐溶蛋白为原料,DPPH自由基清除率为评价指标,利用单因素试验和响应面优化胃蛋白酶酶解岩豆盐溶蛋白制备抗氧化肽的工艺,得到最优酶解条件为酶解温度34℃、酶添加量1 100 U/g、酶解时间36 min、酶解pH 2.0、底物质量浓度0.8 mg/mL,此条件下DPPH自由基清除率为70.41%、多肽得率为53.63%。本研究表明岩豆盐溶蛋白酶解液具有一定的抗氧化活性,可以利用岩豆盐溶蛋白制备抗氧化肽。本研究为增加岩豆的附加值提供一种思路,并为分离纯化岩豆抗氧化肽,研究其抗氧化机理奠定了基础。
