针灸对CTX化疗小鼠骨髓造血微环境中骨髓基质细胞细胞周期的影响*
2020-06-19刘海伟
刘海伟,路 玫
(1.甘肃省中医院,甘肃 兰州 730000; 2.河南中医药大学,河南 郑州 450008)
烷化剂环磷酰胺(Cyclophosphamide,CTX)是临床上广泛应用的抗肿瘤化疗药物和免疫抑制药物,使用后的反复毒性作用可造成骨髓造血微环境的损害[1],并呈现不可逆的改变。骨髓造血微环境是造血干细胞赖以增殖、分化、成熟的“土壤”。造血微环境主要由基质细胞(stromal cells)、细胞外基质(Extracellular matrix,ECM)和造血生长因子(hematopoietic growth factor)组成。其中骨髓基质细胞(Bone marrow stromal cell,BMSC)是造血微环境的重要组成成分。通过产生并分泌细胞黏附分子及造血因子,调节造血干细胞的归巢、定位、增殖、分化、成熟、迁移、凋亡[2]。化疗后造血微环境的损伤主要表现在骨髓基质细胞多种粘附分子表达降低和粘附能力下降,严重影响着造血细胞的分裂增殖。本课题组前期研究证实,针灸可以促进化疗后骨髓细胞的抗损伤和修复功能,加速骨髓细胞从G1期向S期的转化,增强细胞DNA的合成,保护骨髓细胞,使CTX的骨髓抑制状态得到改善[3]。本实验研究利用CTX建立小鼠骨髓抑制模型,通过观察针灸对CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)细胞周期变化的影响,探讨针灸对抗化疗毒副反应、改善骨髓造血微环境中BMSC细胞周期变化、促进造血功能重建的分子生物学机制。
1 材料与方法
1.1 实验动物与分组
选用SPF级雄性昆明种小鼠40只,由河南省实验动物中心提供,动物合格证号:scxk(豫)2014-0001,体质量(22±2)g。实验动物购回后,在相对湿度60%、温度20~25℃的清洁级实验室中,自由喂养3 d,小鼠称重后,依据体质量按照随机分层分组的方法,分笼饲养,每笼5只。分别为空白组、模型组、针刺组、艾灸组,每组10只。用苦味酸溶液对各组小鼠进行染色编号。
1.2 主要试剂
环磷酰胺(0.12 g/瓶,山西普德药业有限公司,批号:20070303);4%多聚甲醛固定液(上海歌凡生物有限公司,批号:20140204);10%EDTA脱钙液(青岛捷世康生物科技有限公司,批号:20140713);凯基细胞DNA含量检测试剂盒(细胞周期,南京生物科技有限公司,产品编号:KGA511-KGA512);HRP辣根过氧化物酶,中性树胶封片剂;PBS缓冲液;70%乙醇。
1.3 仪器及材料
低速离心机(江苏太仓医疗器械厂);COULTER EPICS-XL型流式细胞仪(美国Coulter公司);CO2细胞培养箱(美国SHELLAB公司);-80℃低温冰箱(河南新乡新飞公司);生物显微镜(日本OLYMPUS公司);薄片离心机SHANDON(北京医用离心机厂);隔水式电热恒温培养箱(江苏医疗器械厂);pH仪(PHS-25型,上海医疗器械厂);8112型磁力恒温搅拌器(上海县曹行无线电厂);电热干燥箱;孵育盒;MicromHM 340E石蜡切片机;37℃恒温水箱;200目筛网;细胞计数板等。
1.4 造模方法
依据《新药(西药)临床研究指导原则汇编》[4]的模型制作方法,模型组、针刺组、艾灸组分别采用环磷酰胺(CTX)建立骨髓抑制小鼠模型。腹腔注射CTX100 mg/kg/d(按照小鼠体质量0.02 mL/g用药量,注射浓度为5 mg/mL的CTX溶液),后分别在24 h、48 h再行CTX注射,即连续3 d。停药后4 h模型制作成功(依据环磷酰胺药代动力学过程,4 h后药物活性消失[5])。空白组给予注射同等剂量的生理盐水,连续3 d。
1.5 固定小鼠
右手食指、拇指捏住小鼠尾巴,将小鼠置于鼠笼盖上,小鼠向前爬时,用左手大拇指和食指内侧面捏住小鼠头颈部皮肤以固定小鼠,用无名指和小指配合大鱼际共同固定小鼠尾骶部及尾巴,然后用力量大小适宜的塑料夹子(布条缠绕其夹口,以防止对小鼠四肢造成损伤),夹住小鼠四肢后,将小鼠俯卧位固定于预先备好的鼠板上。
1.6 干预方法
选取“大椎”“膈俞”“肾俞”“足三里”。小鼠穴位定位依据《中国兽医针灸学》[6],并模拟大鼠定位方法,具体定位为“大椎”位于背中线上,第7颈椎与第1胸椎棘突间;“膈俞”位于第7胸椎棘突下,左右各1穴;“肾俞”在第2腰椎棘突下,左右各1穴;“足三里”位于小鼠后肢膝关节下外侧,腓骨小头下3.5 mm处取穴,左右各1穴。
1.6.1 针刺组 采用华佗牌美容毫针(规格:0.19 mm×10.00 mm,由苏州医疗器械用品有限公司制作),采用快速进针法直刺,进针深度为3 mm,行捻转补法1次,留针6 min。每天1次,连续5 d。
1.6.2 艾灸组 用特制美容细艾条(规格:0.4 cm×25 cm,由河南南阳卧龙艾绒厂制作)点燃后,在距离穴位皮肤5 mm处每穴固定悬灸3 min。每天1次,连续5 d。
1.6.3 空白组、模型组 每天陪同针刺组、艾灸组抓取、固定,不做任何治疗。
1.7 观察指标及方法
依次从治疗后第1天、第3天、第5天,观察各组小鼠骨髓造血微环境中BMSC细胞周期百分率的变化。
1.7.1 小鼠骨髓石蜡包埋块制作 将预先用4%多聚甲醛固定好的左侧小鼠股骨,采用10%EDTA脱钙液脱钙1周,脱钙成功后,依次采用全自动脱水机按如下步骤和时间进行脱水:70%乙醇2 h;80%乙醇2 h;90%乙醇2 h;95%乙醇Ⅰ2 h;95%乙醇Ⅱ 2 h;无水乙醇Ⅰ 1 h;无水乙醇Ⅱ 1 h。然后分别二甲苯Ⅰ 30 min;二甲苯Ⅱ 30 min进行透明。经过透明处理后,应用石蜡Ⅰ(50~52℃)60 min;石蜡Ⅱ(60~62℃)60 min浸蜡处理。经过浸蜡后应用全自动包埋仪进行蜡块包埋。包埋好的蜡块置于-20℃冰箱中保存备用。
1.7.2 石蜡包埋组织单细胞悬液制备 具体制备步骤为:切片机上切取整块石蜡包埋组织块,将其切为3~5片,厚度为40~50 μm,而后全部置于试管中;在室温下加入二甲苯5 mL脱蜡,依据脱蜡程度,可置换1次二甲苯,待石蜡脱净后,弃除二甲苯;依次分别加入100%、95%、70%、50%梯度乙醇5 mL进行水化,每步10 min,后弃乙醇,加入蒸馏水5 mL,5 min后弃去;后加入0.5%胃蛋白酶消化液5 mL,置于37℃恒温水箱中消化30 min,期间每隔10 min震荡1次;消化30 min,加入生理盐水终止消化;采用300目尼龙网过滤,消化未彻底的可进行2次消化;收集细胞悬液,依据1 500 r/min离心沉淀,后经生理盐水漂洗2次,500~800 r/min离心沉淀,去除参与碎片,制备好的细胞悬液,应用细胞计数板技术,制作成1×106/mL的骨髓基质细胞(BMSC)单细胞悬液,置于4℃冰箱保存待测。
1.8 流式细胞仪检测
应用凯基细胞周期DNA含量检测试剂盒(南京凯基生物科技发展有限公司提供,产品批号:KGA511-KGA512),具体操作步骤为:将用PBS洗涤过的骨髓基质细胞(BMSC),采用2 000 r/min转速,离心5 min制备单细胞悬液,其细胞浓度为1×106/mL,取1 mL单细胞悬液;将制备的单细胞悬液离心后,去除上清,在细胞中加入体积分数为70%冷乙醇500 μL固定2 h,4℃保存,后用PBS洗去固定液;加入100 μL RNaseA37℃水浴30 min;再加入400 μL PI染液染色混匀,4℃避光30 min;上机检测,每份标本重复检测3次,记录激发波长488 nm处红色荧光。用DNA MultiCycle软件进行统计学分析。
1.9 统计学方法
2 结果
2.1 各组CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)G1期细胞百分率比较

表1 各组CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)G1期细胞百分率比较
注:与空白组比较,1)P<0.05,4)P<0.01;与模型组比较,2)P<0.05,5)P<0.01;与针刺组比较,3)P<0.05。
如表1所示,模型组、针刺组、艾灸组CTX化疗小鼠骨髓造血微环境中BMSC的G1期细胞百分率变化趋势大致相同。与空白组比较,模型组中的3 d组与5 d组BMSC的G1期细胞百分率明显下降,差异具有统计学意义(P<0.05,或P<0.01),见图1;针刺组中1 d组BMSC的G1期细胞百分率明显升高,差异具有统计学意义(P<0.05)。与模型组比较,针刺组中的3 d组与5 d组BMSC的G1期细胞百分率明显下降,差异具有统计学意义(P<0.01或P<0.05);与针刺组比较,艾灸组中的5 d组BMSC的G1期细胞百分率明显升高,差异具有统计学意义(P<0.05)。

图1 空白组骨髓基质细胞(BMSC)分析图
2.2 各组CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)S期细胞百分率比较
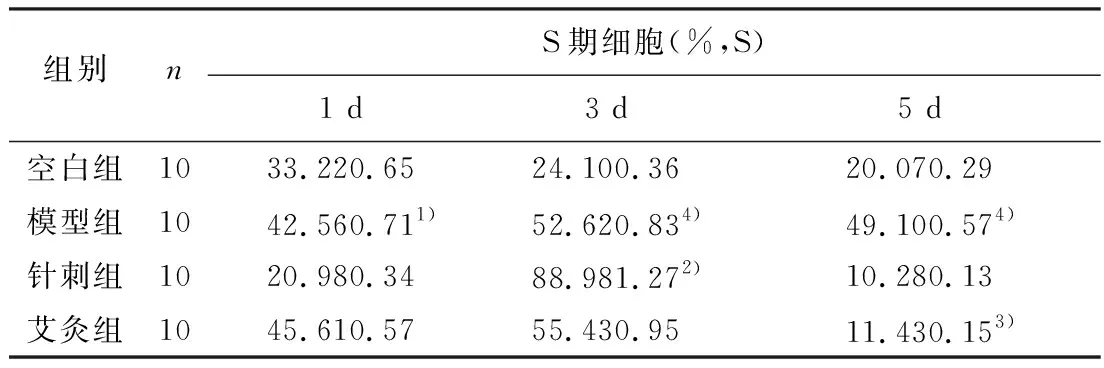
表2 各组CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)S期细胞百分率比较
注:与空白组比较,1)P<0.05,4)P<0.01;与模型组比较,2)P<0.05;与针刺组比较,3)P<0.05。
如表2所示,与空白组比较,模型组中的1 d组与3 d组、5 d组BMSC的S期细胞百分率明显升高,差异具有统计学意义(P<0.05或P<0.01);与模型组比较,针刺组3 d组BMSC的S期细胞百分率明显升高,差异具有统计学意义(P<0.05),见图2;与针刺组比较,艾灸组5 d组BMSC的S期细胞百分率明显升高,差异具有统计学意义(P<0.05)。
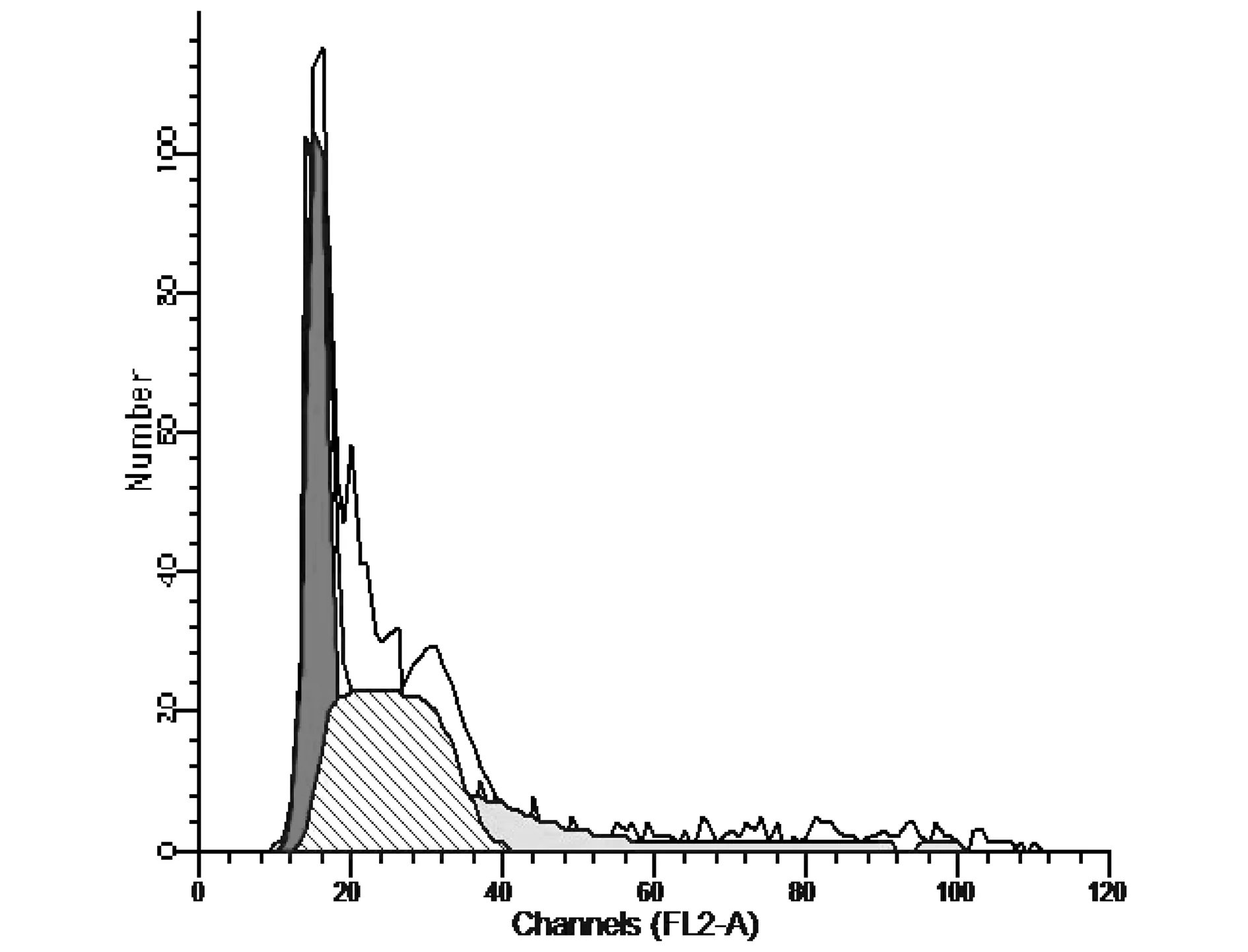
图2 模型组骨髓基质细胞(BMSC)分析图
2.3 各组CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)G2期细胞百分率比较

表3 各组CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)G2期细胞百分率比较
注:与空白组比较,1)P<0.05,4)P<0.01;与模型组比较,2)P<0.05,5)P<0.01;与针刺组比较,3)P<0.05。
如表3所示,与空白组比较,模型组中的1 d组、3 d组与5 d组BMSC的G2期细胞百分率明显降低,差异具有统计学意义(P<0.05或P<0.01);与模型组比较,针刺组3 d组BMSC的G2期细胞百分率明显升高,差异具有统计学意义(P<0.05);与针刺组比较,艾灸组3 d组BMSC的G2期细胞百分率明显升高,差异具有统计学意义(P<0.05),见图3~4。
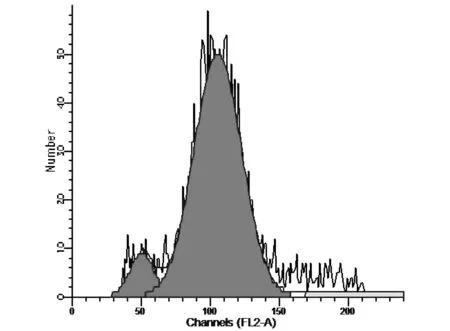
图3 针刺组骨髓基质细胞(BMSC)分析图

图4 艾灸组骨髓基质细胞(BMSC)分析图
3 讨论
骨髓造血微环境又称龛,可调节、定位造血干细胞[7],是造血干细胞(HSCs)的特化结构,其可驻留并调控HSCs,使之归巢,造血微环境主要由骨髓基质细胞(BMSC)及非细胞成分组成,骨髓基质细胞(BMSC)为其核心组成部分[8]。化疗后可以引起骨髓造血微环境的严重破坏,同时也可以导致骨髓基质细胞受损[9],出现骨髓造血功能障碍。骨髓基质细胞(BMSC)周期变化是反应骨髓造血微环境造血功能的主要指标之一。细胞周期分为分裂间期和分裂期(M期),分裂间期分为G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)[10]。有研究证实,骨髓细胞无法进行正常有丝分裂,从而产生骨髓抑制[10]。
传统中医学并无“骨髓抑制”病名,依据该病的病因病机及临床症状,可归属于中医内科学中“虚劳”范畴,病因多由机体正气不足、复感外来化疗之毒邪,导致气血生化之源匮乏、肝肾精血不足,导致“毒邪”与气血相互搏击,使气血脏腑功能失调,发为本病。病机主要责之于气血双亏、肾精不足。依据“劳则温之”“虚则补之”的治则,采用针刺和艾灸大椎、膈俞、肾俞、足三里,以达益气健脾、调补气血和培补后天之功。
本研究结果显示,针灸可以减少CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)G1期细胞百分率,从而加速BMSC向S期的转化。在针刺和艾灸治疗3 d后,CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)S期细胞百分率均明显升高,且高于空白组和模型组的水平,说明针刺和艾灸可以使CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)S期细胞百分率升高,S期为细胞DNA合成期,同时也佐证了采用针灸治疗3 d后,对骨髓造血微环境中BMSC的DNA有修复和保护作用。但在采用针刺和艾灸治疗5 d后,CTX化疗小鼠骨髓造血微环境中骨髓基质细胞(BMSC)S期细胞百分率呈下降趋势,说明随着治疗时间的累积,针灸有减少骨髓基质细胞(BMSC)S期细胞百分率的作用,可加速骨髓基质细胞(BMSC)向G2期转化。针灸可促进骨髓基质细胞(BMSC)G2期细胞百分率升高,
G2期为BMSC的DNA合成后期,说明针灸可促进CTX化疗后BMSC损伤后的自身修复,加速BMSC的有丝分裂和增殖。同时可以使经CTX化疗受损的BMSC分裂停滞状态得到修复。
烷化剂环磷酰胺(CTX)致骨髓造血微环境损伤后,干扰了骨髓基质细胞(BMSC)的细胞周期规律,使BMSC的DNA含量减少,使BMSC的细胞分裂停滞,从而产生骨髓抑制,导致骨髓造血功能障碍。采用本课题研究组抗化疗穴组“大椎”“膈俞”“肾俞”“足三里”[11-12],可以使经环磷酰胺(CTX)化疗后骨髓造血微环境中的骨髓基质细胞(BMSC)受损的细胞周期得到恢复,可加速BMSC中G1期向S期、S期向G2期的转化,促进BMSC的受损DNA在S期大量合成、修复,并可延长BMSC中G2期,使BMSC完成分裂与增殖,提高骨髓造血微环境中BMSC的修复能力,保护骨髓造血微环境,促进骨髓造血功能的重建。
