百香果叶片植株再生快繁技术
2020-06-19杨宝明王丽花李永平黄玉玲李迅东尹可锁张艺萍杨超振
苏 艳,杨宝明,王丽花,李永平,黄玉玲,李迅东,尹可锁,张艺萍,杨超振
(1.云南省农业科学院花卉研究所,农业农村部花卉产品质量监督检验测试中心(昆明),国家观赏园艺工程技术研究中心,云南昆明650205;2.云南省农业科学院农业环境资源研究所,云南昆明650205;3.云南省农业科学院热区生态农业研究所,云南元谋651300)
百香果(Passiflora edulis Sims)又名鸡蛋果、西蕃莲、洋石榴,属西蕃莲科西蕃莲属的滕本植物,为热带亚热带多年生植物;果实富含人体所必需的17种氨基酸、多种维生素、类胡萝卜素和微量元素,营养价值极高;可溶性固形物含量5%~16%,总酸量3.8%~4.0%,甜酸适中,素有“果汁之王”的美誉。其根、茎、叶可入药,具有消炎、止痛、活血、强身等功效[1-2]。
近年来,随着百香果的综合开发[3-6]和高产栽培技术的推广应用[7-11],其种植面积逐年加大,主要集中种植于广西、广东、云南、海南、福建等地[12-16],市场对种苗的需求也越来越大。目前,种苗的繁殖方式主要有3种:用种子播种繁殖;用滕蔓扦插繁殖;用接穗嫁接繁殖。其中,种子播种繁殖,浪费果实、生长周期长、用工量大;扦插繁殖,需要大量滕蔓、易传播病害、加快品种退化;嫁接繁殖,种苗质量好,但占地面积大、成苗周期长、种苗价格高。3种繁殖方法均存在占地、耗时、周期长、生长成本高等问题,受季节、环境、天气等影响,同时还会加剧病害传播[17-18]。因此,应用植物组织培养技术,建立百香果无性快繁体系,是产业化、规范化生产百香果优质种苗最有效的途径[19-20]。
本试验以百香果种子无菌实生苗的子叶、真叶以及田间枝条茎尖嫩叶为外植体,开展百香果组培快繁技术试验,旨在为百香果组培苗适宜的生产方式提供数据参考。
1 材料和方法
1.1 试验材料
供试材料于2017年7月采自云南省昆明市石林县百香果种植园。
1.2 试验方法
1.2.1 外植体选择 于晴天选择生长健壮、长势良好、无病虫害的紫果百香果实及3~4 cm长茎尖。
1.2.2 外植体灭菌 果实灭菌。将果实放在自来水下冲洗,并用肥皂水刷洗果实表面(注意果实表面不能破损);清洗干净后,在无菌工作台内,用75%酒精反复擦拭果实表皮4~5次,备用。
茎尖的灭菌。剪除茎尖不要的老叶,用自来水反复冲洗,再用肥皂水清洗,清洗干净后,在无菌工作台内,先用75%酒精浸泡30 s,再用0.1%的氯化汞溶液浸泡10 min;然后用无菌水冲洗4~5次,再用无菌滤纸吸干表面水分,备用。
1.2.3 种子无菌实生苗的培养 将经无菌处理的果实从中部切开,挑选个大、饱满的种子直接接种到经过灭菌处理的装有珍珠岩(含水量为80%左右)的培养瓶中,经35~40 d培养,即可得到高度为4~5 cm的实生苗。
1.2.4 外植体愈伤组织诱导培养 将经无菌培养得到的实生苗按子叶、真叶部位切割;田间茎尖直接将未完全展开的嫩叶切割下来,分别接种到1~8号处理的培养基中,于第35天统计出愈率及不定芽分化情况。每处理接种5瓶,每瓶接种1块,3次重复。
1.2.5 丛生芽诱导培养 将经愈伤组织诱导培养得到的愈伤组织或芽丛,切割为0.5 cm2左右的小块,接种到9~14号处理的培养基中,于第25天统计不定芽的分化率及分化情况。每处理接种5瓶,每瓶接种1块,3次重复。
1.2.6 腋芽培养 将经丛生芽诱导培养得到的芽或芽丛,分割为含2~3个茎节的茎段或含2~3个芽的芽丛,接种到15~22号处理的培养基中,于第25天统计芽的分化率及生长情况。每处理接种3瓶,每瓶接种1块,3次重复。
1.2.7 生根壮苗培养 将经腋芽培养得到的芽,切割为含2~3节的植株,接种到23~27号处理的生根培养基中,30 d统计生根率及根系生长情况。每处理接种5瓶,每瓶接种5株,3次重复。
1.2.8 培养基及培养条件 以MS为基本培养基,附加蔗糖30 g/L、琼脂5 g/L,pH值5.8~6.0。培养室温度为(25±2)℃,光照强度为1 600~2 000 lx,光照时间为12 h/d。
1.3 数据统计
采用SPSS统计分析软件进行方差分析和多重比较。
2 结果与分析
2.1 不同处理对百香果外植体愈伤组织诱导的影响

表1 不同处理对不同叶片愈伤组织诱导分化的影响
由表1可知,无菌实生苗的子叶、真叶经诱导培养均可产生愈伤组织;最容易诱导产生愈伤组织的部位是子叶,最难诱导的部位是大田茎尖嫩叶;在1~8号处理中,子叶愈伤组织分化早、生长快,接种18 d左右开始分化愈伤组织,出愈率达100%,并在产生愈伤组织的同时还有大量不定芽分化;其次为真叶,最高出愈率为33%;大田茎尖嫩叶没有愈伤组织分化,接种10 d后叶片逐渐变黄或死亡,这可能与灭菌时间过长有关。从8个处理的培养基总体培养效果相比来看,以7号处理的培养基诱导效果最好、诱导能力最强。因此,MS+6-BA 1.5 mg/L+NAA 0.2 mg/L为最佳子叶愈伤组织诱导培养基。
2.2 不同处理对丛生芽诱导分化的影响
由表2可知,丛生芽的分化数与细胞分裂素的种类和浓度直接相关,6-BA和KT都能诱导丛生芽的产生;从9~14号6个处理的培养效果来看,6-BA的作用效果明显好于KT,6-BA更适合丛生芽的诱导和增殖,但当6-BA质量浓度超过1.0 mgL时,培养物的基部容易产生大量的愈伤组织,影响丛生芽的生长,丛生芽密集,芽丛生长缓慢,不长高,丛生芽的分化数量反而呈下降趋势,说明高浓度的6-BA会抑制芽的增殖。因此,MS+6-BA 1.0 mg/L+NAA 0.2 mg/L为诱导丛生芽的最佳培养基。

表2 不同处理芽丛的分化生长情况
2.3 不同处理对腋芽增殖的影响
将经丛生芽诱导培养得到的芽或芽丛切割为带2~3个茎节的茎段或分割为含2~3个芽的芽丛,接种到15~22号处理的培养基中,通过促进腋芽萌发、生长的方式实现植株的增殖。由表3可知,6-BA和IBA配合使用的效果要好于6-BA和NAA配合,在6-BA质量浓度相同时,加入IBA的处理,腋芽萌发早、数量多、生长快、长高明显、植株基部愈伤组织小;加入NAA的处理,腋芽萌发数量较少、腋芽生长缓慢,不长高,植株基部产生大量愈伤组织,接触培养基的叶片易发生卷曲等情况。当6-BA质量浓度为1.0 mg/L、IBA质量浓度为0.2 mg/L时,腋芽萌芽数量达2.86个,高度达4.82 cm,是15~22号8个处理中长势效果最好的处理。因此,腋芽增殖最佳培养基为MS+6-BA 1.0 mg/L+IBA 0.2 mg/L。
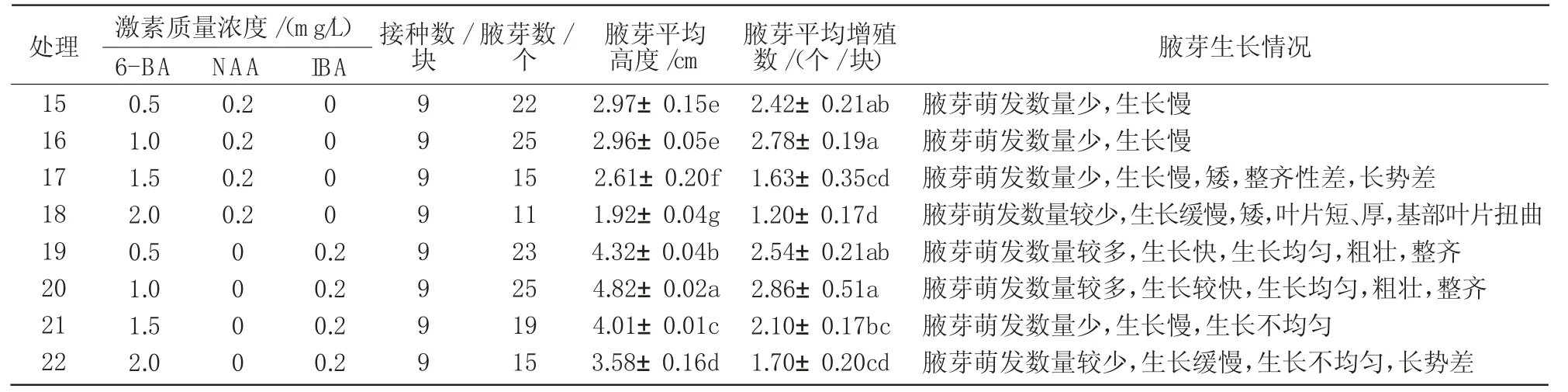
表3 不同处理腋芽的生长情况
2.4 生根壮苗培养

表4 不同处理对百香果根系生长的影响
由表4可知,在培养基中添加NAA或NAA和IBA,都能诱导植株生根,不同处理,根系及植株的生长情况各不相同,存在一定的差异;添加NAA的处理生根相对较快,接种20 d左右开始长出根系,根系粗、短、整齐,但根系脆,基部愈伤组织大;NAA和IBA配合使用的处理,生根相对要慢4~5 d,但根系更长一些、细一些,根系的柔韧性更好一些,基部愈伤组织不明显;在5个处理中,以24、27号这2个处理效果最好,生根率分别为81.3%和65.3%。因此,生根培养基以MS+NAA 0.3 mg/L为最佳。
3 结论与讨论
本试验以百香果种子无菌实生苗的子叶、真叶以及田间茎尖嫩叶为繁殖材料,研究叶片植株再生快繁技术,结果表明,百香果种子灭菌容易、彻底、污染率低;茎尖嫩枝,存在灭菌不彻底、培养中污染率高等问题,这与史沉鱼等[21-22]的研究结果一致。实生苗的子叶、真叶经诱导培养都能产生愈伤组织,而子叶是最好的无性繁殖材料,愈伤组织分化早、生长快,愈伤组织诱导率可达100%,并在产生愈伤的同时可直接分化不定芽丛,最佳子叶愈伤组织诱导培养基为MS+6-BA 1.5 mg/L+NAA 0.2 mg/L;茎尖嫩叶没有成功,接种15 d后叶片逐渐变黄或死亡,可能与灭菌的方法和时间过长有关。在丛生芽的诱导培养中,相同质量浓度的6-BA和NAA组合使用的效果明显好于KT和NAA组合,6-BA和NAA配合使用,丛生芽分化数量多,芽丛粗壮、整齐,当6-BA质量浓度为1.0~1.5 mg/L时,有利于愈伤组织丛生芽的分化和生长,最佳丛生芽分化培养基为MS+6-BA 1.0 mg/L+NAA 0.2 mg/L。在腋芽的增殖培养中,6-BA和IBA促进腋芽萌发和生长的效果好于6-BA和NAA[22-23],加入IBA的处理,腋芽萌发更早,生长更快,植株基部愈伤组织小,长势良好,但当6-BA质量浓度高于1.0 mg/L时,对腋芽的萌芽和生长有抑制作用,最佳腋芽增殖培养基为MS+6-BA 1.0 mg/L+IBA 0.2 mg/L。MS+NAA 0.3 mg/L培养基适合生根,为最佳生根壮苗培养基。
