伤寒沙门菌非编码RNA ArpH表达特征及功能初探
2020-06-18熊昌艳李雪娇黄新祥
熊昌艳,李雪娇,黄新祥
(江苏大学医学院,江苏 镇江 212013)
伤寒沙门菌(Salmonellaentericaserovar Typhi,S.Typhi)是一种重要的革兰阴性人类病原菌,可通过多种毒力因子作用,引起轻度腹泻甚至是严重的全身性感染.沙门氏菌毒力基因的集中区域被称为沙门氏菌致病岛(Salmonellapathogenicityislands,SPIs),可位于细菌染色体或质粒上.S.Typhi与宿主能产生交互作用,有些毒力基因能保护细菌免受宿主免疫系统的攻击[1-2].
病原菌在感染过程中通过调控其毒力基因的表达,可以快速适应环境的变化.许多非编码RNA(non-coding RNA,ncRNA)通过碱基配对相互作用形成与DNA或蛋白质的复合物,参与复杂的基因表达调节网络.以前,许多ncRNA被认为是不参与蛋白质编码的转录噪声,然而近年研究已经证实,大多数ncRNA可通过调节细菌中许多基因的表达来发挥生理作用,包括ABC转运系统、群体感应、氧化应激、耐酸性能和毒力等[3-4].
前期本实验室对伤寒沙门菌野生株进行了全基因组序列分析,获得了基因组结构精细图.通过转录组序列分析发现有大量ncRNA序列位于一千余个基因的反义链上,有的拼接长度甚至超过了1 000 nt.ArpH就是新发现的ncRNA之一,前期研究确定其分子全长为3 508 nt,位于基因rpoH对侧链,5′端位于yhhk起始密码子上游411 nt,3′端位于rpoH起始密码子上游238 nt,与rpoH完全重叠,为rpoH的反义RNA,因此命名为ArpH.研究发现ArpH高表达后能提高rpoHmRNA表达水平[5].RpoH是由rpoH基因编码的σ32(σH),现已知肠道细菌的σ因子之间存在相互作用,如RpoE可促进RpoH和RpoS的表达[6-7].RpoH能激活小RNA的伴侣分子基因hfq的表达,而Hfq也可调节RpoH介导的环境应答反应.在沙门菌中也发现RpoH和RpoE可促进抗氧化作用[8].高渗应激可激活大肠杆菌和鼠伤寒沙门氏菌中依赖σE和σS的基因表达.σE是一种启动一系列基因转录并对应激作出反应的细胞外因子.而σS是极端条件下细菌生存和发挥毒力所需的主要调节因子[7].另外,原核生物体内ncRNA的含量除了与其表达生成有关,与其降解也有重要关系.细菌体内存在多种RNase来降解RNA.本文通过研究σ因子和RNase对ArpH表达的影响,并结合全基因组芯片的结果,初步探讨ArpH对细菌侵袭力和胞内生存力的影响.
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 菌株:S.Typhi 野生株GIFU 10007 (WT),σE缺陷株 (ΔrpoE)[6],σS缺陷株 (ΔrpoS)[7],RNase III缺陷株(ΔRNase III)[9],RNase G缺陷株(ΔRNase G)[9],RNase E缺陷株(ΔRNase E)[9]由本实验室保存,缺陷株使用自杀质粒法制备.arpH缺陷株 (ΔarpH),WT-pBAD (WT含pBAD/Myc-hisA),WT-pBAD-arpH(WT含pBAD-arpH) 由本实验室制备[5].
质粒:pBAD/Myc-hisA (Ampr)购自Invitrogen公司,pBAD-arpH(pBAD/Myc-hisA连接了arpH序列) 由本实验室制备[5].
1.1.2 主要试剂DNA聚合酶Taq、T4 DNA连接酶(Takara公司);质粒提取试剂盒、DNA凝胶回收试剂盒(AXYGEN公司);RNA提取试剂盒 (QIAGEN公司);PrimeScript逆转录试剂盒 (Takara公司);Cy3-dCTP、Cy5-dCTP(Amersham公司);伤寒沙门菌基因组芯片由本实验室制备[10].
1.1.3 主要仪器电穿孔系统Gene Pulsero Ⅱ(Bio-Rad公司);PCR仪2720 Thermal Cycler (ABI公司);实时荧光定量PCR仪CFX96TMReal-Time System (Bio-Rad公司);基因芯片杂交仪hydridiser HB-3d(Roller-Blot公司);基因芯片扫描分析系统Genepix personal 4100A (Axon Instruments公司);CO2细胞培养箱MODEL 3111 S/N 305713-7757(Thermo公司).
1.1.4 引物利用Oligo6软件,根据arpH的核苷酸序列设计qRT-PCR特异性引物ArpH-qF和ArpH-qR.5S rRNA为内参.qRT-PCR引物见表1.

表1 本研究中所用引物序列Tab.1 The sequence of primers used in this study
1.2 方法
1.2.1 细菌培养及RNA提取 将单克隆细菌于LB液体37 ℃过夜培养,按1∶100转接于相同条件LB液体培养基,需要时加入0.2%L-阿拉伯糖诱导30 min.采用TRIzol法提取细菌总RNA后,用DNase I(RNase free)去除混杂的少量DNA,酚仿-乙醇法纯化.取适量RNA用1.2%的琼脂糖凝胶电泳检测RNA质量.
1.2.2 qRT-PCR分析 各取纯化的总RNA 4 μg,用PrimeScript逆转录试剂盒 (Takara公司)分别反转录生成cDNA后,再进行qRT-PCR.内参基因为5S rRNA,用于qRT-PCR分析的引物序列如表1所示.每次实验均按照说明书进行3次.
1.2.3 全基因组芯片检测 将WT-pBAD、WT-pBAD-ArpH培养至对数期 (A600为0.4) 后加入2 g·L-1L-阿拉伯糖诱导30 min,然后在氧应激下(H2O25 mmol·L-1)的LB中37 ℃振荡(250 r·min-1)培养4 h,总RNA用RNA提取试剂盒提取.取上述菌株的总RNA各20 μg进行逆转录,用随机引物N9、伤寒沙门菌GNP引物和PrimeScript逆转录试剂盒,反转录生成cDNAs的同时掺入Cy3-dCTP或Cy5-dCTP,将cDNAs进行相互配对并标记,经提纯后与S.Typhi基因组DNA芯片进行杂交,清洗后用双通道荧光扫描,将荧光信号进行数据转换并经标准化处理后行统计分析[11].
1.2.4 HeLa细胞侵袭实验 用含10%小牛血清的RIPM-1640于37 ℃、5% CO2的培养箱中培养HeLa细胞,实验前24 h按每孔2×105接种于24孔.将S.Typhi野生株(WT)、ArpH缺陷变异株(ΔarpH)、空质粒对照株(WT-pBAD)和ArpH高表达菌株(WT-pBAD-ArpH)培养至对数生长期,按20∶1的细菌与细胞比(multiplicity of infection,MOI)分别加入24孔板,培养90 min(37 ℃、5% CO2),以预热的PBS洗细胞3次后,加入0.1% PBS-DOC作用10 min破膜,将破膜液中的细菌收集起来涂抹于LB平板,经37 ℃温箱培养12 h后计算菌落数(t0);平行板每孔再加入终浓度为100 μg·mL-1的庆大霉素,再培养(37 ℃,5% CO2),让细菌侵袭HeLa细胞,90 min后加入1% Triton X-100作用10 min破膜,收集破膜液中的细菌,涂LB平板,37 ℃过夜培养后计数菌落数(t90).以菌落数t90/t0的比值作为细菌的侵袭力指标.
1.2.5 巨噬细胞内增殖试验 将THP-1单核细胞用含10%小牛血清的RIPM-1640培养基于24孔板培养(37 ℃,5% CO2),加100 ng·mL-1PMA(phorbol 12-myristate 13-acetate)培养24 h,诱导成巨噬细胞.将WT、ΔarpH及WT-pBAD、WT-pBAD-ArpH培养至对数生长期,WT-pBAD、WT-pBAD-ArpH加入0.2% L-阿拉伯糖诱导1 h,按细菌与细胞比20∶1,分别加入含巨噬细胞的24孔板,感染30 min后,每孔再加入庆大霉素(终浓度100 μg·mL-1)1 h以杀死胞外菌,吸取上清,用PBS将每孔吹洗3次.一部分孔加入1 mL 0.5%(V/V)Triton裂解细胞,反应10 min后将裂解物涂于LB平板,37 ℃过夜培养后的单克隆数用t0表示基础细菌吞噬水平;另一部分孔细胞继续培养12或24 h后同样以1 mL 0.5%(V/V)Triton裂解细胞,过夜培养后计算克隆数代表胞内细菌增殖水平(以t12或t24表示).细菌在巨噬细胞内生存12 h及24 h的增殖力分别以t12/t0及t24/t0表示.
1.2.6 统计学分析用平均数±标准差表示3个独立实验的平均值.利用SPSS 22.0软件进行统计分析,组间差异采用方差分析,P<0.05表示差异有统计学意义.
2 结果
2.1 RpoE和RpoS在不同应激条件下对ArpH表达的影响
应用qRT-PCR分析野生株和rpoE、rpoS缺陷株在等渗非应激条件和环境酸、氧和高渗应激下ArpH的mRNA表达水平.结果显示(图1),ArpH表达在酸应激下明显下降,在氧和高渗应激下略有增高.在rpoE缺陷株中,ArpH的表达水平在各种条件下均有明显下降.在rpoS缺陷株中,ArpH表达水平在氧应激时下降较为明显.
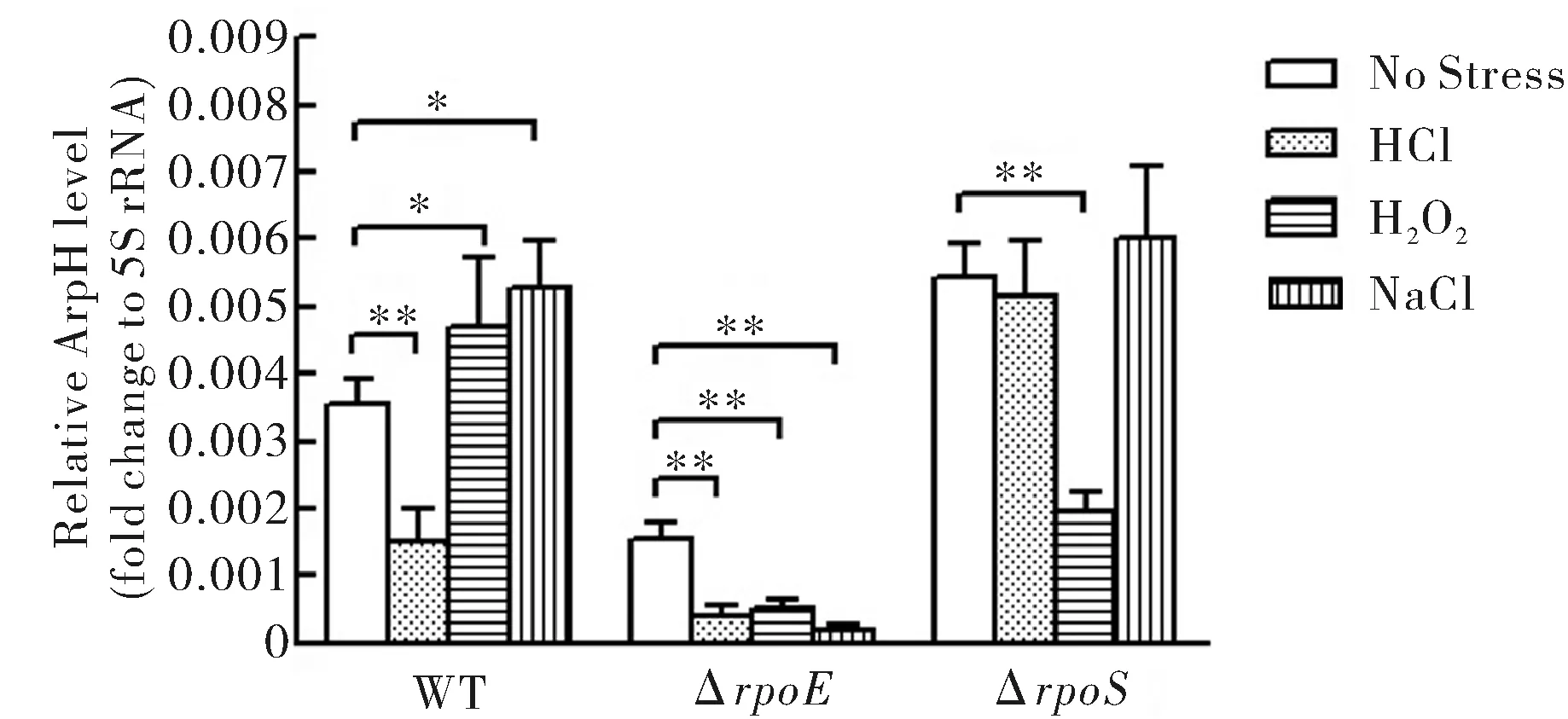
No Stress:无应激;HCl:酸应激;H2O2:氧应激;NaCl:高渗应激.*为P<0.05,**为P<0.01图1 qRT-PCR检测在WT、ΔrpoE和ΔrpoS中不同应激下ArpH的mRNA表达水平Fig.1 The mRNAexpression of ArpH in WT and mutants at different stresses
2.2 RNase III、RNase G和RNase E对ArpH降解的影响
S.Typhi野生株、RNase III、RNase G、RNase E缺陷变异株培养至A600=0.8后,经利福平处理0、5、10、20 min,RNase III缺陷株中ArpH水平明显高于野生株,而RNase G和RNase E这两种RNA酶缺陷株中ArpH水平无明显差异(图2).

图2 WT、RNase III、RNase G和RNase E缺陷株中不同时间的ArpH水平(**为P<0.01)Fig.2 The ArpH levels at different times in WT,RNase III,RNase G and RNase E deficient strains
2.3 ArpH高表达菌株氧应激下的基因表达谱分析
将空质粒对照株(WT-pBAD)和ArpH高表达菌株(WT-pBAD-arpH)培养至对数期(A600为0.4)后加入质量浓度为2 g·L-1的阿拉伯糖诱导30 min,然后在氧应激下的继续培养4 h.提取RNA后,经荧光标记、逆转录、芯片杂交等步骤后进行全基因组芯片分析.数据分析结果显示(表2),和空质粒对照株比较,ArpH高表达菌株中基因表达有显著差异的基因共113个,包括89个上调基因和24个下调基因.上调的基因主要涉及鞭毛相关基因flhDC、fliACJHLSZ和鞭毛基体修饰蛋白基因flgBCDEFHIJKL,超氧化物歧化酶sodB等.下调的基因主要涉及致病岛1效应蛋白prgHIK、sipACD,侵袭相关基因iagA、invAG、tviACDE、spaIKMN和营养代谢相关基因astB、msyB和glpD等.

表2 空质粒对照株和ArpH高表达菌株在氧应激下的部分差异表达基因Tab.2 Differential genes in control strain and ArpH overexpressing strain of S.Typhi induced by H2O2

续表2
2.4 ArpH对细菌侵袭HeLa细胞活性的影响
为了探讨ArpH对伤寒沙门菌侵袭上皮细胞的能力,应用S.Typhi野生株(WT)、ArpH缺陷变异株(ΔarpH)、空质粒对照株(WT-pBAD)和ArpH高表达菌株(WT-pBAD-arpH)对HeLa细胞进行侵袭实验(图3).当arpH基因缺失后,缺陷株的侵袭水平明显强于野生株,约为野生株的1.5倍,其差异具有统计学意义(P<0.05).与空质粒对照株相比,ArpH高表达菌株的侵袭能力下降且差异具有统计学意义(P<0.05).

图3 ArpH各菌株对HeLa上皮细胞侵袭力的影响(*为P<0.05)Fig.3 Invasion of HeLa cells by wild-type,ΔarpH,and WT-pBAD-arpH strains
2.5 ArpH对细菌在THP-1胞内生存力的影响
为了观察ArpH是否会对细菌在THP-1细胞内生存产生影响,应用WT、ΔarpH、WT-pBAD和WT-pBAD-arpH菌株进行THP-1细胞内生存实验.与时间零点的胞内细菌初始水平相比,野生株、空质粒对照株在感染12 h和24 h后的细菌水平均达到3倍以上,且此两种菌株的胞内增殖趋势没有明显差异.然而,ArpH缺陷变异株在感染12 h和24 h后,其胞内细菌水平则分别为初始水平的1.9 ± 0.3倍和1.2 ± 0.2倍,ArpH高表达菌株在感染12 h和24 h后,其胞内细菌水平则分别为初始水平的5.1 ± 0.5倍和3.7 ± 0.3倍(图4).另外,细菌在感染24 h后的胞内水平均较12 h有所下降,可能是由于细菌的感染导致部分细胞死亡并裂解,其胞内的细菌被释放到胞外被庆大霉素杀死.
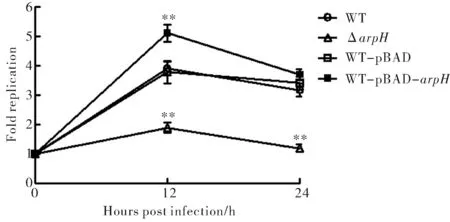
图4 伤寒沙门菌在巨噬细胞内的生存力比较(**为P<0.01)Fig.4 The intracellular survival ability comparison of S.Typhi in macrophages
3 讨论
ncRNA的功能是目前ncRNA研究领域的热点.ncRNA可以在DNA水平、mRNA水平和蛋白质水平上发挥作用[12].现已发现ncRNA具有广泛的生物学功能,包括作为信号分子、分子诱饵作用、引导功能和参与组成染色质支架等4个方面[13].某些ncRNA的生成具有组织和时间特异性,它们的表达是细胞针对特定刺激(如细胞应激和温度等)引起反应的产物[14],这些ncRNA可作为信号分子引起细胞功能的变化.在此,本文初步探讨了前期发现的ncRNA ArpH的部分表达特征和功能.
细菌属原核生物,其基因表达均是由σ因子介导转录起始[15].许多ncRNA表达受应激反应σ因子的正向调节,如RpoE和RpoS、双组分系统PhoP/Q[16].ncRNA通过作用于自己的调节子来进行反馈调控[17].肠道细菌在高渗应激或稳态期条件下,可以诱导产生σE、σH和σS.σH是大肠杆菌中首先被发现的σ因子.rpoH有4个启动子,其中一个启动子rpoH3P可被σE激活[18].本研究模拟体内酸、氧和高渗应激,检测了σ因子对ArpH表达的影响,结果显示在rpoE缺陷株中,ArpH的表达在各种应激条件下均有明显下降.ArpH作为rpoH对侧链的反义RNA[5],提示ArpH的转录可能通过RpoE激活RpoH而介导.hfq编码的蛋白是一种能与RNA结合的调节性蛋白,而σH能激活hfq的表达.反之,Hfq也可调节σH介导的胞质应答反应.同时,Hfq对于rpoS的翻译也起决定作用.在沙门菌中也发现,通过增加σS的水平,σH和σE可促进抗氧化作用[19].σS主要与稳态期和应激条件下基因的表达相关.前期研究显示ArpH在对数晚期至稳态期的表达量最高[5],表明ArpH的表达有可能受到σS的调控.本研究在rpoS缺陷株中发现ArpH的表达水平在氧应激时下降较为明显,这可能是由于σS表达的降低引起σH表达水平的下降,从而导致σH抗氧化作用的减弱,位于rpoH对侧链的反义RNA ArpH也随之下降.这些调控机制的深入研究可能为控制伤寒沙门菌感染提供有效的靶向基因.
RNase III是一种作用于双链 RNA 的核糖核酸内切酶,对 ncRNA 和靶 mRNA 配对的双链区进行切割,可以同时降解 ncRNA 和其配对的靶 mRNA.而RNase G和RNase E一样,主要降解单链,并且多水解5′末端含有单磷酸基团的 RNA 和富含 AU 碱基的区域[20-21].ncRNA能保护靶基因mRNA来对抗RNase E的降解[22].本研究分析了RNase III,RNase G和RNase E对ArpH的降解特性.结果显示这些RNA酶缺陷株经利福平处理后,RNase III缺陷株中ArpH水平明显高于野生株,而RNase G和RNase E这两种RNA酶缺陷株中ArpH水平无明显差异,以上表明RNase III可能是ArpH的主要降解酶.ArpH主要以ArpH/RpoH双链形式被降解,提示ArpH可能参与调控RpoH mRNA的稳定性来影响靶向mRNA的表达.
基因芯片技术可以对一些ncRNA的主要靶基因进行鉴定[23].前期研究发现ArpH的高表达能促进S.Typhi在氧应激条件下的生长[5].因此,本研究在氧应激下对ArpH高表达株应用全基因组芯片技术进行了基因表达谱分析,结果显示超氧化物歧化酶sodB基因表达上调明显.而sodB对S.Typhi在巨噬细胞中的生存力具有重要作用.这进一步验证了ArpH直接或间接调节氧应激环境下的某些基因表达.进一步实验观察了ArpH对S.Typhi在THP-1细胞内生存力的影响,结果发现ArpH可以提高S.Typhi在THP-1的胞内生存力,可能是影响S.Typhi细胞内生存的正向调节因子,提示ArpH可促进S.Typhi抵抗氧化损伤[24-25].另外,下调基因中包括致病岛1效应蛋白prgHIK、sipACD,侵袭相关基因如iagA、invAG、tviACDE、spaIKMN等.这提示ArpH可能是影响伤寒沙门菌侵袭的负向调节因子.为此,本研究进行了HeLa细胞侵袭实验.当arpH基因缺失后,菌株的侵袭水平高于野生株,约为野生株的1.5倍.与空质粒对照株相比,ArpH高表达株的侵袭能力下降,这表明ArpH可以减弱S.Typhi对上皮细胞的侵袭能力,可能是影响伤寒沙门菌侵袭的负向调节因子,这与芯片分析结果一致.ArpH高表达后能提高rpoHmRNA的表达水平[5].ArpH作为rpoH对侧链的反义RNA,ArpH对rpoH表达的影响可能通过顺式作用在转录后水平得以实现.σH可介导沙门菌SPI-1表达的负向调控,从而影响沙门菌对细胞的侵袭作用.有研究表明,σH分别在转录前和转录水平上负向调节HilD和HilA这两种沙门菌SPI-1特异性的转录调节子[26].因此,ArpH可能通过rpoH来间接调控鞭毛、侵袭等基因的表达,其具体机制尚待进一步研究.基因芯片还筛选到诸多涉及营养代谢等功能的基因发生了变化,ArpH对这些基因的调控机制尚待研究.
本文探讨了ArpH的转录和降解特性,进而分析了ArpH对伤寒沙门菌侵袭力的影响和对胞内生存力的作用,研究结果将增强对伤寒沙门菌在感染环境下的基因表达调节网络和致病机制的认识,也为控制细菌感染提供了新的研究策略.
