链霉素菌渣中温厌氧发酵产沼气性能研究
2020-06-18梁文华王瑞达边红杰程辉彩张丽萍
梁文华, 王瑞达, 吴 健, 刘 敬, 边红杰, 程辉彩, 张丽萍
(1.河北省科学院生物研究所, 河北 石家庄 050081; 2.河北科技大学 生物科学与工程学院, 河北 石家庄050018; 3.北方工程设计研究院有限公司, 河北 石家庄 050011)
0 引言
抗生素菌渣是抗生素生产过程中产生的未被完全利用的有机质、 培养基菌丝体及发酵残留抗生素等物质的混合体。 作为世界上最大的抗生素生产使用国,我国的抗生素年产量约为24.8 万t,占全球年产量的70%以上[1]。 在抗生素制备过程中,每产出1 t 抗生素会产生8~10 t 新鲜菌渣。 菌渣的主要危害源于本身所残留的抗生素, 如何对菌渣施行安全高效的处置, 已成为现代抗生素药业发展过程中亟待解决的问题。
欧美等发达国家主要将焚烧作为抗生素菌渣的安全处置方式,此方法在我国石药、华药等制药企业亦有相应的应用。 焚烧处理可迅速使大量菌渣减量化、无害化,但是,焚烧处置菌渣的平均成本高达1 500 元/t,且处理不当可能会带来二次污染。 曹盼通过好氧堆肥的方式对壮观链霉素菌渣进行处理,结果表明,对菌渣中的抗生素残留具有良好的去除效果[2]。 平然利用SEA-CBS 技术对去吉他霉素和螺旋霉素菌渣施行联合处理, 在有效降低菌渣抗生素残留的同时, 得到了具有可观效果的有机肥料[3]。 制作堆肥的过程会对菌渣中的抗生素耐受性微生物起到积累和富集作用,因此,在堆肥实际使用过程中仍须进行安全评估。此外,近年出现的资源化技术,如培养基替代品的制备、水煤浆活性炭的制取、固态燃料的开发等[4]~[6],皆在实际处置中受到技术瓶颈、 生产成本等因素的限制, 面对大规模抗生素菌渣处理的实际问题时效果较差。
作为一种技术成熟的菌渣处理办法, 厌氧发酵技术具有运行过程能耗低、有机负荷高、污水产生量少的特点, 同时可以经济有效地降低菌渣中的抗生素残留, 是当下国内企业进行抗生素菌渣处置的有效途径之一[7],[8]。本文重点研究了链霉素菌渣厌氧发酵过程中各参数的变化规律, 探讨了链霉素菌渣在含固率(以VS 的质量计,下同)为2%、中温(30±2 ℃)的条件下进行批式厌氧发酵时的产气特性及各参数的动态变化, 为抗生素菌渣的无害化处理研究提供了合理化方案和数据支持。
1 材料与方法
1.1 试验材料
链霉素菌渣取自河北省石家庄市华药集团,种子液(已在实验室进行了驯化)取自石家庄市桥西区污水处理厂。
1.2 试验方法
试验设置2 个处理,处理一为对照组,处理二为菌渣处理组,每个处理设置3 个平行。发酵罐运行的有效体积为2.5 L,其中,链霉素菌渣在处理二中的含固率为20 g/L, 对照组不添加链霉素菌渣(其他条件均与处理二相一致);种子液添加量均为有效体积的1/3,即800 mL,剩余部分用自来水补充。 定期记录集气袋中的气体体积和组分含量, 同时放出40 mL 发酵液用于理化性质的测定。 菌渣和种子液的理化性质如表1 所示。
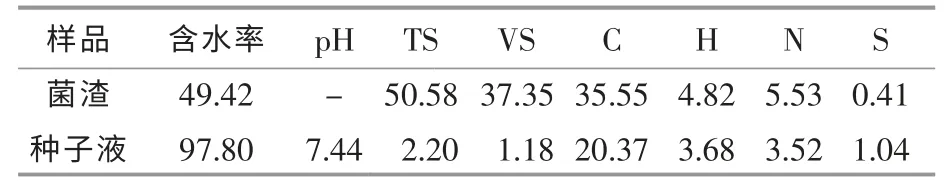
表1 链霉素菌渣与接种液的理化性质Table 1 Physicochemical properties of streptomycin fermentation residue and inoculum %
链霉素菌渣发酵液发酵前后抗生素效价的测定试验:以金黄色葡萄球菌为指示菌作链霉素效价检测,设置对照组(每孔加10 000 U 链霉素标准品)、发酵前组(取发酵前混合液50 μL)和发酵后组(取发酵后沼液50 μL)[9]。
1.3 试验装置及检测方法
试验装置如图1 所示。
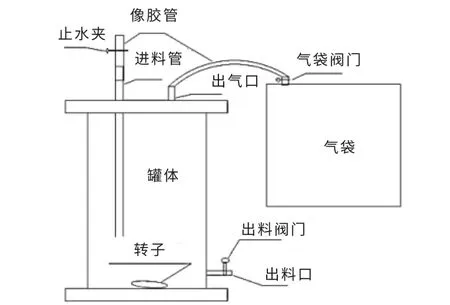
图1 厌氧发酵试验装置Fig.1 Diagram of anaerobic digestion test device
各指标的检测方法如下:
①溶解性化学需氧量(SCOD)和氨氮含量测定:化学需氧量快速测定仪5B-3C(V8),分别执行HJ/T399-2007 标准和DZ/T 0064.57-1993 标准;
②pH 值、挥发性脂肪酸(VFAs)和碳酸氢盐(TIC) 浓度测定:ZD-2 自动电位滴定仪, 采用Nordmann 滴定法[10];
③氧化还原电位测定:OHAUS STARTER 3100 氧化还原电位仪;
④沼气产量及组分含量测定:湿式流量计与Biogas 5000 沼气分析仪;
⑤含固率(包括TS 和VS)测定:烘箱-马弗炉差重法[11]。
2 结果与分析
2.1 SCOD 和氨氮含量的变化
在链霉素菌渣厌氧发酵过程中,SCOD 和氨氮含量的变化情况如图2 所示。 从图2(a)可以看出: 链霉素菌渣发酵液的起始SCOD 为466.65 mg/L,在厌氧发酵初期,体系中各种水解微生物的生长代谢活动较为活跃, 底物被分解成较小的可溶性物质,发酵液的SCOD 在短期内迅速上升,反应进行到第11 天时达到最高值 (2 199 mg/L);随着发酵时间的延长, 酸化菌对底物的适应能力变强,进而对有机质的利用速率加快,发酵体系中总有机质与可利用有机质的含量越来越少,SCOD也相应减少,18 d 后,链霉素菌渣发酵液的SCOD下降速率减缓,直至后期维持在500 mg/L 左右。
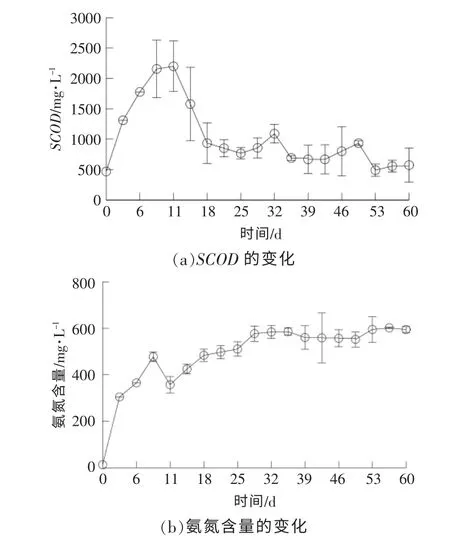
图2 SCOD 和氨氮含量的变化情况Fig.2 Changes of SCOD and ammonia nitrogen content
氨氮由蛋白质和氨基酸等各种含氮基质在水解酸化作用下产生, 氨氮含量的高低对反应体系的稳定性与反应速率有较大影响。 从图2(b)可以看出:链霉素菌渣厌氧发酵前期,发酵液的氨氮含量持续增加,第8 天出现峰值(477.53 mg/L)后略有下降,11 d 后, 发酵液的氨氮含量继续升高,第29 天达到576.80 mg/L,此后发酵液的氨氮含量维持在550~600 mg/L;反应体系氨氮含量的快速增加主要集中在0~8 d, 原因是此阶段系统中原料水解酸化速率逐渐加快, 蛋白质和氨基酸等容易分解利用的大分子组分快速降解, 生成了氨氮和小分子化合物。 由于发酵底物的含固率仅为2%,因此,发酵液的氨氮含量整体处于较低水平,此条件下的氨氮含量未达到相关报道指出的氨氮抑制浓度。
2.2 VFAs 和TIC 浓度的变化
在链霉素菌渣厌氧发酵的水解阶段, 底物通过菌群的降解作用被分解成单糖、 氨基酸等小分子有机物, 这些小分子有机物进一步降解为更短的成分复杂的挥发性脂肪酸(VFAs),这些VFAs是使产甲烷过程顺利进行的主要底物。 链霉素菌渣厌氧发酵过程中VFAs 和TIC 浓度的变化情况如图3 所示。 从图3 可以看出:在厌氧发酵初期,发酵液的VFAs 浓度迅速上升,第8 天出现峰值1 834 mg/L,之后直到第22 天,发酵液的VFAs 浓度快速下降;在厌氧发酵后期,发酵液的VFAs 浓度相对稳定,维持在170~230 mg/L。 链霉素菌渣发酵过程中,发酵液的VFAs 浓度整体较低,8~22 d 处于VFAs 的快速消耗期,原因是这个时期的甲烷菌活性较高, 将大量VFAs 分解转化为沼气;22~29 d 仍处于反应体系的产气高峰期, 此阶段的VFAs 浓度对链霉素菌渣厌氧发酵产沼气效果的影响不明显。TIC 对防止发酵液酸化、保证厌氧发酵反应正常进行具有重要作用。 从图3 可以看出, 在厌氧发酵初期, 发酵液的TIC 浓度逐渐增加,22 d 之后,维持在2 500~3 000 mg/L。
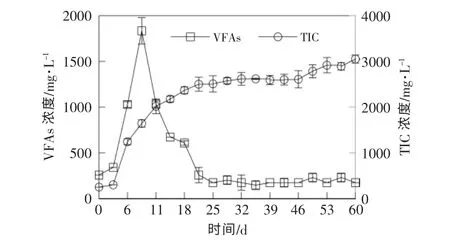
图3 VFAs 和TIC 浓度的变化Fig.3 Changes of VFAs andTIC
2.3 pH 值和氧化还原电位变化
在链霉素菌渣厌氧发酵过程中,发酵液的pH值和氧化还原电位的变化情况如图4 所示。 从图4(a)可以看出,在厌氧发酵初期,发酵液的pH 值明显下降, 反应进行到第6 天时降至最低, 之后pH 值明显上升, 从第15 天开始,pH 值的上升幅度减小,直到发酵结束,发酵液的pH 值始终维持在7.0~7.2。 在发酵初期,系统中底物的水解酸化造成的酸类物质增多是发酵液pH 值降低的主要原因;此外,TIC 浓度相对较低,对发酵液中酸类物质的缓冲能力较弱,对厌氧发酵初期发酵液pH值的变化亦存在一定的影响; 随着底物的降解及TIC 的积累,系统稳定性不断增强,在产气高峰阶段,VFAs 的快速利用和消耗使发酵液pH 的值快速上升。
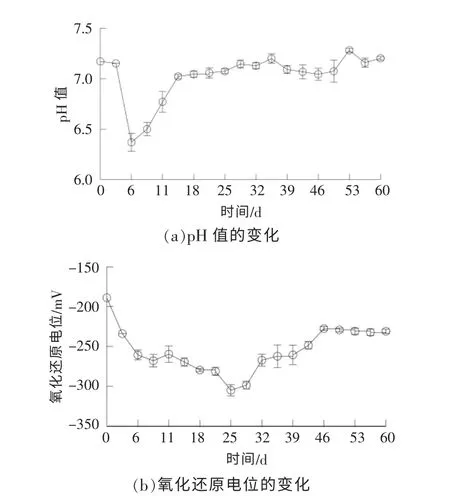
图4 发酵液pH 值和氧化还原电位的变化情况Fig.4 Changes of pH value and redox potential of fermentation broth
从图4(b)可以看出:在厌氧发酵的前6 d 里,发酵液的氧化还原电位由-189 mV 降至-260 mV,产气集中阶段(6~29 d),发酵液的氧化还原电位维持在-250~-300 mV; 随着产气速率的降低, 发酵液的氧化还原电位有所上升, 最终维持在-230 mV 附近。在厌氧发酵初期,系统中的氧气在好氧微生物的作用下快速耗尽,之后,底物通过厌氧微生物的代谢,转化为还原性酸类等有机物,这是发酵液的氧化还原电位在短期内迅速降低的主要原因。在产气高峰期,还原性酸类物质大量消耗,致使发酵液中还原性物质的浓度逐渐降低,促进了氧化还原电位的升高;在厌氧发酵后期,发酵液的氧化还原电位相对较稳定, 还原性物质的生成与消耗速率达到平衡。
2.4 日产气量和累积产气量的变化
在链霉素菌渣厌氧发酵过程中, 日产气量和累积产气量的变化情况见图5。 从图5 可以看出,厌氧发酵进行到第4 天开始产气, 日产气量为0.93 L,随后产气速率迅速下降,第6 天又开始缓慢上升,在第15,25 天分别产生两个日产气量峰值,29 d 之后, 沼气的产生速率明显降低,46 d 之后,沼气的产生速率小于0.05 L/d。 经计算,发酵进行到第36 天时,系统的累积产气量为16.60 L,约占总累积产气量的90%。 空白对照组的产气量<100 mL,可以忽略不计。

图5 日产气量和累积产气量的变化情况Fig.5 The changes of daily gas production and cumulative gas production
链霉素菌渣厌氧发酵的启动阶段会水解产生大量以CO2为主的气体, 随后厌氧发酵进入酸化期。随着甲烷菌对发酵环境的适应,产甲烷代谢随之增强,系统的产气量与甲烷含量不断升高,第15天时,系统的发酵环境最适合甲烷菌。由于原料中各种成分降解的难易程度不同, 发酵反应体系中微生物在对底物先后利用的过程中表现出时间差异,进一步体现为不同产气峰。日产气量的变化趋势与厌氧微生物直接利用的前体物质 (VFAs)含量的变化有较大的相关性, 随着体系中VFAs 浓度的升高, 厌氧发酵的日产气量亦表现出与之相对一致的同步性;在第22~29 天,两者的同步性出现较大偏差, 推测此时的甲烷菌代谢活性仍较高,产甲烷活动促进了底物的消耗,使得VFAs 的浓度降低;29 d 之后,发酵液中可利用的有机物几乎消耗殆尽,产甲烷菌的代谢受到影响,导致后期的产气量显著下降。
2.5 CH4 和H2S 含量的变化
在链霉素菌渣厌氧发酵产甲烷过程中,CH4和H2S 含量的变化情况如图6 所示。 从图6 可以看出:厌氧发酵初期,气体中的CH4含量(体积含量)较低,第15 天,CH4含量达到最高值(57.47%),直到厌氧发酵结束,发酵体系的CH4含量亦无明显变化;产气稳定期,CH4含量的平均值为55.27%;整个发酵过程中,沼气中的H2S 含量都很低,第1天,沼气中的H2S 的含量仅为1.32×10-4,第8 天后降至10-4以下, 之后,H2S 的含量一直处于0.4×10-4~0.8×10-4。

图6 CH4 和H2S 含量的变化情况Fig.6 The changes of CH4 and H2S content
2.6 链霉素菌渣厌氧发酵前后,TS 和VS 含量的变化
厌氧发酵系统中的有机物可用于各种厌氧微生物的生长繁殖和代谢过程。厌氧发酵前,发酵液中的TS 和VS 含量分别为3.37%和2.35%, 厌氧发酵后,TS 和VS 含量分别降至1.88%和0.84%,TS 和VS 的去除率分别达到44.19%和64.32%。由此可见,链霉素菌渣经过中温厌氧发酵后,其中的多数有机物被去除。
2.7 链霉素菌渣厌氧发酵前后链霉素残留的测定
链霉素对金黄色葡萄球菌的生长繁殖具有抑制作用,以金黄色葡萄球菌为指示菌,对链霉素菌渣厌氧发酵前后的链霉素活性进行测定, 结果如图7 所示。 测得CK 抑菌圈的平均直径为35.3 mm,厌氧发酵前,发酵液的抑菌圈直径接近打孔直径,平均为11.0 mm,而厌氧发酵后,沼液未表现出抑菌效果。这说明经过厌氧发酵后,链霉素菌渣的抗生素残留大大降低, 通过抑菌圈试验已经检测不到链霉素的残留, 进一步说明通过厌氧发酵可以实现链霉素菌渣的无害化、资源化处理。

图7 链霉素菌渣的厌氧发酵对抗生素活性的影响Fig.7 Effect of streptomycin fermentation residue anaerobic digestion on antibiotic activity
3 结论
①链霉素菌渣经过60 d 的中温(30±2 ℃)厌氧发酵,累积产气量为18.20 L,原料的产气能力为364.07 mL/g;发酵进行到第36 天时,系统的累积产气量占总产气量的90%,系统的最大产气速率为972.5 mL/d;在稳定产气阶段,CH4的含量为55.27%,H2S 的日排放量均值小于10-4。
②以金黄色葡萄球菌为指示菌对发酵前的菌渣和发酵后的沼液进行抑菌试验,试验结果表明,厌氧发酵后的沼液未出现抑菌圈, 这说明通过厌氧发酵的方式, 可以有效去除链霉素菌渣中的链霉素残留。
