褪黑素增强紫杉醇对膀胱癌T24细胞增殖的抑制作用
2020-06-17陈欢朱佳斌赵晓瑾董传江董自强
陈欢,朱佳斌,赵晓瑾,董传江△,董自强△
膀胱癌是泌尿系统最常见的恶性肿瘤[1],也是全球第十大最常见的癌症。在2018年,全球估计有54.9万新发病例和20万死亡病例;膀胱癌在男性中的发病较女性更常见,其发病率和死亡率是女性的4 倍[2]。近20 年来,我国膀胱癌的发病率呈明显上升趋势,居男性恶性肿瘤发病率第六位[3],寻找治疗膀胱癌的新靶点是目前临床研究的重点。根治性膀胱切除术并辅以化疗是目前治疗膀胱癌的主要方法[4]。但是,对于发生转移的膀胱癌,患者的5 年生存率仍然很低[5-6]。紫杉醇(paclitaxel,PTX)是国际上继阿霉素和含铂类抗癌药物之后的热点抗肿瘤药物,其作用机制是通过抑制增殖细胞的有丝分裂、诱导细胞凋亡,最终导致肿瘤细胞死亡[7]。紫杉醇对膀胱肿瘤具有显著的疗效,是目前所知单药治疗膀胱肿瘤最好的化疗药物。褪黑素(melatonin,Mel)是脊椎动物松果体的主要分泌产物,具有调节昼夜节律、睡眠、情绪、繁殖等生理作用[8]。先前的研究表明,褪黑素具有抗增殖、抗炎和抗肿瘤的作用[9]。本研究旨在观察褪黑素能否增强紫杉醇对膀胱癌细胞增殖的抑制作用,并探讨其作用机制,为褪黑素协同紫杉醇治疗膀胱癌提供理论依据。
1 材料与方法
1.1 主要药物、试剂与仪器 PTX(纯度>98%,购自美国sigma 公司)溶解于DMSO 中,储备液浓度500 μmol/L。Mel(纯度>98%,购自百灵威)溶解于DMSO 中,储备液浓度500 mmol/L。CCK-8 检测试剂购自Bimake 公司;环氧化物酶-2(COX-2)抗体、p-p65/p65 抗体、p-IκBα/IκBα 抗体购自美国Cell Signaling Technology 公司;核转录因子-kappa B(NF-κB)荧光素酶报告基因质粒购自碧云天生物技术公司;LipoFiterTM转染试剂购自汉恒生物科技有限公司;Dual-Luciferase 检 测 试 剂 盒 购 自Promega 公 司;RNAiso Plus 和PrimeScriptTMRT-PCR Kit 购自TaKaRa 公司。超净工作台购自苏州安泰空气技术有限公司;紫外分光光度仪购自Thermo公司;高速低温离心机、台式常温离心机购自美国Eppendorf公司;多功能酶标仪购自美国Peridn Elmer公司;Western blot仪器购自北京六一生物科技有限公司;CO2培养箱购自美国Thermo公司。
1.2 细胞系和细胞培养 人膀胱癌细胞株T24 购自美国模式培养物集存库(American typeculture collection,ATCC)。细胞培养于37 ℃含5%CO2(体积分数)的培养箱中。使用添加有10%(体积分数)胎牛血清及100 U/mL 青霉素和100 U/mL链霉素的RPMI 1640培养基中进行细胞培养,待贴壁生长至90%时使用胰蛋白酶消化传代。
1.3 CCK-8 实验检测T24 肿瘤细胞存活率 取对数生长期T24 细胞,按6×104/mL 密度接种于96 孔培养板内,同时以不含细胞的培养液作为调零孔,100 μL/孔。37 ℃、5%CO2条件下培养24 h后,实验组中分别加入含不同浓度褪黑素和(或)紫杉醇培养液,褪黑素终浓度为0.25、0.50、0.75和1 mmol/L,紫杉醇终浓度为5、10、25和50 nmol/L,对照组中加入不含任何干预剂的培养液,每组设5个复孔。培养48 h后,除去上清培养基,加入新鲜的含10%CCK-8的培养基。继续培养2 h,于酶标仪450 nm波长处检测各孔的吸光度(A)值,计算细胞的存活率(%)=(实验组平均A值/对照组平均A值)×100%。
1.4 药物剂量及细胞分组 根据CCK-8 实验结果,紫杉醇(5 nmol/L)联合褪黑素(0.75 mmol/L)处理T24 细胞48 h 后,其抑制率接近半数抑制浓度(IC50),其浓度将作为后面的实验浓度。T24细胞设对照组(DMSO处理)、褪黑素组、紫杉醇组、紫杉醇联合褪黑素组。
1.5 平板克隆形成实验检测T24 细胞的克隆形成能力 取对数生长期的T24细胞,6孔细胞培养板中每孔接种1 500个细胞,在CO2恒温孵育箱中培养24 h后,更换为新鲜的含有不同浓度药物的10%FBS 培养基。24 h 后,更换为新鲜的10%FBS 培养基,继续培养10 d。细胞经固定液(冰醋酸∶甲醇∶去离子水=1∶1∶8)固定后,0.1%结晶紫染液染色。
1.6 RT-PCR检测COX-2 mRNA水平 各组加药48 h后,收集膀胱癌细胞,Trizol 法提取各样本细胞总RNA,逆转录为cDNA,进行聚合酶链反应扩增。内参GAPDH 上游引物5'-AATCCCATCACCATCTTCC-3',下 游 引 物5'-CATCACGC CACAGTTTCC-3',产物长度382 bp;COX-2 上游引物5'-TCACAGGCTTCCATTGACCAG-3', 下游引物 5'-CCGAGGCTTTTCTACCAGA-3',产物长度189 bp。PCR 反应条件为:94 ℃30 s;55 ℃30 s,72 ℃30 s,循环30次;72 ℃延伸5 min。以COX-2/GAPDH比值表示目的基因相对表达量。
1.7 Western blot 检测蛋白表达 各组加药48 h 后,收集膀胱癌细胞,用RIPA裂解液裂解细胞蛋白,BCA蛋白定量试剂盒测定蛋白浓度。SDS-PAGE电泳后,将蛋白转至PVDF膜,5%脱脂奶粉TBS 封闭2 h,加入COX-2(1∶800)、GAPDH(1∶1 000)、p-p65(1∶500)、p65(1∶1 000)、p-IκBα(1∶500)、IκBα(1∶1 000),4 ℃孵育过夜,次日洗涤后,加入二抗,室温孵育1 h,ECL发光液显色检测。
1.8 Dual-Luciferase 报告基因检测NF-κB 启动子活性 取对数生长期的T24 细胞,以3×105个接种于6 孔板中。次日,无血清培养基饥饿4 h后,向每孔加入质粒-转染试剂混合液(0.07 μg pRL-TK、1.5 μg pGL3-NF-κB 和3.75 μL LipoFiterTM转染试剂),6 h 后,更换新鲜含有不同剂量药物的培养基。24 h后,用Dual-Luciferase试剂盒检测Luciferase荧光强度。
1.9 统计学方法 应用SPSS 17.0 统计软件进行统计分析,数据以均数±标准差(±s)表示,2 组间比较用独立样本t检验,多组间比较用单因素方差分析(ANOVA)或析因设计方差分析,组间多重比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 褪黑素联合紫杉醇对T24 细胞存活率、细胞形态和克隆形成的影响 单因素方差分析显示,与对照组相比,褪黑素、紫杉醇单独或者协同给药处理对T24 膀胱癌细胞均有明显的抑制作用(P<0.05),见图1。紫杉醇单独作用于T24 细胞48 h 的IC50为(19.5±2.7)nmol/L,紫杉醇联合褪黑素(0.75 mmol/L)作用于T24细胞48 h的紫杉醇IC50为(6.8±1.2)nmol/L。褪黑素可以增强紫杉醇对T24 细胞生长的抑制作用,紫杉醇联合褪黑素作用与紫杉醇单独作用相比,褪黑素能够明显降低紫杉醇的IC50值。由此,选取0.75 mmol/L褪黑素和5 nmol/L紫杉醇作为后续实验的给药浓度。通过研究发现,与紫杉醇或褪黑激素单独处理组相比,紫杉醇联合褪黑素组中T24 细胞形态变化更加明显,表现为细胞数目显著减少,细胞形态变圆,变小,细胞与细胞间的接触、丝状伪足均显著减少,见图2。析因方差分析显示,与紫杉醇组相比,联合治疗组中T24 细胞的克隆形成能力显著降低,差异有统计学意义,见图3。褪黑素可显著影响紫杉醇的治疗效果,联合褪黑素处理组细胞克隆形成率(8%)显著低于紫杉醇单独处理组(53.7%)。
2.2 褪黑素联合紫杉醇对T24 细胞COX-2 表达的影响 与对照组相比,紫杉醇组T24 细胞中COX-2的mRNA 和蛋白水平均明显降低;与紫杉醇单独治疗组相比,联合治疗组T24 细胞中COX-2 的表达水平进一步降低,见图4。
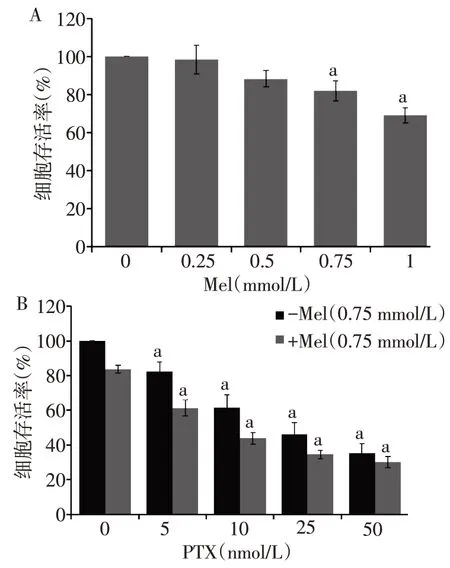
Fig.1 Effects of melatonin combined with paclitaxel on the survival rate of T24 cells图1 褪黑素联合紫杉醇对T24细胞存活率的影响
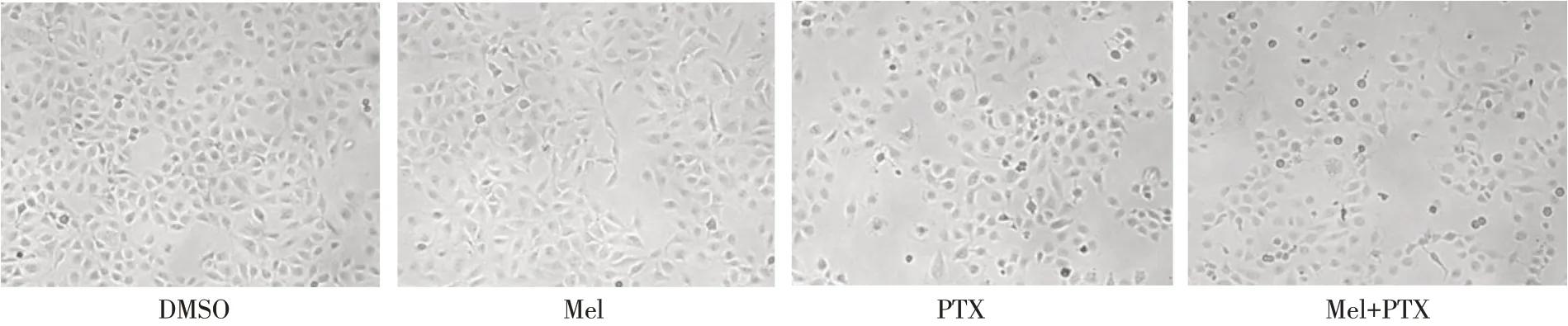
Fig.2 Effects of melatonin combined with paclitaxel on morphology of T24 cells(×25)图2 褪黑素联合紫杉醇对T24细胞形态的影响(×25)
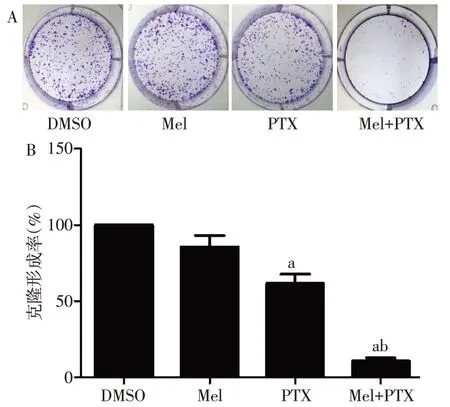
Fig.3 Effects of melatonin combined with paclitaxel on the cloning of T24 cells图3 褪黑素联合紫杉醇对T24细胞克隆形成的影响
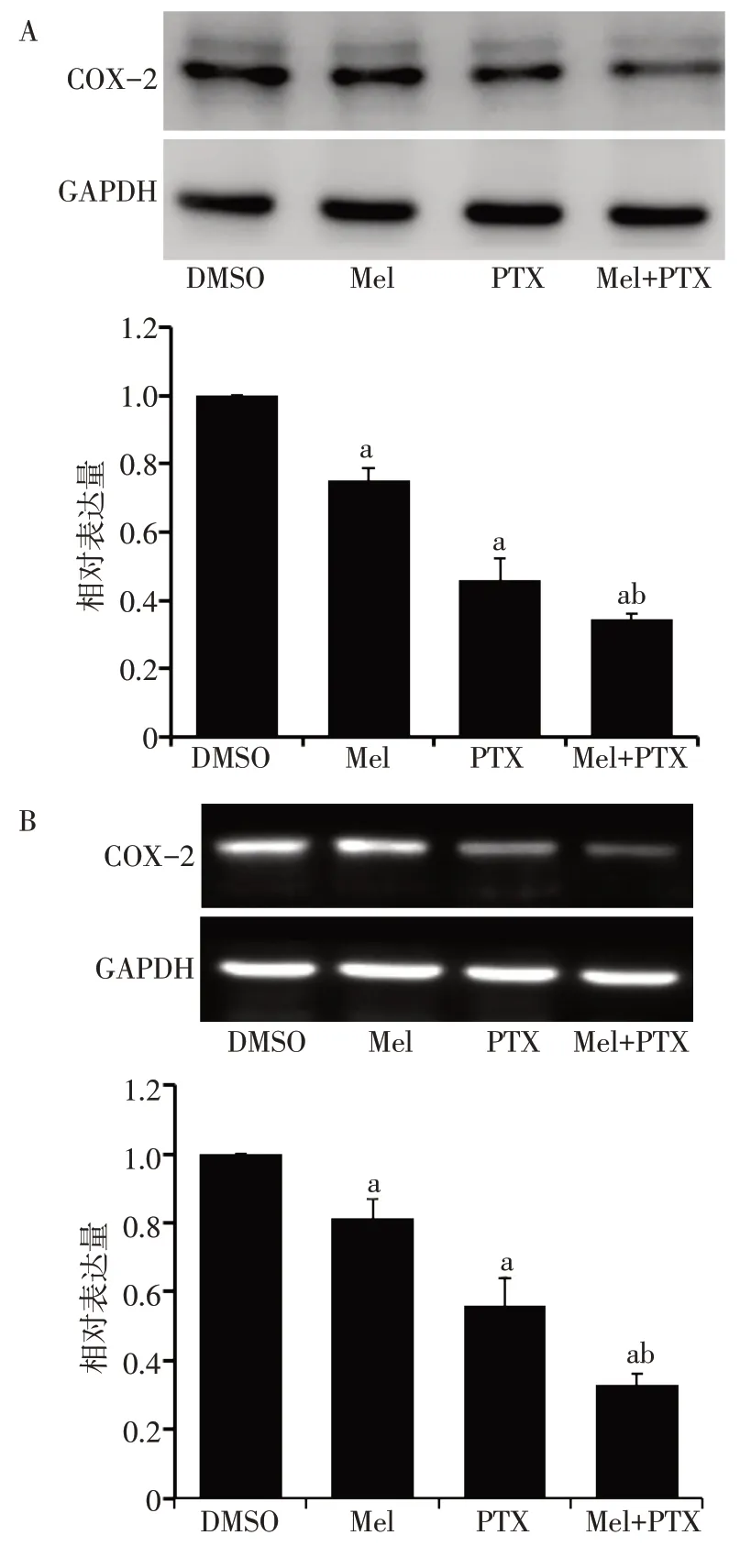
Fig.4 Effects of melatonin combined with paclitaxel on COX-2 expression in T24 cells图4 褪黑素联合紫杉醇对T24细胞COX-2表达的影响
2.3 褪黑素联合紫杉醇对NF-κB 信号通路的影响 与对照组和紫杉醇组比较,联合治疗组中pp65/p65 和p-IκBα/IκBα 的水平显著降低;此外,与紫杉醇组比较,联合治疗组NF-κB启动子转录活性也显著减低(P<0.05),见图5、6。
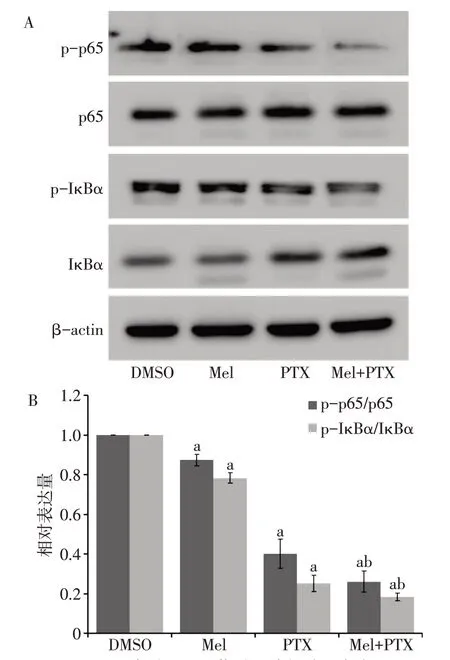
Fig.5 Effects of melatonin combined with paclitaxel on NF-κB signaling pathway图5 褪黑素联合紫杉醇对NF-κB信号通路的影响
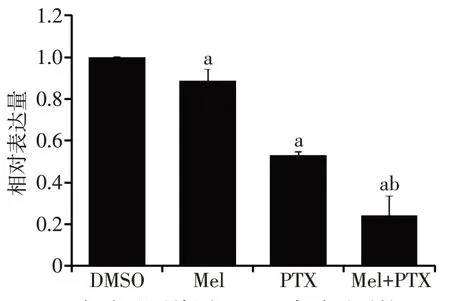
Fig.6 Effects of melatonin combined with paclitaxel on transcriptional activity of NF-κB promoter图6 褪黑素联合紫杉醇对NF-κB启动子转录活性的影响
3 讨论
在膀胱癌的治疗中,紫杉醇作为一种单药治疗膀胱肿瘤最好的化疗药物,在临床上取得了一定的疗效,但是其不良反应较多。为了增强紫杉醇的治疗效果,减轻药物带来的不良反应,改善患者的预后,临床中常采用紫杉醇联合其他药物治疗膀胱癌,如吉西他滨、顺铂等。褪黑素是一种衍生自L-色氨酸的吲哚胺,在生物体中普遍存在,包括人类。褪黑素具有广泛的生理作用,包括促进睡眠、昼夜节律、体温调节、季节性繁殖、抗氧化和免疫调节等[10-11]。褪黑素能够通过抑制NF-κB 信号通路抑制多种肿瘤的生长,包括膀胱癌、肝癌、结肠癌和白血病等[12-15]。许多研究证明,褪黑素是一种有效的抗癌药物,并且成功用于不同类型癌症的化疗以及增强肿瘤细胞对化疗药物的敏感性[13-14,16]。本研究发现褪黑素联合不同浓度紫杉醇对T24膀胱癌细胞的抑制作用显著高于单独使用紫杉醇,在褪黑素(0.75 mmol/L)的作用下,可以明显降低紫杉醇的IC50值。
COX-2 是花生四烯酸合成前列腺素的限速酶,与许多人类癌症的发生有密切联系,包括肺癌、乳腺癌、结肠癌等,其过度表达与患者预后不良高度相关[17-18]。COX-2 的表达受经典NF-κB 信号通路的严格调控[19-20]。COX-2 高表达于膀胱癌细胞中,可通过不同途径促进膀胱肿瘤细胞增殖,抑制细胞凋亡,增强癌细胞侵袭和转移能力,参与膀胱癌的发生发展[21-23]。因此,抑制COX-2 表达可能是抑制膀胱癌进展的有效方法。本研究表明,褪黑素显著增强紫杉醇抑制NF-κB信号通路的活性,表现为降低pp65/p65 和p-IκBα/IκBα 的蛋白表达水平。此外,褪黑素可增强紫杉醇抑制NF-κB启动子的转录活性,从而抑制COX-2 的表达,提示褪黑素增强T24 细胞对紫杉醇的敏感性的原因之一可能是褪黑素增强紫杉醇抑制NF-κB 信号通路的活性及其启动子的转录活性。
在体内实验,研究者给予裸鼠褪黑素25 mg/kg剂量时,可明显增加5-氟尿嘧啶的敏感性[13,24]。按照药理实验中动物间和动物与人体间的等效剂量换算[25],成人(60 kg)褪黑素服用量为2 mg,符合美国食品药品管理局(FDA)对于成人推荐剂量(1~3 mg)。紫杉醇用量为135~175 mg/m2,按照成人换算即45~66 μmol/L(体表面积为1.6 m2,血液量5.6 L)。因此,本研究中采用的剂量对人体的毒性在合理的范围内。
总之,本研究表明褪黑素增强了紫杉醇抑制膀胱癌生长的能力,其机制为通过抑制NF-κB/COX-2信号传导来实现褪黑素增强紫杉醇对膀胱癌细胞抑制作用。同时,本研究中采用的剂量对人体的毒性在合理的范围。这为今后褪黑素协同紫杉醇治疗膀胱癌提供了理论依据。
