基于铁离子作用结合高效液相色谱在线筛选金花茶花黄酮中抗氧化物质和体内抗氧化活性研究
2020-06-17张海龙虞青婷吴清孝秦小明
张海龙,虞青婷,吴清孝,秦小明*
1广东海洋大学食品科学与技术学院 广东省水产加工与安全重点实验室 广东省亚热带果蔬加工现代农业科技创新中心,湛江 524088;2怀化学院生物与食品工程学院,怀化 418008
金花茶为常绿灌木至小乔木,高2~3 m,属山茶科(Theaceae)山茶属(Camellia),于1933年在我国广西壮族自治区防城港防城大菉阿泄隘被我国学者左景烈首次发现,1965年被命名为TheopsischrysanthaHu,现《中国植物志》修订为CamellianitidissimaChi[1],其大部分分布于中国广西[2]。近年来研究表明,金花茶叶提取物中含有多种黄酮类物质[3],具有抗氧化、抗癌、降血脂等多种生物活性[4,5]。金花茶叶的化学成分和生物活性已被深入研究和报道,金花茶花富含黄酮[6],生物活性却研究较少,有报道金花茶花在体外具有良好抗氧效果,但仅限于体外抗氧化实验[7]。因此,研究金花茶花黄酮的体内抗氧化效果将其用于保健功能食品,具有十分重要的意义。
目前体外筛选抗氧剂主要采用柱后衍生的方法如图1所示,用相对稳定的自由基溶液,如2,2-二苯基-1-苦基肼(DPPH)或2,2-偶氮二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)显色后,注入到高效液相色谱(HPLC)来筛选抗氧化剂。Wu等[8]采用DPPH结合高效液相色谱从相思树花提取物中在线筛选出6种潜在的抗氧化物质,并分别用清除DPPH自由基、超氧化物自由基方法验证了上述物质的抗氧化效果;Karaçelik等[9]用ABTS结合高效液相色谱从欧洲荚蒾花中在线筛选出12种抗氧化物质,并用质谱表征上述筛选物均为已证实具有抗氧化效果的化合物。上述柱后衍生方法虽然能成功筛选出抗氧化物质,但是这些方法较复杂、试剂消耗大、操作繁琐而没有被商业化。可否用柱前衍生的方法筛选抗氧化物质,Tang等[10]报道了一种基于柱前衍生的方法,将金银花提取物与DPPH反应后,再注入到液相色谱系统,快速筛选出抗氧化物质,这表明柱前衍生筛选抗氧化物质是可行的。目前基于铁离子清除自由基和螯合作用筛选抗氧化物质的研究鲜有报道,因此,本文将建立基于铁离子作用(清除自由基和螯合作用)的柱前衍生方法,在线快速、简单和高效的筛选金花茶花黄酮中抗氧化物;同时结合体内抗氧化实验系统评价金花茶花黄酮的抗氧化效果。
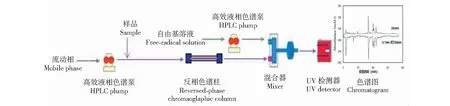
图1 采用自由基溶液在线筛选抗氧化物示意图Fig.1 Instrumental setup for the HPLC-DPPH or ABTS online detection of radical-scavenging compounds
1 材料与方法
1.1 材料
金花茶花黄酮(Cnfe)本实验自制,详细制备过程参阅文献[11],黄酮含量为70±5.83 g芦丁当量/100 g提取物。
1.2 实验试剂和仪器
1.2.1 实验试剂
乙腈和甲酸均为色谱纯,购自Fisher Chemical公司;DPPH、ABTS和维生素C购自Sigma Aldrich公司;三氯化铁购自国药控股有限公司;SPF级雄性SD(Sprague Dawley)大鼠(4~5周龄)购于济南朋悦实验动物繁育有限公司(实验动物生产许可证:SCXK (Lu) 2014-0007);维持饲料购于北京华阜康生物科技股份有限公司;D12492高脂饲料(脂肪供能占比60%)购于小黍有泰(北京)生物科技有限公司;谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、总超氧化物歧化酶(T-SOD)检测试剂盒、丙二醛(MDA)检测试剂盒、过氧化氢酶(CAT)检测试剂盒和BCA法检测总蛋白含量试剂盒均购于南京建成生物工程研究所有限公司。
1.2.2 实验设备
e2695高效液相色谱仪(美国,Waters),Lynx6000高速落地离心机(美国,ThermoFisher),1200型分析半制备高效液相色谱仪(美国,Agilent),Xevo G2-XSQTof四级杆飞行时间质谱(美国,Waters),Varioskan LUX全自动多功能酶标仪(美国,ThermoFisher),N-1100V-W旋转蒸发仪(日本,东京理化器械株式会社)。
1.3 方法
1.3.1 铁离子作用结合高效液相色谱法筛选抗氧化物质
1 mg/mL金花茶花黄酮溶液和浓度为0.1% 三氯化铁溶液等体积混合在40 ℃下孵育40 min。然后离心(10 000 rpm,10 min),收集上清过0.22 μm滤膜进入液相系统分析,用蒸馏水代替金花茶花黄酮溶液做空白实验。
1.3.2 高效液相色谱分析条件
采用C18色谱柱(4.6 mm × 250 mm,5 μm),柱温25 °C,UV检测器,波长280 nm,上样量10 μL,流速1.0 mL/min。流动相A甲酸水(水∶甲酸,99.7∶0.3,V/V)和流动相B乙腈,洗脱程序为:7% B(0~25 min),7%→9% B(25~40 min),9%→14% B(40~55 min),14%B(55~70 min),14%→18% B(70~90 min),18%→20% B(90~96 min),20%→80% B (96~99 min)和80%→7% B(99~100 min)。
1.3.3 收集各目标组分
采用半制备色谱收集各个目标峰,色谱条件如下:半制备柱YMC C18ODS-A column(10 mm × 250 mm,5 μm),柱温30 °C,流速4 mL/min,上样量100 μL,上样浓度100 mg/mL。其它色谱条件与上述1.3.2一致。目标组分采用人工收集,当目标峰被流动相洗脱下来时,收集目标峰放置于棕色玻璃瓶中,各目标物在40 ℃条件下,旋转蒸发脱除溶剂,然后冷冻干燥48 h,再加入适量溶剂配成相应的浓度用于抗氧化分析。
1.3.4 清除DPPH自由基方法
采用早期报道的方法[12],并略作修改,100 μL不同浓度的样液和100 μL浓度 0.2 mM DPPH溶液混合,在25 ℃孵育30 min。100 μL的蒸馏水和100 μL的DPPH溶液用于空白实验。上述混合物在517 nm处检测吸光度。
自由基清除率 =(1-样品吸光度/空白吸光度)× 100%
1.3.5 清除ABTS自由基方法
清除ABTS自由基方法根据Re等[13]的报道,并略作修改。ABTS+溶液用乙醇稀释到吸光度在0.7附近,50 μL的样品溶液和200 μL ABTS+溶液混合置于25 °C避光孵育6 min,在734 nm处检测上述混合物的吸光度。50 μL的蒸馏水和50 μL的ABTS+溶液用于空白实验。
自由基清除率 =(1-样品吸光度/空白吸光度)× 100%
1.3.6 黄酮化合物结构表征
采用时间飞行质谱对目标组分结构表征,质谱条件如下:采用负离子全扫描模式,质量范围设置为100~2 000 Da,雾化温度400 ℃,毛细管电压2 kV。将目标组分的质谱数据与文献对照确定化合物的结构。
1.3.7 动物实验设计
实验选用SPF级雄性SD大鼠(4~5周龄,体重120~130 g),饲养条件为:湿度:55%±10%、温度:24±2 ℃、光照/黑暗周期12 h,大鼠可自由获取水和维持饲料。经过7天适用期后,60只大鼠被随机分为高脂饲料饮食组(50只)和正常维持饲料饮食组(10只)。选择经过4周高脂饮食成功造成肥胖的大鼠氧化应激模型(体重大于正常饮食组平均体重10% 以上),随机分为4个小组,每组7只,每笼3~4只。第一组(HFD)模型组,采用高脂饲料喂养;第二组高剂量组(HDG),高脂饲料加金花茶花黄酮(灌胃量:300 mg/kg体重(BW)/天); 第三组中剂量组(MDG),高脂饲料加金花茶花黄酮(灌胃量:150 mg/kg BW/天);第四组低剂量组(LDG),高脂饲料加金花茶花黄酮(灌胃量:75 mg/kg BW/天)。实验于四周后结束,SD大鼠禁食12 h后,采用15%水合氯醛麻醉,收集腹主动脉血样。血样在4 ℃下,3 000 rpm离心10 min,收集血清和肝脏置于-80 ℃直至用于检测抗氧化指标。以上所有的动物实验操作均按照广东海洋大学伦理委员会(SYXK(YUE) 2019-0204)批准的方法进行。
1.3.8 体内抗氧化指标检测
血清和肝脏的谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)、丙二醛(MDA)、过氧化氢酶(CAT)的检测方法均按照南京建成生物工程研究所有限公司说明书进行。
1.3.9 数据处理
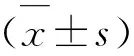
2 结果与分析
2.1 铁离子作用结合高效液相色谱法筛选抗氧化物质结果
人们通常用两种机制来解释铁离子与黄酮的抗氧化作用,即清除自由基和金属螯合作用[14]。金属螯合作用支持了黄酮作为潜在的抗氧化剂在抑制过渡金属催化自由基形成方面的作用[15,16]。金属螯合和氧化还原作用发生在铁离子和黄酮溶液之间。

图2 金花茶花黄酮分别与水(A)、三氯化铁溶液(B)反应后的高效液相色谱色谱图Fig.2 High performance liquid chromatography (HPLC) of Cnfe with water (A) and FeCl3 solution (B)
在金属螯合过程中,三价铁离子与黄酮的结合破坏了黄酮的分子结构。在氧化还原反应中, 三价铁离子被还原成二价亚铁离子[17,18],同时抗氧化剂一旦与三价铁离子反应,分子结构中的共轭系统被破坏。因此,具有抗氧化效果的黄酮与三氯化铁溶液相互作用后,其高效液相色谱图的吸光度下降;而与三氯化铁溶液混合反应后峰型几乎没有变化的化合物,说明其抗氧化作用弱或无抗氧化作用。实验结果如图2和表1所示,金花茶花黄酮高效液相色谱图中有多个峰,经铁离子作用结合高效液相色谱法处理后,峰1、2、3、4、5、6、7、8、9峰面积相对减少量分别为60.20%±1.56%、100.00%±0.00%、54.75%±2.05%、100.00%±0.00%、100.00%±0.00%、43.70%±3.54%、72.65%±1.06%、17.10%±1.00%、26.20%±2.21%。峰10的峰面积相对减少量为1.96%±0.28%,峰面积几乎没有大的改变。因此,除了峰10外,所有指定的峰都被认为是金花茶花黄酮中潜在抗氧化剂。
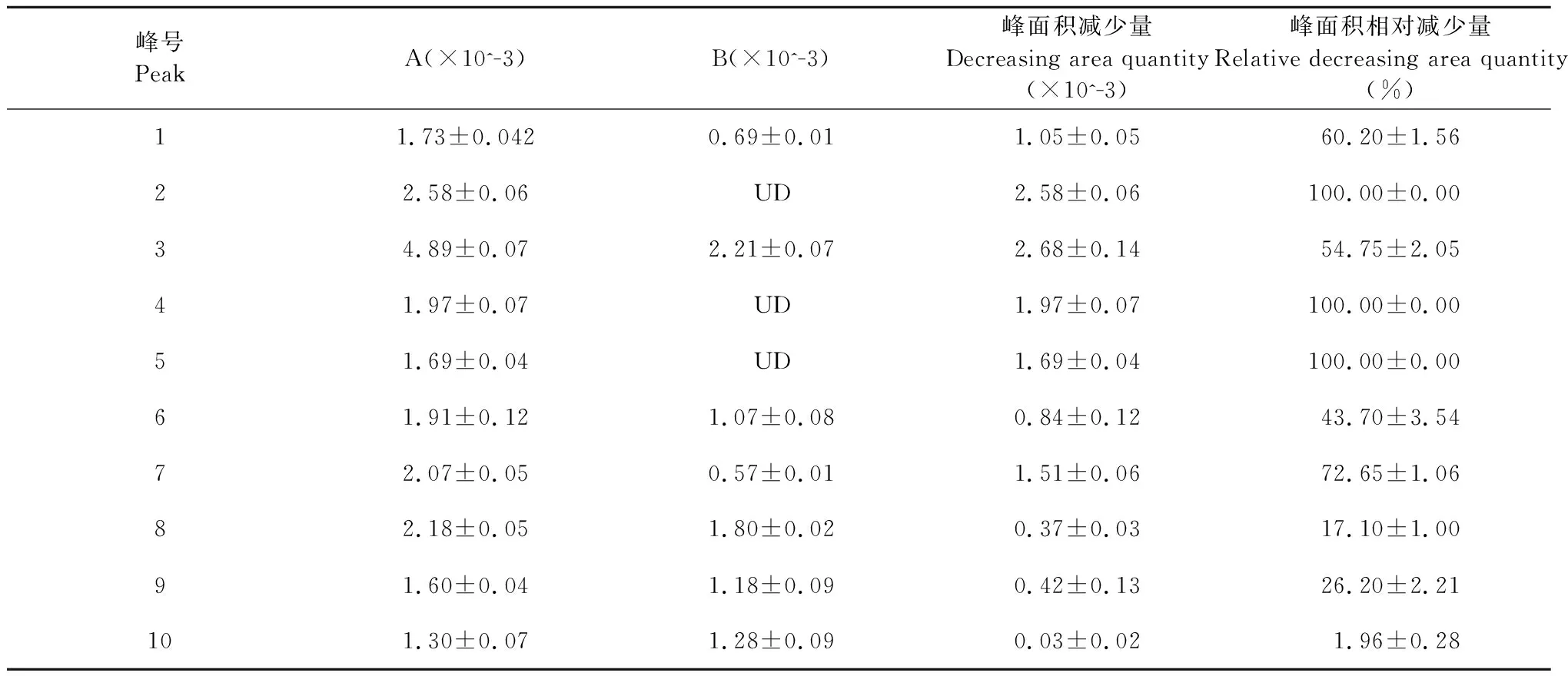
表1 金花茶花黄酮1~10峰面积数据Table 1 Peak area data of 1-10
注:A为金花茶花黄酮与水反应后各峰面积值,B为金花茶花黄酮分别与三氯化铁反应后各峰面积,峰面积减少量=A-B,峰面积相对减少量=(A-B)/A×100%,UD为没有检测到峰面积。
Note:A was the peak area of the reaction of Cnfe with water,and B was the peak area of the reaction of Cnfe with Fecl3,respectively.The peak area decrease value=A-B,and the relative decrease amount of peak area= (A -B) /A×100%.UD:The peak area was not detected.
2.2 验证金花茶花黄酮中1~10峰的抗氧化效果
采用DPPH自由基清除方法和ABTS自由基清除方法鉴定了金花茶花黄酮1~10峰的抗氧化活性。1~10峰的清除自由基效果如表2和表3所示。结果表明,1~9峰的DPPH自由基清除率和ABTS自由基清除率较好。其中峰1、2、3、5、6、9的DPPH自由基清除率IC50分别为9.17±0.51、7.46±0.04、8.35±0.04、9.12±0.85、9.29±0.71、9.14±0.66 μg/mL,均小于阳性对照维生素C组的DPPH自由基清除率IC50(9.46±0.33 μg/mL)。峰10的DPPH自由基清除率IC50(65.51±2.38 μg/mL)明显高于1~9峰的DPPH自由基清除率IC50,而对应的清除DPPH 自由基活性最低。清除ABTS自由基的IC50由小到大的顺序如下:峰2的IC50(8.39±0.01 μg/mL)< 峰1的IC50(10.66±0.22 μg/mL)<峰9的IC50(10.69±0.18 μg/mL)<峰3的IC50(10.84±0.04 μg/mL)<峰4的IC50(12.22±0.25 μg/mL)<维生素C的IC50(13.23±0.09 μg/mL)<峰6的IC50(13.98±0.14 μg/mL)<峰5的IC50(15.75±0.30 μg/mL)<峰8的IC50(15.93±0.62 μg/mL)<峰7的IC50(35.51±0.01 μg/mL)<峰10的IC50(264.67±19.82 μg/mL)。峰10的清除ABTS自由基IC50是所有峰中最大的,而对应的ABTS清除活性最小。液相色谱图的峰面积相对减少量、DPPH自由基清除率IC50和ABTS自由基的清除率IC50三者之间并不呈对应关系。这主要是由于三者检测抗氧化物的原理(抗氧化体系)不同造成的。综上所述DPPH和ABTS自由基清除能力IC50的测定结果也证实了铁离子作用结合高效液相色谱法筛选金花茶花黄酮的抗氧化化合物是可行的。

表2 金花茶花黄酮1~10峰清除DPPH自由基的效果Table 2 Effects of Cnfe single sample on DPPH-scavenging activity

表3 金花茶花黄酮1~10峰清除ABTS自由基的效果Table 3 Effects of Cnfe single sample on ABTS-scavenging activity
2.3 金花茶花黄酮中1~10峰的结构表征
采用时间飞行质谱对金花茶花黄酮中的1~10峰的结构进行表征,结果如表4所示。峰1和峰2的紫外吸收光谱在280 nm有最大吸收值,且在m/z577处有分子离子峰,二级质谱数据在m/z451、425、407、289处出现特征碎片离子,上述数据显示峰1和峰2可能为原花青素二聚体(Procyanidin dimer)的同分异构体[19]。碎片离子m/z451通过杂环裂变失去一分子间苯三酚(分子量126)的中性物质产生;碎片离子m/z425由分子离子经逆狄尔斯-阿德尔(RDA)裂解失去一个C8H8O3(分子量152)产生。碎片离子m/z407由碎片离子m/z425失去了一个水分子得到。碎片离子m/z289是表儿茶素或儿茶素,两分子的表儿茶素(儿茶素)通过醌甲基化机制产生分子离子m/z577。综合上述分析,峰1和峰2为原花青素二聚体。
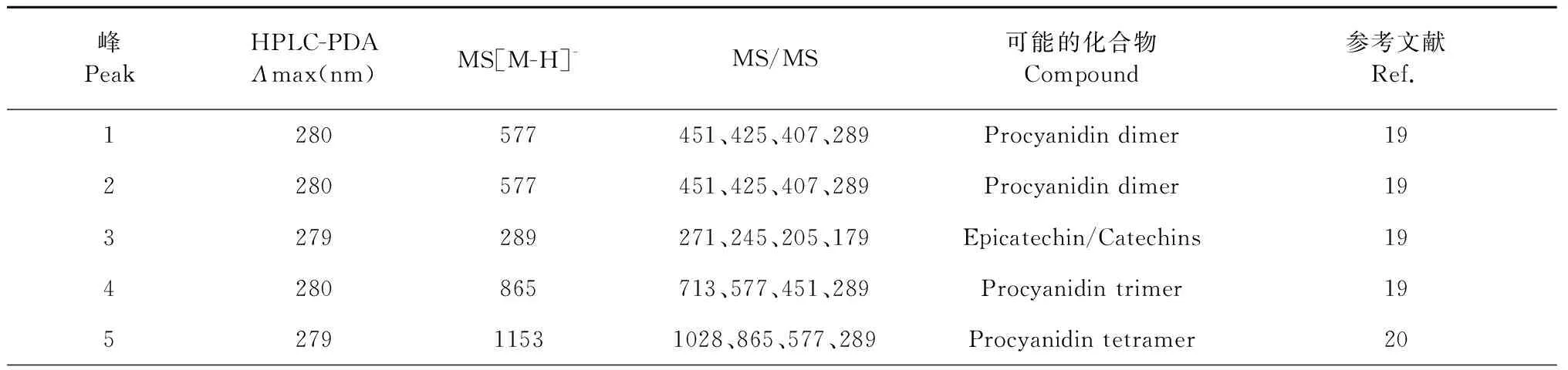
表4 金花茶花黄酮1~10峰的最大紫外可见吸光度和质谱数据Table 4 UV-vis and MS spectra and proposed identities of Cnfe
续表4(Continued Tab.4)
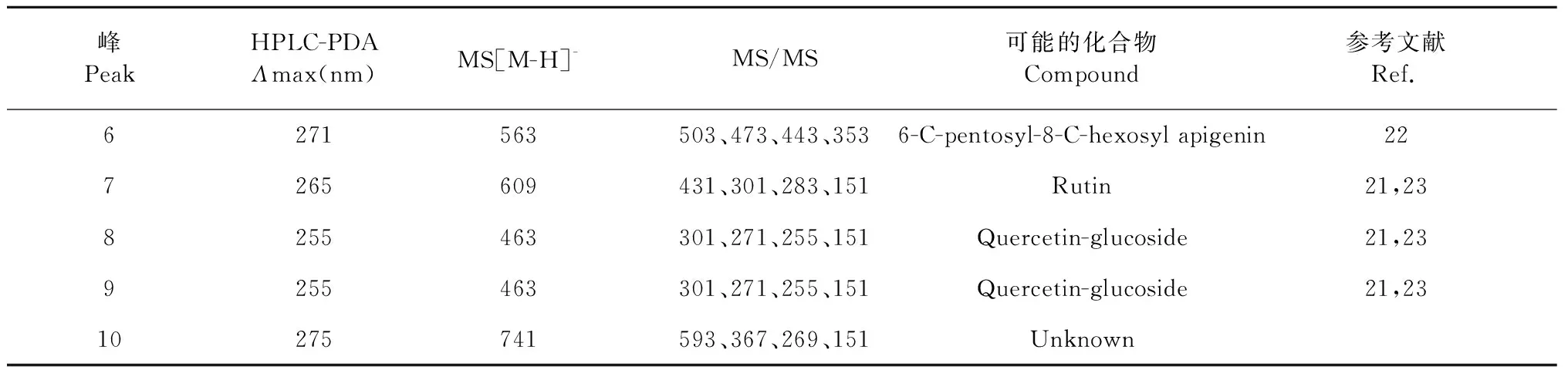
峰PeakHPLC-PDA Λmax(nm)MS[M-H]-MS/MS可能的化合物Compound参考文献Ref.6271563503、473、443、3536-C-pentosyl-8-C-hexosyl apigenin227265609431、301、283、151Rutin21,238255463301、271、255、151Quercetin-glucoside21,239255463301、271、255、151Quercetin-glucoside21,2310275741593、367、269、151Unknown
峰3的紫外吸收光谱在279 nm处有最大吸收值,在m/z289处有分子离子峰,其二级质谱数据在m/z271、245、205、179处有特征碎片离子,上述数据显示峰5为表儿茶素或儿茶素[19]。碎片离子m/z271和245分别通过分子离子m/z289失去一分子水和一分子二氧化碳形成。碎片离子m/z205是由分子离子m/z289失去两个乙烯酮形成;碎片离子m/z179由分子离子m/z289失去一分子邻苯二酚分子形成的。4和5峰的紫外吸收光谱分别在279 和280 nm处有最大吸收值,分别在m/z865和1 153处有分子离子峰,且二级质谱数据中分别有m/z713、577、451、289特征碎片离子和m/z1028、865、577、289特征碎片离子,为原花青素三聚体和四聚体[19,20]。
峰6和7的紫外吸收光谱在271和265 nm处有最大吸收值,分别在m/z563和609处有分子离子峰,且二级质谱中分别有m/z503、473、443、353和m/z431、301、283、151特征碎片离子,符合芹菜素-6-C-葡萄糖-8-C-木糖苷[22]、芦丁[21]结构特征,所以峰6和7分别是芹菜素-6-C-葡萄糖-8-C-木糖苷和芦丁。8峰和9峰的紫外吸收光谱在255 nm处有最大吸收值,在m/z463处出现分子离子峰,二级质谱数据在m/z301、271、255、151处出现特征碎片离子,峰8和9为同分异构体,且符合异槲皮素的结构特征[21,23],峰8和9为异槲皮素或异槲皮素同分异构体。10峰的紫外吸收光谱在275 nm处有最大吸收值,在m/z741处有分子离子峰,二级质谱数据为m/z593、367、269、151,10峰的详细结构未知需要进一步表征。
综述所述1~9峰分别为原花青素二聚体、原花青素二聚体、表儿茶素、原花青素三聚体、原花青素四聚体、芹菜素-6-C-葡萄糖-8-C-木糖苷、芦丁、异槲皮素或异槲皮素同分异构体,这与我们早期的研究结果一致[11],这些物质都具有较强的抗氧化效果。
2.4 金花茶花黄酮体内抗氧化研究

表5 金花茶花黄酮体内抗氧化指标(肝脏)Table 5 Antioxidant activity of Cnfe in
注:与HFD比较,*P< 0.05;**P< 0.01;与NFD比较,#P< 0.05;##P< 0.01,下同。
Note:Compared with HFD,*P< 0.05,**P< 0.01;Compared with NFD,#P< 0.05,##P< 0.01,the same below.

表6 金花茶花黄酮体内抗氧化指标(血清)Table 6 Antioxidant activity of Cnfe in
检测了金花茶花黄酮干预高脂饲料诱导的氧化应激模型大鼠肝脏和血清的抗氧化指标,结果如表5和表6所示。相对正常饮食组肝脏中脂质过氧化物丙二醛含量(2.03±0.11 nmol/mg),高脂饲料能显著增加高脂饲料组肝脏中丙二醛的含量(3.10±0.36 nmol/mg,P<0.01)。经过金花茶花黄酮干预后,能显著降低肥胖大鼠肝脏中丙二醛的含量,且剂量效应明显。随着金花茶黄酮浓度增加,高脂饲料诱导的氧化应激模型大鼠肝脏丙二醛含量越低,高剂量组和中剂量组的肝脏丙二醛含量显著低于高脂饮食组(P< 0.05)。相对正常饮食组而言,高脂饲料导致了高脂饲料组肝脏和血清中过氧化氢酶、谷胱甘肽过氧化物酶和总超氧化物歧化酶含量下降,诱发了氧化应激效应。经过金花茶花黄酮干预后能显著增加肝脏和血清中过氧化氢酶、谷胱甘肽过氧化物酶和总超氧化物歧化酶的含量。特别是在高剂量金花茶花黄酮组,肝脏中的过氧化氢酶(60.47±2.80 U/mg)、谷胱甘肽过氧化物酶(649.10±51.50 U/mg)和总超氧化物歧化酶(69.91±4.56 U/mg)经过干预后均接近正常饮食组的过氧化氢酶(60.68±4.34 U/mg)、谷胱甘肽过氧化物酶(627.10±49.8 U/mg)和总超氧化物歧化酶(73.27±8.31 U/mg)水平,实验结果与Xu[24]和Xiao[25]等的研究结果一致。Xu等[24]发现含有原花青素的苹果多酚能提高仔猪的抗氧化能力、改善脂质代谢、降低氧化应激效应;Xiao等[25]也发现含有原花青素的莲蓬提取物能提高小鼠血清中总抗氧化能力水平、谷胱甘肽过氧化物酶和总超氧化物歧化酶活性,降低脂质过氧化产物丙二醛的含量。实验结果表明金花茶花黄酮也含有大量的原花青素,具有显著改善高脂饲料导致大鼠的氧化应激效应,提高血清和肝脏中总抗氧化能力水平。
3 结论
本文以金花茶花黄酮为例,建立了基于铁离子作用结合高效液相色谱在线筛选抗氧化物的方法。用清除DPPH自由基和ABTS自由基方法验证了铁离子作用结合高效液相色谱筛选抗氧化物质是可行的,并用时间飞行质谱表征了潜在的抗氧化物质。铁离子作用结合高效液相色谱筛选抗氧化物质的方法具有快速、简单和高效特点,是否能应用于其他提取物还需进一步研究。体内抗氧化实验表明,金花茶花黄酮通过降低脂质过氧化产物丙二醛的含量,上调抗氧化应激防御系统中过氧化氢酶、谷胱甘肽过氧化物酶和总超氧化物歧化酶的含量,显著改善大鼠体内氧化应激效应。上述发现为金花茶花在功能性食品的应用提供了理论支持。
