木犀草素通过MIEF1抗H9c2心肌细胞损伤的机制研究
2020-06-17史有阳孙霃平
史有阳,杨 瑞,张 洋,孙霃平,刘 胜
上海中医药大学附属龙华医院中西医结合乳腺科,上海200032
阿霉素(doxorubicin,Dox)为乳腺癌常用的化疗药物,是目前治疗乳腺癌的一线药物,也是术后辅助治疗和姑息治疗中重要的组成部分[1]。心脏毒性是阿霉素临床应用主要不良反应之一,随着剂量的增加,心脏毒性的发生率升高[2],因此寻找减轻阿霉素心脏毒性的有效药物具有重要意义。
中药桔梗辛、苦、平,具有宣肺祛痰、利咽排脓的功效。神农本草经有云:“主胸胁痛如刀刺,腹满肠鸣幽幽,惊恐悸气”[3]。课题组前期研究发现,桔梗能够提高阿霉素化疗后乳腺癌病人的左心室射血分数,减轻阿霉素带来的心脏毒副反应[4]。桔梗与阿霉素联合应用可提升乳腺癌肺转移小鼠左心室射血分数水平,增强心脏泵血功能,促进阿霉素在肺部的聚集,降低其在心脏的分布[5]。但具体药物活性成分及作用机制并不明确。木犀草素(luteolin,Lut)是一种分布广泛的类黄酮,常以糖苷类形式大量存在于包括桔梗在内的多种中药中[6]。现代药理学研究表明,Lut具有抗肿瘤[7]、抗氧化[8]、心血管保护的功能[9],但对心肌细胞保护的具体机制并不明确。本研究拟用阿霉素建立心肌细胞损伤模型,通过转录组学测序筛选出Lut作用靶点,并运用分子生物学技术,对潜在靶点线粒体延长因子1(mitochondrial elongation factor 1,MIEF1)进行抑制,探究Lut对人心肌细胞损伤的保护作用及机制,为进一步治疗阿霉素化疗后心脏毒性提供依据。
1 材料
1.1 细胞
野生型大鼠H9c2心肌细胞购自中国科学院上海细胞库。低表达MIEF1大鼠H9c2心肌细胞由本实验室构建。
1.2 药物及试剂
木犀草素(成都曼思特生物科技有限公司,批号:MUST-17102605,纯度≥98%);MTT粉剂(美国Sigma公司);阿霉素(碧云天生物技术有限公司,批号:SC0159);RPMI-1640 培养基(美国Hyclone公司);磷酸盐缓冲液(PBS)、胎牛血清(FBS)、青链霉素双抗、胰蛋白酶(美国Gibico公司);Qubit2.0 DNA检测试剂盒(Life Q10212);MIEF1抗体(北京博奥森生物技术有限公司,批号:bs-12634R);p-Drp1(Ser637),Caspase-3抗体(美国Cell Signaling公司,批号分别为4867,9662);Trizol,GAPDH,HRP标记的山羊抗兔IgG二抗(上海生工生物有限公司,批号B511311、D110016、D110058);siRNA转染试剂盒(苏州吉玛生物有限公司,批号G04003)。
1.3 仪器
细胞培养箱(美国Thermo公司);Qubit2.0荧光计Q32866 Invitrogen;RT-PCR仪(美国 Thermo公司);电泳仪及酶标仪(美国BIO-RAD公司);倒置显微镜(日本Olympus 公司);HiseqTM测序仪(美国Illumina公司)。
2 方法
2.1 细胞培养
大鼠H9c2心肌细胞接种于含10%胎牛血清,1%青链霉素混合液的1640完全培养基,于37 ℃,5% CO2培养箱中培养,每3天以0.25%胰酶消化传代。
2.2 增殖抑制率测定
取5×103对数生长期H9c2细胞接种于96孔板中,置于培养箱中继续培养。24 h后,弃去培养基,每孔加入Dox(1 μM)及不同浓度的Lut(5、10、20 μM)作用24 h。每孔加入15 μL MTT 反应4 h,加入DMSO 150 μL,振荡5 min,用酶标仪测定波长为490 nm处的光密度值(OD值),按下式计算:
细胞增殖抑制率=(对照组OD值-实验组
OD值)/对照组OD值×100%
2.3 总RNA提取与测序
取对数生长期5×104个H9c2心肌细胞,种入6孔板。设置为正常组、Dox(1 μM)组、Dox(1 μM)加Lut(20 μM)组,每组3个样本重复,药物处理24 h后,加入氯仿,离心,异丙醇萃取后乙醇洗涤沉淀。干燥后,加入ddH2O溶解RNA,琼脂糖凝胶电泳检测RNA完整性。以短片段RNA为模板,合成一链cDNA,加入缓冲液、dNTP、RNase和DNA polymeraseⅠ合成二链cDNA;将双链cDNA修复、加A尾并连接测序接头,PCR扩增,按照1∶1的比例等量混合后,采用HiseqTM测序仪进行测序,Trimmomatic,HISAT2及StringTie 软件分析测序数据[10]。
2.4 差异表达基因靶点筛选
采用DESeq进行显著差异的基因分析,用Fold Change值表示基因表达的差异倍数,按|log2(Fold Change)|>1且P<0.05,q<0.05的原则筛选差异表达靶点基因(differentially expressed gene,DEG)。
2.5 低表达MIEF1基因H9c2细胞的构建及验证
为了进一步明确MIEF1与Lut改善心肌细胞损伤的关系,利用分子生物学技术构建siRNA-MIEF1抑制H9c2细胞中MIEF1的表达。取对数生长期野生型大鼠H9c2心肌细胞,以5×104每孔种于6孔板内,待细胞贴壁后分为5组,正常组加入常规培养基,其余4组分别加入空载体siRNA、siRNA-MIEF1 1号、2号、3号Mate转染试剂复合物,轻轻摇晃培养基均匀后放置37℃,CO2培养箱内转染24 h,Western blot验证MIEF1蛋白的抑制效果。
2.6 RT-PCR法验证细胞MIEF1 mRNA表达情况
取对数生长期野生型大鼠H9c2心肌细胞,以5×104每孔种于6孔板内,分组及处理同“2.5”项,提取总RNA。MIEF1及GAPDH基因引物由苏州吉玛生物有限公司设计。MIEF1基因上游引物F5′-GGGAGGAACCAAACUGGAUTT-3′,下游引物R5′-AUCCAGUUUGGUUCCUCCCTT-3′,GAPDH基因上游引物F5′- GGTGCTGAGTATGTCGTGGAG-3′,下游引物R5′-TTGCTGACAATCTTGAGGGAG-3′。两步法进行扩增,45个循环。
2.7 蛋白免疫印迹法(Western blot)检测蛋白表达水平
取对数生长期H9c2心肌细胞,以每孔5×104个接种于6孔板,每孔2 mL,设置为正常组,低表达MIEF1加Dox(1 μM)组,Dox(1 μM)组,低表达MIEF1加Dox(1 μM)加Lut(20 μM)组。收集细胞,冰上裂解细胞30 min后,15 000转离心15 min,取上清,BCA法测定蛋白浓度,电泳、转膜后,5%BSA封闭2 h。一抗根据说明书按1∶1 000稀释,抗体加入封闭液中稀释到所需浓度,4°C孵育过夜。二抗根据说明书1∶2 000稀释,加入二抗室温孵育2 h后ECL化学发光显色剂显色,用凝胶分析系统扫描出图像。
2.8 统计方法

3 结果
3.1 Lut对Dox诱导后H9c2 细胞活力的影响
与正常组比较,Dox组H9c2细胞活力显著降低(P<0.05);与Dox组比较,不用浓度Lut处理后,H9c2细胞活力明显提升,细胞的存活率较Dox组有显著差异(P<0.05)。20 μM Lut效果最好,因此后续选择20 μM进行转录组测序(见表1)。
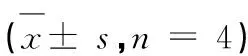


组别Group浓度Concentration(μM)存活率Survival rate(%)正常 Normal-100.00Dox160.00±3.69*Dox+Lut1+564.46±6.16#1+1083.60±2.90#1+2087.77±6.09#
注:与正常组比较,*P<0.05;与阿霉素组比,#P<0.05。
Note:Compared with normal,*P<0.05;Compared with Dox,#P<0.05.
3.2 细胞差异基因表达情况
将H9c2细胞转录组测序获得的基因表达量进行标准化处理,两组分别进行比较,筛选出P<0.05且q<0.05,和Fold Change大于2倍及小于0.5倍的差异基因。如图1和表2所示,Dox组与正常组进行比较得到3 582个差异基因,其中上调基因647个,下调基因2 935个;Lut加Dox组与Dox组进行比较得到1 981个差异基因,其中上调基因1 811个,下调基因170个。为了找到与用药相关的差异基因,选取Dox组对比正常组中上调且Dox加Lut组对比Dox组下调的123个基因;选取Dox组对比正常组中下调且Dox加Lut组对比Dox组上调的814个基因(图2)对以上的交集基因进行分析。分析后发现,与正常组相比,Dox组MIEF1基因被显著下调;而经过Lut治疗后,与Dox组相比,MIEF1基因表达水平得到恢复。因此,后期实验选择MIEF1作为Lut改善H9c2心肌细胞损伤的靶点基因。
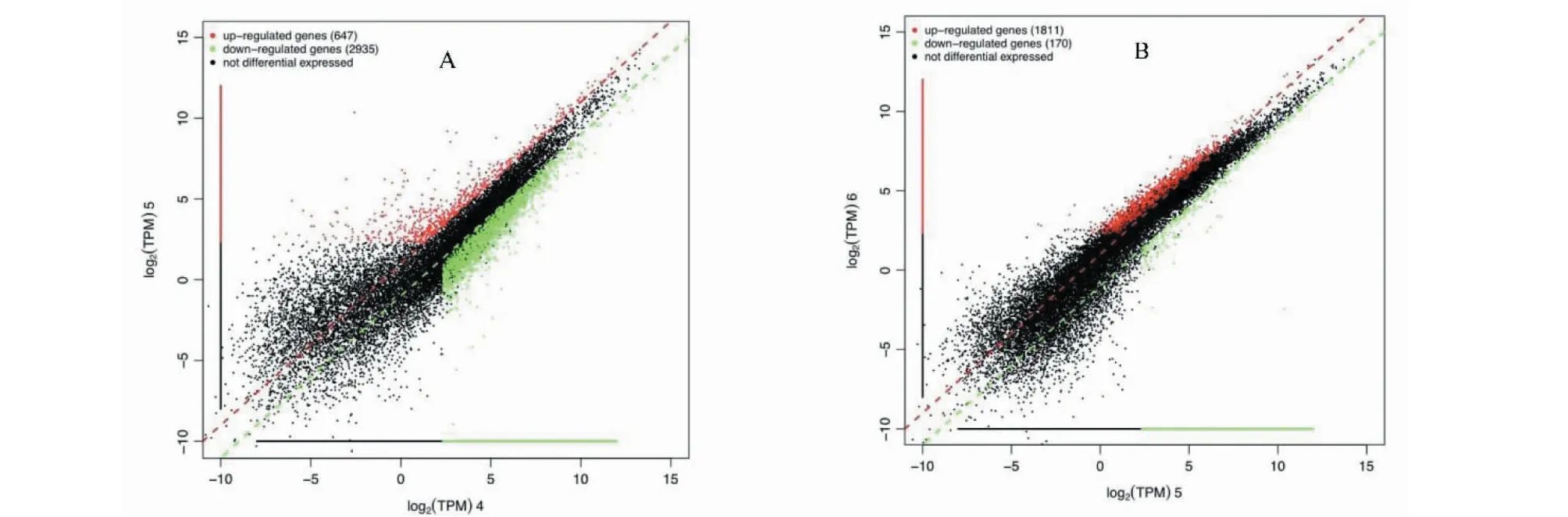
图1 细胞差异基因散点图Fig.1 Scatter plot of differentially expressed genes in cells注:A:Dox组vs正常组;B:Dox+Lut 组vs Dox 组。Note:A:Dox group vs normal group;B:Dox+Lut group vs Dox group.
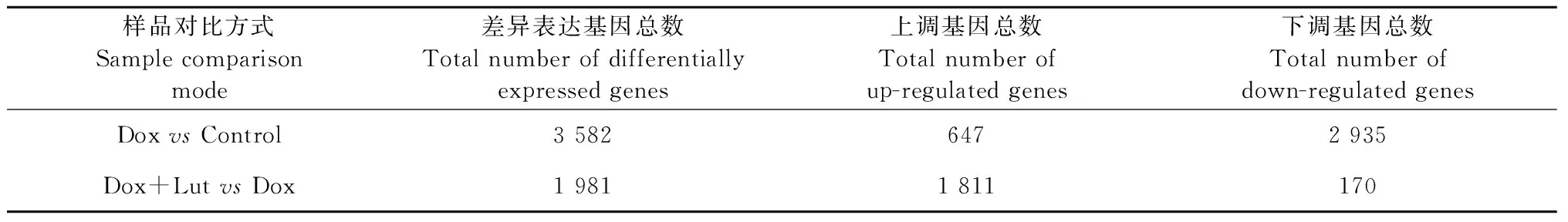
表2 细胞差异表达基因Table 2 Differentially expressed genes in cells

图2 细胞交集基因韦恩图Fig.2 Venn diagram of intersection gene
3.3 低表达MIEF1的H9c2细胞的验证
MIEF1-siRNA转染H9c2细胞24 h后,Western blot 检测细胞MIEF1蛋白表达水平。MIEF1siRNA转染后,与野生型及空载体siRNA细胞相比,siRNA-MIEF1 1号细胞MIEF1蛋白的表达水平降低最为明显,转染效率最高(P<0.05)。RT-PCR实验证明,与正常组细胞相比,siRNA-MIEF1 1号转染后的细胞MIEF1 mRNA水平明显降低(P<0.05)。说明低表达MIEF1的H9c2细胞构建成功(见表3、表4、图3)。
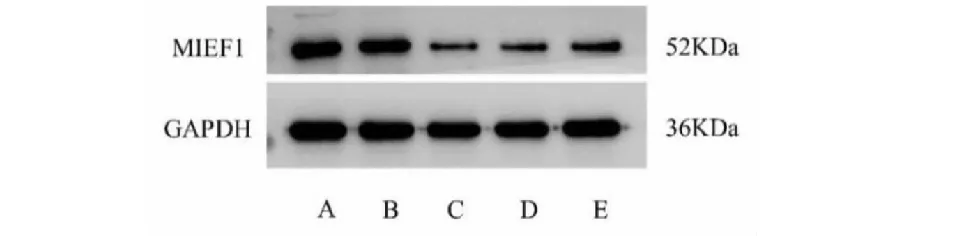
图3 转染后细胞中MIEF1蛋白表达电泳Fig.3 Electrophoresis of MIEF1 protein expression after transfection注:A:正常组;B:siRNA-空白;C:siRNA-MIEF1#1;D:siRNA-MIEF1#2;E:siRNA-MIEF1#3。Note:A:Normal group;B:siRNA-control;C:siRNA-MIEF1#1;D:siRNA-MIEF1#2;E:siRNA-MIEF1#3.
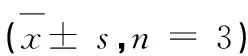
表3 转染后细胞中MIEF1蛋白表达
注:与正常组比较,*P<0.05。
Note:Compared with the normal group,*P<0.05.
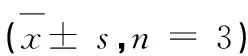
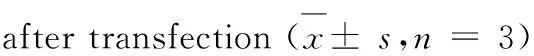

组别 GroupmRNA表达量mRNA expression正常NormalsiRNA- MIEF1#11.08±0.080.51±0.02*
注:与正常组比较,*P<0.05。
Note:Compared with the normal group,*P<0.05.
3.4 Lut对H9c2细胞MIEF1、p-Drp1(Ser637)、Caspase-3蛋白影响
与Dox组相比,siRNA+Dox组MIEF1、p-Drp1(Ser637)蛋白水平降低(P< 0.05),Caspase-3蛋白的表达水平增加(P< 0.05)。Lut+ siRNA+Dox组与siRNA+Dox组相比,MIEF1、p-Drp1(Ser637)蛋白水平上升(P< 0.05),Caspase-3蛋白的表达水平降低(P< 0.05)(见表5和图4)。
4 讨论
阿霉素(doxorubicin,Dox)又称多柔比星,属蒽环类抗生素,被应用于多种恶性肿瘤的治疗,但因其出现剂量依赖性心脏毒性,限制了其临床应用。蒽环类药物致心脏损伤的确切机制目前尚不清楚[11,12],因此寻找阿霉素心脏毒性的分子靶标,研发有效的抗阿霉素心脏毒性的药物尤为重要。

图4 细胞中MIEF1、p-Drp1(Ser637)、Caspase-3蛋白表达电泳Fig.4 Electrophoresis of MIEF1,p-Drp1(Ser637),Caspase-3 protein expression in cells注:A:正常组; B:siRNA+Dox组; C:Dox组;D:Lut+siRNA+Dox组。Note:A:Normal group;B:siRNA+Dox group;C:Dox group;D:Lut+siRNA+Dox group.
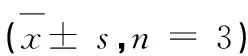
表5 Lut对H9c2细胞MIEF1、p-Drp1(Ser637)、Caspase-3蛋白影响Table 5 Effect of Luteolin on MIEF1,p-Drp1(Ser637),Caspase-3 protein expression in H9c2 cells ± s,n = 3)
注:与Dox组比较,*P<0.05;与siRNA+Dox组比,#P<0.05。
Note:Compared with the Dox group,*P<0.05;Compared with the siRNA+Dox group,#P<0.05.
目前,越来越多的学者发现,中药复方及所含活性成分能有效保护蒽环类药物对心脏的损伤[13,14]。线粒体是细胞的“能量工厂”,在所有细胞中心肌细胞是含线粒体最多的细胞。线粒体形态和功能对于维持正常的心脏生理功能至关重要[15]。研究表明,线粒体是一个动态变化的细胞器,其通过不断地融合与分裂以维持自身稳态。当心肌细胞线粒体融合或分裂过程失衡时,则会引起自身形态及功能紊乱,进而导致心脏功能损害[16]。研究报道,在细胞凋亡早期,线粒体出现了断裂以及嵴重构,线粒体融合、分裂调控蛋白也积极参与了细胞凋亡过程。同时,Tang等[17]研究发现,阿霉素可导致心肌细胞线粒体过度分裂从而导致细胞发生凋亡。MIEF1,又称MiD51,是一种参与调控线粒体融合分裂的重要分子,位于线粒体外膜上[18],其作用是通过招募下游动力相关蛋白1(Drp1)到线粒体上,使得Drp1在Ser637位点发生磷酸化[19],从而抑制细胞线粒体过度分裂,减少细胞凋亡[20]。研究报道,在利用CRISPR/cas9技术敲除MIEF1的293T细胞中,线粒体过度分裂,细胞线粒体功能遭到破坏[21]。由此可见,MIEF1在调控线粒体融合分裂方面发挥了举足轻重的作用。
本研究发现,Lut作用阿霉素诱导的心肌细胞后,细胞活力得到明显提升。转录组学结果提示,阿霉素作用细胞后,MIEF1表达水平明显下调,而经过Lut干预后,MIEF1水平又得到了恢复提升,因此确定MIEF1可能是木犀草素发挥抗心脏毒性作用的潜在靶点。利用分子生物学技术降低MIEF1蛋白及mRNA水平,通过Western blot 检测下游p-Drp1(Ser637)及细胞凋亡经典通路蛋白Caspase-3水平后发现,1 μM阿霉素作用心肌细胞时,与正常组相比,并未引起Caspase-3及其他蛋白显著的变化。而Lut能够提高低表达MIEF1细胞线粒体MIEF1蛋白的表达,促进Drp1蛋白在Ser637位点的磷酸化,进而阻止线粒体的过度分裂,抑制线粒体Caspase-3凋亡信号通路的激活。以上实验阐释了木犀草素心肌保护的部分作用机制,但其在降低线粒体过度分裂的过程中是否有其他信号途径参与,有待进一步研究。
