HBV cccDNA、 HBsAg、HBV pgRNA联合检测对恩替卡韦治疗HBeAg阳性慢性乙型肝炎效果的预测价值
2020-06-17秦建忠
王 颖, 赵 奎, 秦建忠
苏州大学附属第二医院 普外科, 江苏 苏州 215000
Value of combined measurement of hepatitis B virus covalently closed circular DNA, HBsAg, and hepatitis B virus pregenomic RNA in predicting the treatment outcome of HBeAg-positive chronic hepatitis B patients treated with entecavir
WANGYing,ZHAOKui,QINJianzhong.
(DepartmentofGeneralSurgery,TheSecondAffiliatedHospitalofSoochowUniversity,Suzhou,Jiangsu215000,China)
Abstract:ObjectiveTo investigate value of combined measurement of serum hepatitis B virus (HBV) covalently closed circular DNA (cccDNA), HBsAg, and HBV pregenomic RNA (pgRNA) in predicting the treatment outcome of HBeAg-positive chronic hepatitis B (CHB) patients treated with entecavir (ETV).MethodsA total of 87 HBeAg-positive CHB patients who were diagnosed and treated in The Second Affiliated Hospital of Suzhou University from May 2015 to May 2017 were enrolled. All patients were treated with ETV for 48 weeks, and the serum levels of HBV cccDNA, HBsAg, and HBV pgRNA were measured at baseline and at weeks 12, 24, and 48 of treatment. Thet-test was used for comparison of normally distributed continuous data between groups, and the Mann-WhitneyUtest was used for comparison of non-normally distributed continuous data between groups. The chi-square test was used for comparison of categorical data between groups, and the Mann-WhitneyUtest was used for comparison of ranked data between groups. A Pearson correlation analysis was performed to determine the correlation of liver HBV cccDNA with serum HBsAg and HBV pgRNA. A multivariate logistic regression analysis was used to investigate the predictive factors for complete response, and the receiver operating characteristic (ROC) curve was used to evaluate the value of serum HBV cccDNA, HBsAg, and HBV pgRNA measured alone or in combination in predicting complete response.ResultsOf all 87 HBeAg-positive CHB patients after 48 weeks of ETV treatment, 38 achieved complete response and 49 did not achieve complete response. Compared with the non-complete response group, the complete response group had significant reductions in the levels of HBV cccDNA at baseline and at weeks 24 and 48 of treatment (Z=-2.452, -2.518, and -2.266, allP<0.001), HBsAg at baseline and at weeks 12, 24, and 48 of treatment (Z=-2.431, -2.750, -2.386, and -2.536, allP<0.001), and HBV pgRNA at weeks 12, 24, and 48 of treatment (Z=-2.674, -2.503, and -2.528, allP<0.001). Compared with the non-complete response group, the complete response group had significantly greater reductions in HBV cccDNA at week 24 of treatment, HBsAg at week 12 of treatment, and HBV pgRNA at week 12 of treatment (Z=-2.352, -2.566, and -2.389,P=0.006, 0.001, and 0.004). Serum HBsAg and HBV pgRNA were positively correlated with HBV cccDNA in liver tissue (r=0.553 and 0.757, bothP<0.001). The levels of HBV cccDNA at week 24 of treatment (odds ratio [OR]=6.248, 95% confidence interval [CI]: 1.574-14.262,P<0.05), HBsAg at week 12 of treatment (OR=5.452, 95% CI: 2.048-16.888,P<0.05), and HBV pgRNA at week 12 of treatment (OR=5.670, 95% CI: 1.201-16.183,P<0.05) were predictive factors for complete response. As for the area under the ROC curve (AUC), HBV cccDNA, HBsAg, or HBV pgRNA measured alone had a significantly lower AUC than the combined measurement of the three indices (0.845/0.741/0.773 vs 0.913, allP<0.001), and the patients with a value of <9.7 could achieve complete response at week 48 of treatment.ConclusionCombined measurement of serum HBV cccDNA, HBsAg, and HBV pgRNA has a good value in predicting the treatment outcome of HBeAg-positive CHB patients treated with ETV.
Keywords:hepatitis B, chronic; DNA, circular; HBV pgRNA; entecavir
慢性乙型肝炎(CHB)是由HBV持续感染所引起的慢性肝脏炎症性疾病,可导致肝硬化乃至肝癌的发生,具有较高的致死率,近年来CHB的发病率呈现出高速增长之势,现已成为世界性的卫生难题。目前临床主要采取干扰素类(IFN)和核苷酸类药物(NAs)抗病毒治疗,在NAs中,恩替韦卡(ETV)以抑制HBV DNA作用强、耐药基因屏障高以及不良反应少等优势,被推荐为一线首选用药[1]。但近年来ETV也暴露出了治疗早期应答率低、疗程长等问题[2],因此如何对其疗效精准预测成为学术界研究的重点课题。最新研究[3]提出以HBV共价闭合环状DNA(HBV cccDNA)消失或静默为基础,以HBV RNA持续阴性和低HBsAg水平为标准的“准临床治愈”,可作为抗病毒治疗的新阶段终点,对指导CHB患者安全用药、停药及疗效预测等方面可能有重要意义。本文将通过前瞻性研究,重点探讨血清HBV cccDNA、HBsAg、HBV前基因组RNA(HBV pgRNA)联合检测对ETV治疗HBeAg阳性CHB患者疗效的预测价值。
1 资料与方法
1.1 研究对象 选取2015年5月-2017年5月在本院确诊为HBeAg阳性CHB患者。诊断标准参考我国《慢性乙型肝炎防治指南(2015年更新版)》[4]。纳入标准:(1)HBsAg、HBeAg均呈阳性,其中HBsAg阳性维持6个月以上;(2)血清HBV DNA定量检测>2×104IU/ml;(3)血清ALT水平超过正常值上限2~10倍。排除标准:(1)处于妊娠期或哺乳期女性;(2)合并自身免疫性、药物性及酒精性肝病或脂肪性肝炎、肝癌者;(3)合并其他病毒免疫缺陷感染疾病以及心肝肾等器官功能严重受损者;(4)入组前半年内接受过抗病毒、抗肝炎及免疫调节等治疗者;(5)ETV严重过敏史者。所有患者均自愿参加并签署知情同意书,本研究经苏州大学附属第二医院伦理委员会审核批准(批号:JD-LK-2017-052-01)。
1.2 试验方案 患者均采取口服ETV(生产厂家:正大天晴药业有限股份公司,国药准字:H20100019,规格:0.5 mg/片), 0.5 mg/d,疗程48周。治疗期间每隔12周对患者血清HBV cccDNA、HBV pgRNA、HBsAg的动态变化水平进行检测。并于治疗后检测血清HBV DNA、ALT及HBeAg的水平,据此评定患者疗效。
1.3 检测方法 (1)HBV cccDNA检测:肝组织中采取DNA聚合酶消化加滚环扩增加跨缺口实时荧光定量PCR法,血清中采取PCR荧光探针法,QIA amp DNA提取试剂盒购自德国凯杰公司,DNA聚合酶购自美国Epicentre公司,滚环扩增试剂盒购自上海雅吉生物科技有限公司,Eco-48型PCR试剂盒由科尔默帕(上海)仪器有限公司提供。(2)HBV DNA检测:采用荧光定量PCR法,检测所用ABI 7900 Real-time荧光定量PCR仪购自美国ABI公司。(3)HBeAg与HBsAg检测:采用电化学发光免疫分析法,检测所用abbott i2000全自动免疫发光分析仪购自美国雅培公司。(4)HBV paRNA检测:采用Taqman探针法,检测所用Real-time PCR Easy TM-Taqman试剂购自上海祈明生物科技有限公司。(5)ALT检测:采用ELISA法,检测所用全自动分析仪购自西门子公司。
1.4 疗效指标 病毒学应答:HBV DNA载量较基线下降≥2 log10IU/ml或<500 IU/ml的检测下限;生化学应答:ALT水平降至40 U/L的正常水平;血清学应答:HBeAg阴转,并未伴随抗-HBe的出现;完全应答:HBV DNA载量大幅降低(≥2 log10IU/ml)或低于检测下限(<500 IU/ml),ALT水平恢复正常(≤40 U/L),HBeAg阴转,抗-HBe阳性。

2 结果
2.1 一般资料 研究纳入患者共计87例,其中男50例,女37例,年龄22~62岁,平均(36.82±8.21)岁,治疗及随访期间未出现脱落病例。48周疗程结束后获得完全应答患者38例(获得组),未获得49例(未获得组),2组患者性别、年龄以及基线血清HBV DNA、ALT的水平比较差异均无统计学意义(P值均>0.05),完全应答获得组患者血清HBeAg水平明显低于未获得组(P<0.05)(表1)。

表1 2组患者临床资料比较
2.2 血清HBV cccDNA、HBsAg与HBV pgRNA的动态变化水平分析 完全应答获得组患者基线、治疗24周、48周时的HBV cccDNA水平明显低于未获得组(Z值分别为-2.452、-2.518、-2.266,P值均<0.001),2组患者治疗12周时的HBV cccDNA水平比较差异无统计学意义(P>0.05);并且完全应答获得组在治疗24周时的HBV cccDNA下降水平明显大于未获得组(Z=-2.352,P=0.006),两组患者在治疗12、48周时的HBV cccDNA下降水平比较差异均无统计学意义(P值均>0.05)(图1a)。
完全应答获得组患者基线,治疗12、24及48周时的HBsAg水平明显低于未获得组(Z值分别为-2.431、-2.750、2.386、2.536,P值均<0.001);并且获得组在治疗12周时的HBsAg下降水平明显高于未获得组(Z=-2.566,P=0.001),2组患者在治疗24、48周时的下降水平比较差异无统计学意义(P值均>0.05)(图1b)。
完全应答获得组患者治疗12、24、48周时的HBV pgRNA水平明显低于未获得组(Z值分别为-2.674、-2.503、-2.528,P值均<0.001),2组患者基线HBV pgRNA水平比较差异无统计学意义(P>0.05),并且完全应答组患者在治疗12周的HBV pgRNA下降水平明显高于未获得组(Z=-2.389,P=0.004),2组患者在治疗24、48周时的下降水平比较差异均无统计学意义(P值均>0.05)(图1c)。

图1 完全应答获得组与未获得组患者血清HBsAg、HBV pgRNA与HBV cccDNA的动态变化
2.3 肝组织HBV cccDNA与血清HBsAg、HBV pgRNA间的关系 Pearson相关分析结果显示,肝组织HBV cccDNA与血清HBsAg、HBV pgRNA均呈正相关(r值分别为0.553、0.757,P值均<0.001)(图2)。
2.4 患者治疗48周时实现完全应答的预测因素分析 收集影响完全应答的潜在因素,进行赋值,采取多因素logistic回归分析。结果显示,治疗12周HBsAg、治疗12周HBV pgRNA、治疗24周HBV cccDNA水平可作为预测患者治疗48周时实现完全应答的独立影响因素(表2,3)。

图2肝组织HBVcccDNA与血清HBsAg、HBVpgRNA的相关性
2.5 HBV cccDNA、HBsAg、HBV pgRNA对48周时完全应答的预测价值分析 将多元logistics回归分析筛选出的治疗12周HBsAg、12周HBV pgRNA与24周HBV cccDNA处理为一个综合指标,设为Combined,表达式为-2.458+0.942HBsAg+1.013HBV pgRNA+1.546HBV cccDNA。比较ROC曲线下面积(AUC)。结果显示,Combined的AUC值(0.913)明显高于HBV cccDNA(0.845)、HBV pgRNA(0.773)、HBsAg(0.741)(Z值分别为-2.411、-2.673、-2.712,P值均<0.001),其诊断敏感度、特异度分别为94.7、87.4,cut-off值<9.7表示患者治疗48周时可获得完全应答(表4、图3)。

表2 多因素logistic回归分析赋值表

表3 患者治疗48周时实现完全应答的多因素logistic回归分析
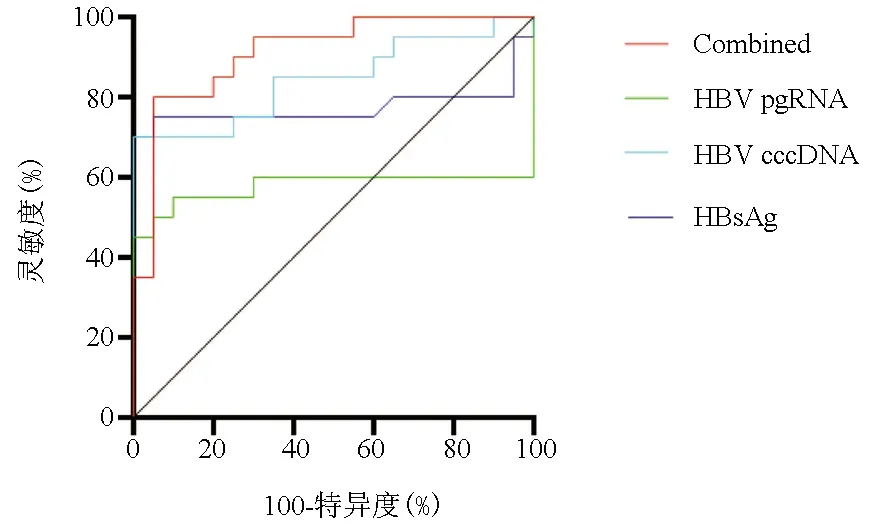
图3HBVcccDNA、HBsAg、HBVpgRNA诊断48周时完全应答的ROC曲线
3 讨论
荟萃分析[5]显示,经ETV治疗48周或96周后患者可获得较高的HBV DNA清除率与ALT正常化率,肝组织学指标(炎症活动度、纤维化程度)也有较为明显改善。因此既往对其疗效预测,临床常通过对血清HBV DNA定量,ALT、抗-HBe、HBeAg的监测以及肝活检进行[6]。但上述指标尚不能准确反应机体对HBV的免疫控制程度,预测价值有限。本研究在检测HBeAg阳性CHB患者的血清HBV DNA、ALT、HBeAg的基础上,探寻更具灵敏度、特异度的预测ETV疗效的指标及组合。
HBV cccDNA对HBV复制及感染状态的建立具有十分重要的意义,但现有的NAs或IFN药物均无法对其进行彻底清除,尤其是肝内cccDNA,只要其仍持续存在,在转录沉默状态激活后就极有可能使HBV再度复制活跃,导致感染慢性化[7],是CHB患者停药后高病毒反弹率和复发率的首要原因。因此众多指南提出将肝组织内检测不到HBV cccDNA作为抗病毒治疗的最佳终点[8],但尚缺乏公认的定量检测技术,仍需要找到其他替代指标反映肝内HBV cccDNA的清除水平。

表4 HBV cccDNA、HBsAg、HBV pgRNA单独及联合检测诊断48周时完全应答的ROC曲线分析
近年来临床已初步开展采用与肝内HBV cccDNA再激活复制感染过程中相关的血清学标志物预测抗病毒疗效及其维持效果的研究。有学者[9]发现,当肝组织处于炎症活动阶段以及肝细胞发生变性、坏死时,肝内cccDNA可释放入血,进一步分析发现肝内与血清中的HBV cccDNA水平具有较大的相关性。最新研究[10-11]指出,血清HBV cccDNA与ALT升高呈明显的负相关,且较ALT变化有所提前,也与HBV DNA有很好的相关性,是HBV持续感染的根源之一,鉴于其生物学特性,对抗病毒疗效可能有较大的预测价值。HBsAg是以cccDNA为模板生成的HBV外壳蛋白,研究[12]发现在NAs治疗下,血清HBsAg能较好地体现肝内HBV cccDNA的下降水平和转录活性。目前大量研究[13-14]表明,血清HBsAg清除/转换常伴随持久HBV DNA清除的发生,其治疗前后的定量水平及变化是HBeAg、HBsAg消失的强效预测因子。一项关于NAs初治HBeAg阳性患者停药后的研究[15]也显示,HBeAg清除后,低基线水平HBsAg(<2500 IU/ml)并且较基线快速下降(>3 log10IU/ml)的患者停药后可获得持久完全应答,终末期肝病的发生率及复发率大幅降低。HBV pgRNA是只能由cccDNA直接转录生成的HBV复制中间产物,常以衣壳化病毒颗粒形式存在于血清,在NAs停药时,可反映肝内HBV cccDNA的残留及转录[16-17]。并且HBV pgRNA也是一种新型HBV血清学标志物,Carey等[18]研究表明,在抗病毒治疗过程中HBV pgRNA下降能够较敏感地反应病毒复制情况,可用于预测HBeAg阳性患者的血清学应答,对筛选出NAs治疗最受益的患者以及预测病情严重性急性进展具有很大的潜在价值。
本研究结果显示,采用ETV治疗48周后,获得完全应答患者38例,未获得49例,治疗应答率(43.68%)在国内抗病毒药物中较高,与其能强效地抑制HBV复制以及不易发生耐药突变有关[19]。但关于ETV的疗效预测还急待改进,本文采取血清HBV cccDNA、HBsAg、HBV pgRNA联合检测进行研究,结果显示完全应答获得组基线与治疗12、24、48周时的HBsAg水平以及除12周外的HBV cccDNA水平和除基线外的HBV pgRNA水平均明显低于未获得组,且总体看来完全应答获得组患者各指标在治疗24周前的水平较未获得组下降更为明显,提示治疗早期血清HBV cccDNA、HBsAg、HBV pgRNA水平快速下降的患者更有可能实现完全应答,对临床进行停药或更换其他抗病毒药治疗等个体化处理具有较大的指导意义。进一步logistics回归分析显示,治疗12周HBsAg、治疗12周HBV pgRNA与治疗24周HBV cccDNA的水平可作为48周时患者获得完全应答的预测指标。在此基础上行ROC曲线分析结果显示,血清HBV cccDNA、HBsAg、HBV pgRNA联合检测的AUC值明显高于各单项指标检测,笔者分析认为,由于肝内HBV cccDNA的形成极为复杂,同时在HBV复制周期中,以其为模版涉及到多种前基因组RNA及不同长度mRNA的转录,进而翻译生成病毒的大部分组成蛋白,因此临床尚未找到一种可完全替代其预测抗病毒疗效价值的指标。而本研究所选取的血清HBV cccDNA、HBsAg、HBV pgRNA均与肝内HBV cccDNA具有良好的相关性,三者联合检测可以更为全面地体现肝内HBV cccDNA在ETV治疗过程中的清除水平及转录再激活状态,另外三者对预测病毒学应答、血清学应答及生化学应答有各自突出的优势,故联合检测可更为准确地反映出患者获得完全应答的情况。
综上所述,血清HBV cccDNA、HBsAg、HBV pgRNA联合检测对预测HBeAg阳性CHB患者的ETV疗效具有较大价值。但考虑到本研究纳入样本过少,同时也未开展长时间的随访监测,相关结论还有待进一步扩大研究论证。
