DPP-4抑制剂联合格列美脲对2型糖尿病患者血清炎性因子及胰岛β细胞功能的影响
2020-06-17翁小珍杭州市临安区中医院药房杭州311300
翁小珍(杭州市临安区中医院药房 杭州 311300)
2型糖尿病是一种慢性终身疾病,病机较为复杂,主要以胰岛素的绝对减少及胰岛素的相对不足为表现[1]。格列美脲是第三代磺酰脲类抗糖尿病药,不仅具有常规降糖作用,还可调节胰岛分泌,适用于2型糖尿病,但单独使用格列美脲疗效欠佳,常需联合其他降糖药提高疗效[2]。格列汀是一种高效DPP-4抑制剂,可有效抑制肝脏葡萄糖合成,并能延长胰升血糖素样肽-1(GLP-1)活性,使胰升血糖素分泌减少及胰岛素分泌增加,进而发挥高效控制血糖的作用[3]。然而国内尚缺乏足量DPP-4抑制剂联合格列美脲治疗T2DM报道,笔者进行临床对照性研究,就这一临床课题进行初步观察,旨在为临床诊断治疗提供依据。
1 资料与方法
1.1 一般资料:选取我院2019年1—4月收治的2型糖尿病患者202例,均符合2010年美国糖尿病协会(ADA)糖尿病诊断标准[4]。纳入标准:①血浆糖化血红蛋白(HbA1c)>6.5%,空腹血糖(FPG)>7.0 mmol/L;②近3个月未接受过糖皮质激素类药物治疗;③无合并严重糖代谢紊乱、凝血功能异常;④了解此次研究并同意配合。排除标准:①处于妊娠期或哺乳期;②合并严重精神系统疾病或恶性肿瘤;③存在严重感染或是应激;④对本研究药物过敏或伴有影响药物吸收疾病;⑤伴有急、慢性炎症性疾病。根据随机数表法分为研究组和对照组,各101例。对照组男性56例,女性45例;年龄 31~78岁,平均年龄(46.71±7.32)岁;病程1个月~7年,平均病程(22.18±13.46)个月。研究组男性53例,女性 48例;年龄 33~75岁,平均年龄(45.87±7.20)岁;病程 2个月~7年,平均病程(23.06±13.58)个月。两组一般资料差异无统计学意义(P>0.05),有可比性。
1.2 治疗方法:对照组于早餐前30 min口服格列美脲片(赛诺菲北京制药有限公司,国药准字H20057672,2 mg/片)治疗,剂量为2 mg/次/d,根据血糖波动情况进行调节剂量,最大为6 mg/次/d。在此基础上,研究组接受DPP-4抑制剂西格列汀(杭州默沙东制药有限公司,国药准字J20140095,0.1 g/片)治疗,口服剂量为50 mg/次,1次/d。两组治疗时间均为3个月,期间予健康教育、饮食控制及运动指导等。
1.3 观察指标:①分别于治疗前后空腹8 h以上,于次日晨采集空腹静脉血及餐后2 h静脉血,采用高效液相色谱法测定(HbA1c),采用葡萄糖氧化酶法测定餐后2 h血糖(2 hPG)、FPG。②于治疗前后采用酶免疫磁分离法测定FC-P,同时考虑部分患者曾接受过胰岛素治疗,其血清胰岛素值可能受外源性胰岛素影响,故采用FC-P代替空腹胰岛素改良公式[5],HOMA-β=0.27×FC-P/(FPG-3.5)+50,HOMA-IR=1.5+FPG×FC-P/2800。③于治疗前后抽取晨起空腹外周静脉血2 mL,抗凝处理后低速离心(速度:3 500 r/mim;半径:8 cm),留取上层血清,采用免疫放射分析法测定白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)水平,试剂盒均由上海西唐生物有限公司提供。
1.4 统计学方法:采用SPSS22.0软件分析,计量资料以(±s)表示,采用 t检验;计数资料以(%)表示,采用 χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组血糖指标比较:治疗前两组HbA1c、FPG、2 hPG比较无显著差异(P>0.05);治疗后两组 HbA1c、FPG、2 hPG 均出现显著降低,且研究组较对照组更低(P<0.01)。见表1。
2.2 两组胰岛β细胞功能指标比较:治疗前两组FC-P、HOMA-β、HOMA-IR 比较无显著差异(P>0.05);经治疗,两组 FC-P、HOMA-β均出现显著升高,且研究组较对照组更高(P<0.01);两组HOMA-IR均出现显著降低,且研究组较对照组更低(P<0.01)。见表2。
表1 两组血糖指标比较(±s)
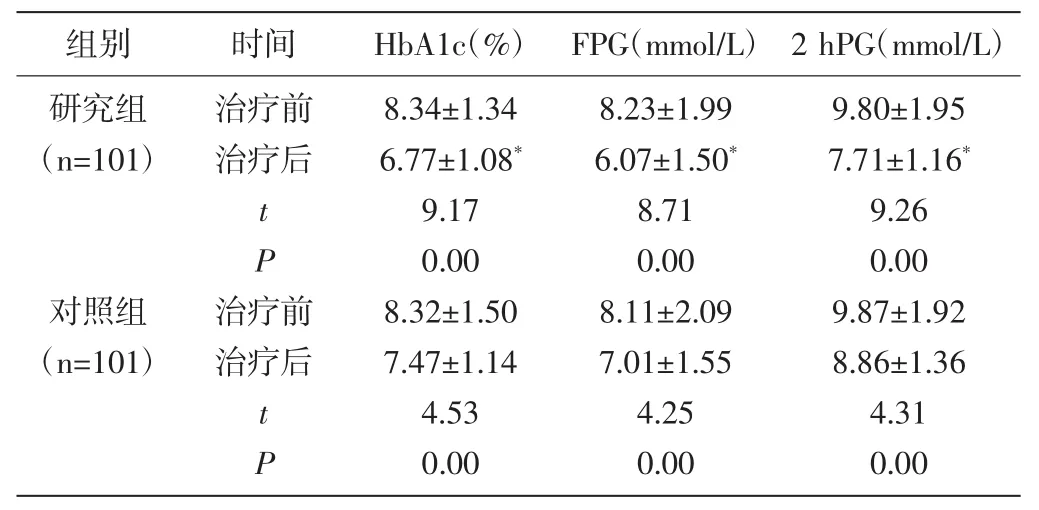
表1 两组血糖指标比较(±s)
注:与对照组比较,*P<0.01。
组别 时间 HbA1c(%) FPG(mmol/L) 2 hPG(mmol/L)研究组(n=101)治疗前治疗后tP对照组(n=101)治疗前治疗后tP 8.34±1.34 6.77±1.08*9.17 0.00 8.32±1.50 7.47±1.14 4.53 0.00 8.23±1.99 6.07±1.50*8.71 0.00 8.11±2.09 7.01±1.55 4.25 0.00 9.80±1.95 7.71±1.16*9.26 0.00 9.87±1.92 8.86±1.36 4.31 0.00
表2 两组胰岛β细胞功能指标比较(±s)
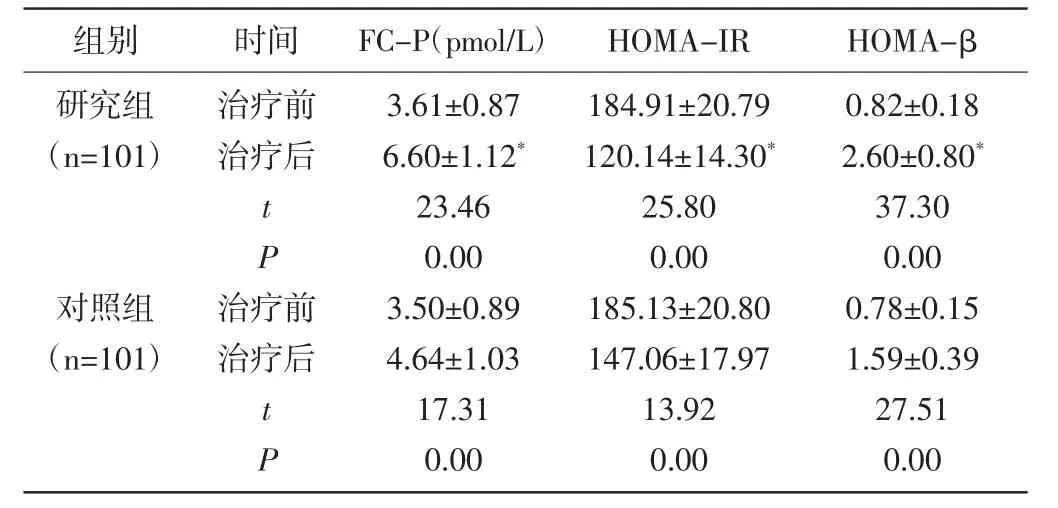
表2 两组胰岛β细胞功能指标比较(±s)
注:与对照组比较,*P<0.01。
组别 时间 FC-P(pmol/L) HOMA-IR HOMA-β研究组(n=101)治疗前治疗后tP对照组(n=101)治疗前治疗后tP 3.61±0.87 6.60±1.12*23.46 0.00 3.50±0.89 4.64±1.03 17.31 0.00 184.91±20.79 120.14±14.30*25.80 0.00 185.13±20.80 147.06±17.97 13.92 0.00 0.82±0.18 2.60±0.80*37.30 0.00 0.78±0.15 1.59±0.39 27.51 0.00
2.3 两组血清炎性因子比较:治疗前两组IL-6、TNF-α比较无显著差异(P>0.05);经治疗,两组 IL-6、TNF-α 均出现显著降低,且研究组较对照组更低(P<0.01)。见表3。
表3 两组血清炎性因子比较(±s)
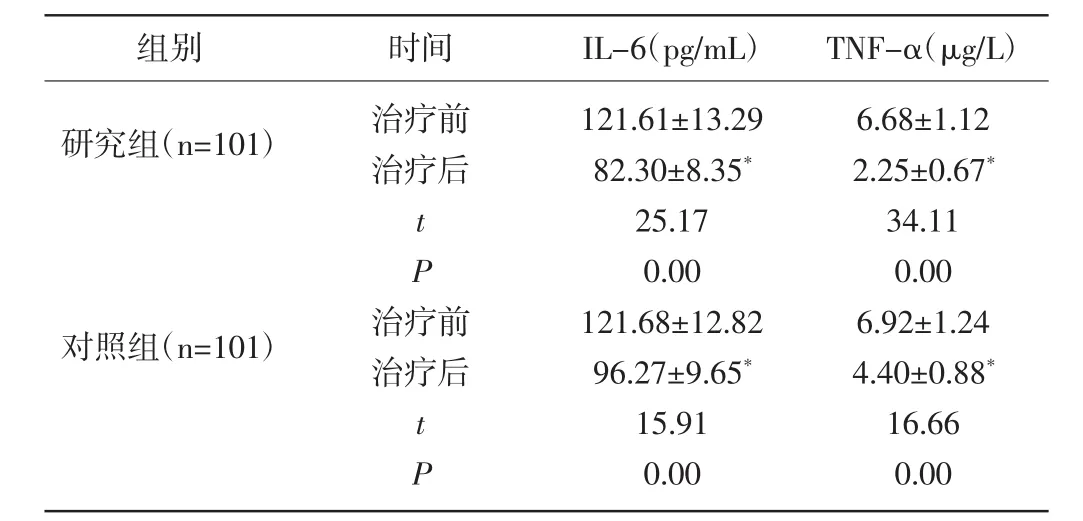
表3 两组血清炎性因子比较(±s)
注:与对照组比较,*P<0.01。
组别 时间 IL-6(pg/mL) TNF-α(μg/L)研究组(n=101) 治疗前治疗后tP对照组(n=101)治疗前治疗后tP 121.61±13.29 82.30±8.35*25.17 0.00 121.68±12.82 96.27±9.65*15.91 0.00 6.68±1.12 2.25±0.67*34.11 0.00 6.92±1.24 4.40±0.88*16.66 0.00
3 讨论
目前,临床上尚未出现能够彻底治愈2型糖尿病的手段,且随着饮食结构的改变及人口老年化的加剧,该病患病率呈现明显上升之势,格列美脲为磺酰脲类长效抗糖尿病药,作用机制是通过促使腺苷三磷酸(ATP)敏感钾离子通道与胰腺β-细胞表面磺酰脲受体耦连,令电压依赖性钙通道开放,钙离子内流从而促进胰岛素释放。除此之外,该药亦能够通过非胰岛素依赖途径增加心脏对葡萄糖摄取,发挥降低血糖作用[6]。但临床实践证实,长期服用格列美脲可能发生过敏性反应、代谢和营养紊乱、血液系统紊乱等症状。
既往对T2DM的治疗多侧重于严格控制血糖,但近年来研究发现,在T2DM的早期,胰岛β细胞处于葡萄糖失敏感性阶段,受损是可逆的[7],应在单纯降糖治疗基础上加强胰岛β细胞功能的保护,避免病情进展。亦有研究指出,机体血糖升高时,肠道能够分泌GLP-1和糖依赖性胰岛素释放肽(GIP)等肠促胰岛激素,可促进胰岛β细胞分泌胰岛素,起到平稳降血糖的作用。DPP-4抑制剂是一种新型口服降糖药,可通过与DPP-4结合形成DPP-4复合物抑制DPP-4的活性,促使活性形式的GLP-1和GIP血浆浓度的增加,同时,该药还可直接增加细胞环磷酸腺苷,激活ERKl/2信号,从而刺激GLP-1分泌。此外,DPP-4抑制剂在促进胰岛β细胞以葡萄糖依赖的方式分泌胰岛素的同时,还可对胰岛α细胞的功能紊乱进行调控,使胰升血糖素分泌减少,发挥对机体血糖的双向调节作用[8]。本研究结果显示,研究组经治疗HbA1c、FPG、2hPG、HOMA-IR均较对照组更高(P<0.01),而 FC-P、HOMA-β 则较对照组更低(P<0.01),提示DPP-4抑制剂联合格列美脲能够产生疗效协同效应,可有效降低血糖及HbA1c水平,并改善胰岛β细胞功能,我们考虑这可能与二者在治疗机制上互补,使活性GLP-1水平最大化,进而刺激胰岛素分泌有关。
2型糖尿病患者多合并有肥胖、超重,而脂肪组织分泌的细胞因子,致使2型糖尿病患者长期处于一种低度慢性炎症状态,亦在糖尿病并发症的发生、发展过程中发挥重要的作用[9-10]。本次研究对两组治疗前后血清炎性因子水平进行检测发现,研究组治疗后的 IL-6、TNF-α 均较对照组更低(P<0.01),表明二者联合用药能够缓解T2DM患者的高炎症状态,我们考虑这可能与以下机制有关:在TLR4-MARK途径中,DPP-4抑制剂可通过抑制TLR4介导的细胞外信号调节激酶磷酸化,从而降低基质金属蛋白酶的表达,实现抑制促炎性细胞因子表达的目的。
综上所述,DPP-4抑制剂联合格列美脲能够有效降低2型糖尿病患者血糖水平,抑制体内炎症反应,且可改善胰岛β细胞功能。但本研究也存在一定的局限性,受样本数量限制,且人群分布差异等因素的影响,可能对本研究结果可信度造成一定影响,今后将重视在扩大样本数量基础上进行深入研究。
