钒钛磁铁尾矿土壤中水黄皮根瘤菌铁耐受性与钝化能力研究
2020-06-16秦诗洁王琼瑶崔永亮余秀梅
闫 敏, 秦诗洁, 王琼瑶, 沈 甜, 张 芳, 崔永亮, 许 凤, 袁 满, 余秀梅*
(1.四川农业大学 资源学院,四川 成都 611130;2.四川省自然资源科学研究院,四川 成都 610041)
攀枝花铁矿蕴藏量占全国总量的16%,尾矿铁含量为15%~23%,主要存在形式为化合态Fe3+[1]。大量堆积的铁尾矿不仅占用较多土地资源、污染农耕土壤,还破坏矿区生态环境。土壤中过量的铁会导致植株出叶减缓、叶绿素含量下降、植物干重减少,严重影响农作物产量和品质[2]。因此,如何有效控制铁尾矿区土壤铁污染已成为急需解决的问题。植物修复具有吸附率大、处理效率高、无二次污染等优点[3],在治理金属污染土壤中发挥着不可替代的作用,其目的是从土壤中提取金属并改善土壤肥力[4]。豆科植物作为金属污染地的先锋植物,利用豆科植物-根瘤菌共生体系的固氮作用来加速污染地氮素积累,进而促进污染地的营养元素循环和积累,已成为金属污染土壤修复的研究热点[5]。植物根际微生物可通过增加生物质产量和改变植物组织中的金属积累来提高植物修复效率,促进植物抗性[6-7]。豆科乔木植物水黄皮主根较长,侧根较密,对许多害虫具有较强耐受性[8],此外还具有很强的耐逆性、耐盐碱、耐旱、耐重金属并可在酸性、沙、石质等贫瘠环境生长,种子油可作为生物燃油原材料[9],为矿区生态修复和土地复垦的理想材料。根瘤菌与豆科植物共生固氮可为豆科植物生长代谢提供氮营养促进生长,并能提高逆境中豆科植物的抗逆性[10]。王俊娟等[11]以铁尾矿砂为基质种植苜蓿,接种不同根瘤菌不仅能提高苜蓿的株高、鲜重,还能改善铁尾矿砂基质的理化性质和土壤结构,使有机质、碱解氮、速效磷和速效钾含量显著提高。此外,部分根瘤菌分泌的有机酸、氨基酸等可使土壤酸化,提高土壤中铁的有效性,促进植物对铁的吸收[12]。在重金属等逆境环境下,根瘤菌可通过金属离子泵出、积累、络合及有毒金属向毒性较低形式转化的氧化还原等钝化作用降低重金属有效性,表现出不同程度的逆境生长能力[13-14],此外还可通过吸附或解吸机制保护植物免受镍和锌的毒害作用[15]。据研究报道,根瘤菌可通过吸附、胞外沉淀或结晶来抵抗Cu的毒性,也可通过能量介导的输出系统来降低Cu的毒性[16]。相关研究表明,水黄皮-根瘤菌共生体系能适应攀枝花钒钛磁铁矿区被金属污染土壤的环境,且能钝化尾矿土壤中的金属,但土壤中高浓度铁会影响共生体系的固氮作用和修复效率[8]。因此,本研究主要分析攀枝花钒钛磁铁尾矿土壤中水黄皮共生根瘤菌的铁耐受性,筛选出铁钝化能力强的土著根瘤菌用以强化水黄皮-根瘤菌共生体系,为水黄皮-根瘤菌联合修复钒钛磁铁尾矿土壤提供优势菌株资源。
1 材料与方法
1.1 材料
1.1.1 实验材料 利用5点取样法从攀枝花新九乡钒钛磁铁尾矿库采集钒钛磁铁尾矿土壤样品,装入无菌聚乙烯塑料袋中带回实验室立即开展水黄皮根瘤菌捕获实验。水黄皮种子采自海南省文昌县红树林。
1.1.2 培养基 ①YMA培养基:甘露醇5.0 g,酵母粉1.0 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,NaCl 0.1 g,CaCO33.0 g,琼脂粉18 g,蒸馏水1 L,pH 7.0;②TY液体培养基:蛋白胨10.0 g,NaCl 5.0 g,酵母膏5.0 g,葡萄糖1.0 g,蒸馏水1 L,pH 7.0;③牛肉膏培养基:牛肉膏5.0 g,蛋白胨10 g,NaCl 5.0 g,琼脂粉18 g,蒸馏水1 L,pH 7.2~7.4。
1.1.3 主要仪器与设备 立式高压蒸汽灭菌锅(LDZF-75L-Ⅲ,上海申安医疗器械厂);双层恒温摇床(HY150S,武汉汇诚生物技术有限公司); 分光光度计(V-1100D,上海美谱达仪器有限公司);离心机(Centrifuge5148R,艾本德中国有限公司);火焰光度计(FP6410,上海精科仪器有限公司);PCR仪、凝胶成像系统、聚丙烯酰胺凝胶电泳仪(Bio-Rad公司);ICP-AES(美国热电公司)。
1.2 方法
1.2.1 水黄皮共生根瘤菌的捕获与分离纯化 选取饱满成熟水黄皮种子播种,置于25 ℃温室进行预发芽。取幼苗栽种于装满尾矿土的灭菌白色塑料盆中,放置温室中培养90 d后,挑选出水黄皮根系粒大、红润的根瘤,将根瘤表面洗净后,在无菌工作台中用0.1% HgCl2溶液、75%酒精表面消毒后放入EP管中,挤破根瘤,用无菌玻璃棒沾取汁液接种于YMA培养基上划线培养单菌落,通过革兰染色和镜检初步筛选出根瘤菌,保存在YMA斜面(4 ℃)上和甘油管(-80 ℃)中。
1.2.2 水黄皮共生根瘤菌对Fe2+/ Fe3+的耐受性测定 将分离纯化得到的菌株接种于5 mL TY液体培养基,摇床培养24 h后吸取50 μL新鲜菌液接种于含不同浓度Fe2+/Fe3+的超纯水溶液(质量浓度梯度为0.2 g/L),28 ℃、150 r/min培养48 h后,用不接菌的TY培养液做参比测定OD600值以确定菌株的存活情况及生长状况,(OD600≥0.1视为可生长)。
1.2.3 水黄皮共生优势根瘤菌分子鉴定 水黄皮共生根瘤菌DNA提取采用GUTC(异硫氰酸胍)法[17],根瘤菌16S rRNA基因测序扩增引物[8]27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸2 min,35个循环;72 ℃最终延伸5 min,终止[18]。对扩增后的产物进行琼脂糖凝胶电泳检测,由深圳华大基因公司进行测序后,将测序结果在GenBank中进行BLAST相似性分析,用MEGA5.0构建系统进化树,明确根瘤菌在种属水平上的分类地位。
1.2.4 水黄皮共生根瘤菌对Fe2+/ Fe3+钝化效率测定 将耐受性较好的菌株接种于150 mL TY液体培养基中,28 ℃、150 r/min培养24 h,离心收集细胞,无菌水冲洗2次后分别加至不同质量浓度(200、400、800、1 600 mg/L)1.5 mL Fe2+/Fe3+溶液,摇匀后28 ℃、150 r/min培养6 h;将菌液离心后取上清液,用ICP-MS测定上清液中Fe2+/Fe3+浓度,并计算Fe2+/Fe3+钝化效率。计算公式:
式中,C1、C2分别为Fe2+/Fe3+的起始浓度和钝化后的浓度(mg/L),A为菌株在实验中对Fe2+/Fe3+的钝化效率(%)。
1.2.5 数据处理 采用Microsoft office 2016和 SPSS 20.0进行统计分析。
2 结果与分析
2.1 耐Fe2+/Fe3+水黄皮共生根瘤菌筛选
采用平板划线法从水黄皮共生根瘤中分离纯化根瘤菌,在挑选单菌落时,主要根据其菌落形态大小、颜色、形状等,挑选特征与根瘤菌相似的菌株纯化后经革兰染色及镜检(呈阴性),初步筛选出根瘤菌39株。如图1所示, 39株根瘤菌对200 mg/L Fe2+和Fe3+均具有抗逆性,所有菌株均能顺利存活;随着Fe2+和Fe3+浓度提高,菌株抗逆性逐渐减弱,存活率整体呈下降趋势,在400以及1 000 mg/L Fe2+/Fe3+质量浓度下,生长受到抑制的菌株数量跳跃式增加,尤其是Fe2+对根瘤菌的存活情况影响更为显著,400 mg/L Fe2+质量浓度条件下存活菌株减少为25株,1 000 mg/L Fe2+质量浓度条件下存活菌株仅剩10株。所有菌株在1 600 mg/L Fe2+/Fe3+质量浓度下存活率仅为10%(图2),根据Fe耐受性实验筛选出不同Fe2+/Fe3+浓度下抗逆性较好的菌株PZHS20、PZHS87以及PZHS90共3株。
2.2 根瘤菌的系统进化分析
根瘤菌抗逆优势菌株PZHS90、PZHS87、PZHS20的16S rRNA基因测序片段大小为1 143 bp,其在GenBank中分别与慢生根瘤菌属(Bradyrhizobium)、慢生根瘤菌属(Bradyrhizobium)、苍白杆菌属(Ochrobactrum)高度同源,其同源性高达100%。选取慢生根瘤菌属(Bradyrhizobium)、苍白杆菌属(Ochrobactrum)的不同种作为参比菌株,构建16S rRNA基因系统进化树,PZHS90、PZHS87、PZHS20分别鉴定为埃尔坎慢生根瘤菌(Bradyrhizobiumelkanii)、埃尔坎慢生根瘤菌(Bradyrhizobiumelkanii)、人苍白杆菌(Ochrobactrumanthropic)(图3)。

图1 根瘤菌在不同质量浓度Fe2+/Fe3+胁迫下的存活情况Fig.1 Survival of Rhizobium strains in the stress of different concentration Fe2+/Fe3+ “1”对应的图中黑色区域代表根瘤菌在相应Fe2+/Fe3+浓度下能正常生长,即与相同处理条件下不接菌的TY培养液体相比可明显观测到菌细胞,判断为该条件下菌株可以存活;“2”对应的白色区域则反之 The blake area in theFigure corresponding to "1" represents that the Rhizobium can grow normally under the corresponding Fe2+/Fe3+ concentration, it means the bacterial cells can be clearly observed compared with the TY culture liquid which is not inoculated under the same treatment conditions, and it is judged that the strain can survive under the condition; the white area corresponding to "2" is the opposite

图2 钒钛磁铁矿土中水黄皮共生根瘤菌对Fe2+/Fe3+耐受性Fig.2 Resistance of Pongamia pinnata symbiotic rhizobia in vanadium titanium magnetite soil to Fe2+/Fe3+
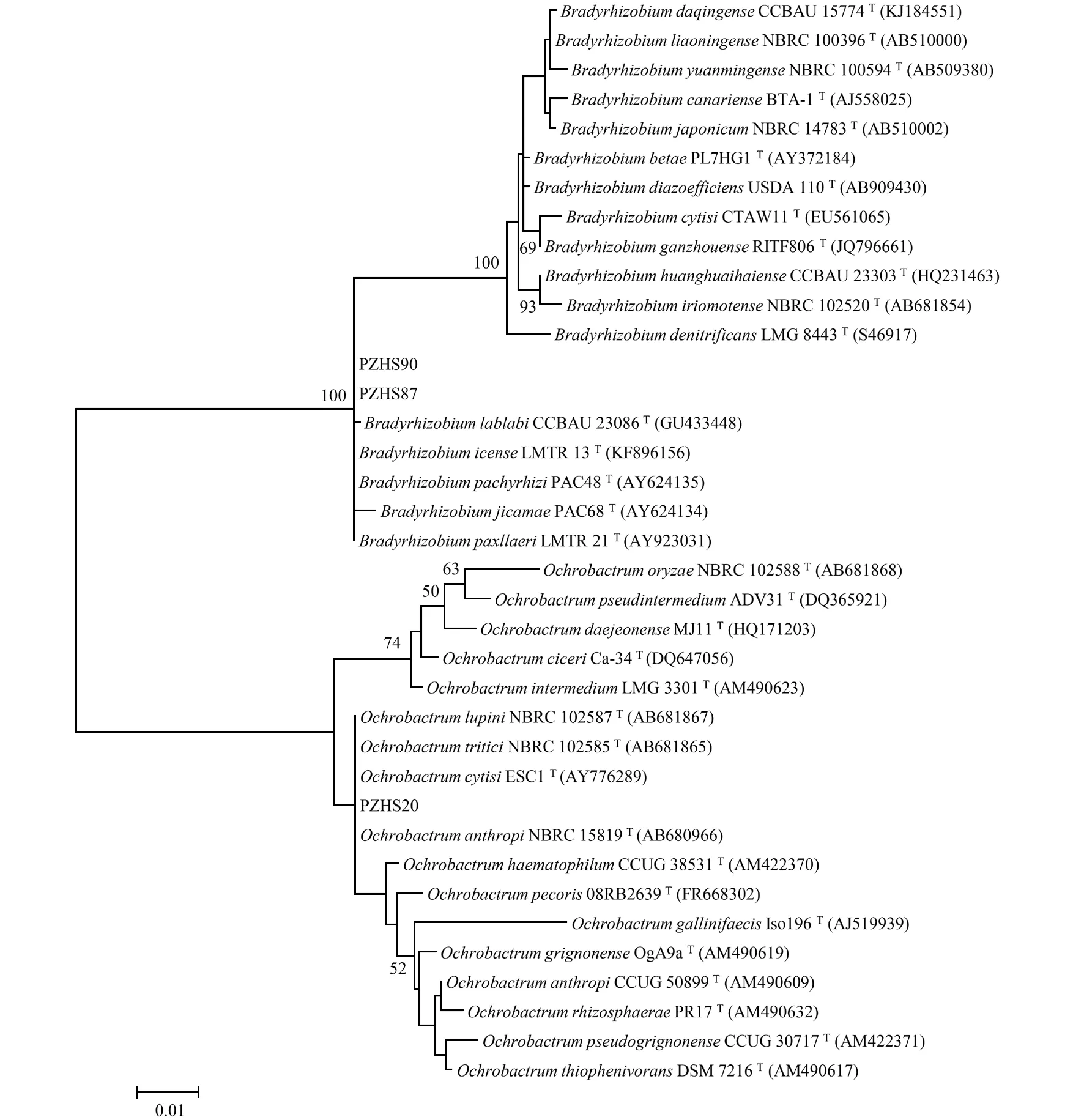
图3 耐Fe2+/Fe3+水黄皮根瘤菌16S rRNA基因的系统发育树Fig.3 Phylogenetic tree of the 16S rRNA gene of Rhizoctonia solani with tolerance to Fe2+/Fe3+
2.3 根瘤菌对Fe2+/Fe3+耐受性分析
不同Fe2+质量浓度下,各菌株在0~400 mg/L生长几乎未受影响,生长状况较好。随着Fe2+浓度增加,菌株生长均受到不同程度抑制,但3株菌株均能在1 600 mg/L Fe2+质量浓度中生长,其中以PZHS90耐受能力最强,细胞浓度约占200 mg/L的17.7%;1 000~1 200 mg/L质量浓度下PZHS90抑制作用最为明显,1 000 mg/L时PZHS90细胞浓度约为200 mg/L的62.8%,1 200 mg/L时菌株PZHS90细胞浓度仅为200 mg/L的27.4%,耐受能力下降幅度较大(图4)。



图4 不同Fe2+质量浓度下根瘤菌生长曲线Fig.4 Fe2+ Growth curve of rhizobia in different concentration of Fe2+ solution
不同小写字母表示差异显著性(P<0.05),下图同
The different lowercase letters indicate significant differences (P<0.05), the same below
在0~400 mg/L Fe3+质量浓度下,各菌株生长较为良好,受Fe3+影响较小,低浓度下耐受能力更强。随Fe3+浓度增加,菌株生长状况均出现较明显变化,其中以400~800 mg/L下耐受能力变化最为明显;3株菌株均能耐受1 600 mg/L Fe3+,1 800 mg/L时PZHS90不能生长,PZHS20、PZHS87均能生长,其中以PZHS20耐受能力最强,1 800 mg/L Fe3+细胞浓度约为200 mg/L的9.2%;PZHS20在400 mg/L下细胞浓度约为200 mg/L的92.1%,800 mg/L下细胞浓度约为200 mg/L的47.8%,菌株耐受能力降低幅度较大(图5)。
2.4 根瘤菌对Fe2+/Fe3+钝化能力测定
在不同Fe2+浓度下,各菌株的钝化能力整体呈现下降趋势,其中在800~1 600 mg/L Fe2+质量浓度范围内,菌株钝化能力下降更为明显。在低质量浓度(200 mg/L)时,各菌株对Fe2+钝化效率均在70%以上,以PZHS20钝化能力较强,较PZHS90、PZHS87分别高出2.1%、5.0%;当Fe2+质量浓度为400 mg/L时,3株菌株钝化能力均在70%左右;当Fe2+质量浓度为800~1 600 mg/L时,各菌株钝化效率显著性差异不明显,1 600 mg/L Fe2+环境下各菌株间钝化效率均在10%以上(图6)。

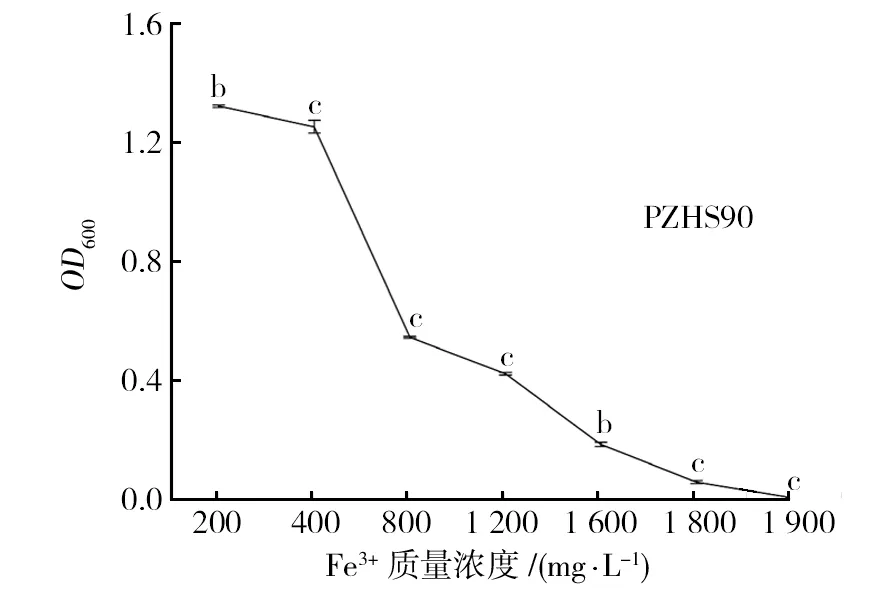

图5 不同Fe3+质量浓度下根瘤菌生长曲线Fig.5 Fe3+ Growth curve of rhizobia in different concentration of Fe3+ solution
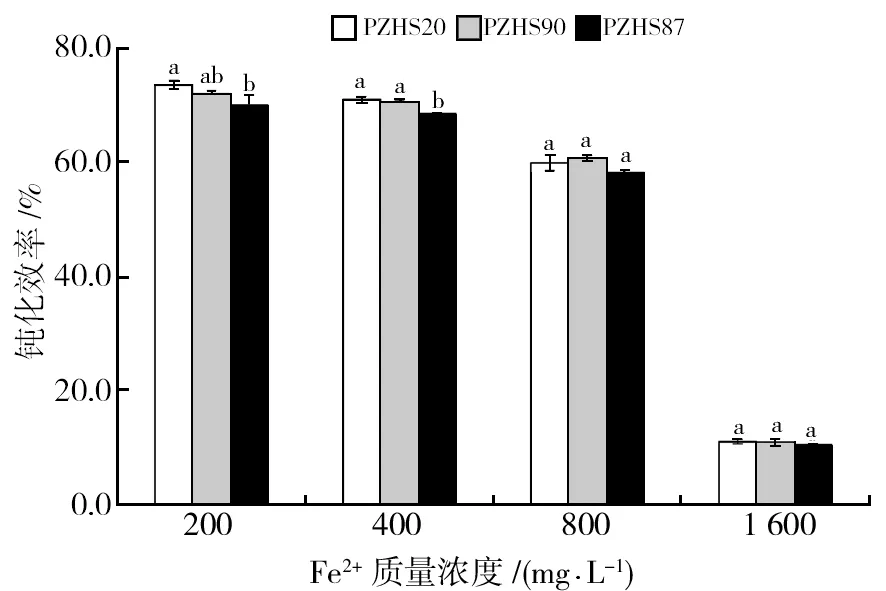
图6 不同质量浓度下根瘤菌Fe2+钝化效率测定结果Fig.6 Fe2+ Passivation rate of rhizobia in different concentration of Fe2+ solution
在不同Fe3+浓度下,各菌株整体钝化能力随Fe3+浓度增高呈现下降趋势,0~400 mg/L变化不太明显,800~1 600 mg/L出现明显下降。当Fe3+质量浓度为200 mg/L时,各菌株对Fe3+钝化效率均高于80%,显著性差异不明显;当Fe3+质量浓度为400 mg/L时,各菌株钝化效率在80%左右,其中PZHS20较PZHS90、PZHS87分别高出2.3%、3.9%;当Fe3+质量浓度为800 mg/L时,以PZHS20钝化能力较佳,较PZHS90、PZHS87分别高出2.9%、5.5%,显著性差异明显;当Fe3+质量浓度为1 600 mg/L时,各菌株钝化效率均高于20%,显著性差异不明显(图7)。
在200、400及800 mg/L Fe2+/Fe3+质量浓度下,PZHS20、PZHS90及PZHS87钝化Fe2+/Fe3+的量随Fe2+/Fe3+浓度增高不断增加,当Fe2+/Fe3+质量浓度达到1 600 mg/L时,3株根瘤菌对Fe2+/Fe3+实际钝化量显著减少,尤其是对Fe2+的平均钝化量仅为173.23 mg/L,相比800 mg/L时减少了303.62 mg/L,表明Fe2+/Fe3+浓度过高时,菌株对铁的钝化能力受到明显抑制。同时,相同浓度下PZHS20、PZHS90及PZHS87对于Fe3+的钝化能力均显著高于对Fe2+的钝化能力(表1)。且随着Fe2+/Fe3+浓度增加,3株根瘤菌对Fe2+和Fe3+实际钝化量的差异愈发明显,当Fe2+/Fe3+质量浓度达到1 600 mg/L时差异最为显著,这一结果应该与Fe3+具有强氧化性有关。

图7 不同质量浓度下根瘤菌Fe3+钝化效率测定结果Fig.7 Fe3+ Passivation rate of rhizobia in different concentration of Fe3+ solution

表1 根瘤菌在不同Fe2+/Fe3+质量浓度条件下钝化Fe2+/Fe3+的能力
注:同一Fe质量浓度数据中不同小写字母表示差异显著(P<0.05)
3 讨 论
攀枝花地区矿业发达,钒钛磁铁尾矿堆积较多,尾矿铁含量约为212.7 g/kg[8]。虽然铁不属于重金属,但其含量过多同样会影响植物正常生长[19-20]。水黄皮在铁尾矿土壤中生长状况良好,且能与根瘤菌共生结瘤,说明水黄皮能适应金属含量高的尾矿土壤等极端环境,具有较强的抗逆能力。本研究通过对铁尾矿水黄皮共生根瘤菌的捕获、分离与纯化获得对高浓度Fe2+/ Fe3+有抗逆性的根瘤菌39株,说明攀枝花钒钛磁铁尾矿中有丰富的耐铁细菌资源。Carrasco等[21]从黄铁矿溢出污染区分离得到41株根瘤菌可耐高达300 mg/L As、100 mg/L Cu和500 mg/L Pb;Vidal等[22]从法国南部锌尾矿筛选出MesorhizobiummetalliduransSTM 2683,可耐受32 mmol/L Zn和0.5 mmol/L Cd。根瘤菌能与豆科植物共生结瘤固氮,将空气中的氮气转化为有效氮,补充土壤氮供给,改善土壤营养状况[23-25]。有些根瘤菌还具有溶磷、解钾等功能,促进植株对营养元素的吸收与利用,增加植物的抗逆性[26],在微生物-植物联合修复尾矿中可发挥重要作用。
本研究筛选出对铁耐受性强的埃尔坎慢生根瘤菌(Bradyrhizobiumelkanii)、人苍白杆菌(Ochrobactrumanthropic)在200 mg/L Fe2+/ Fe3+溶液中对Fe2+/ Fe3+钝化效率分别为70%和80%。由此可知,铁耐受根瘤菌可能具备铁钝化功能。微生物富集重金属主要通过胞内外沉积作用等机制来实现[27],而微生物对铁钝化机理尚不清楚,但可能与重金属钝化机制大致相同[28]。据研究报道,不同铁浓度下菌株钝化能力还受pH[29]、温度[30]等因素影响。本研究中耐铁根瘤菌的铁钝化效率随Fe2+/Fe3+浓度的上升而下降,可能与菌株在不同Fe2+/Fe3+浓度下的耐受能力密切相关,随Fe2+/Fe3+浓度增加菌株生长受到不同程度抑制,菌体实际钝化Fe2+/Fe3+的量与溶液中Fe2+/Fe3+总量的比值逐渐减小,钝化效率逐渐降低。本研究从含高浓度铁的钒钛磁铁尾矿土壤中分离筛选出兼具Fe2+/Fe3+耐受性和钝化能力的根瘤菌资源,为水黄皮-根瘤菌联合修复钒钛磁铁矿尾污染土壤提供了可利用的菌株资源。
