乳腺癌肺转移过程中Th1/Th2型细胞因子的动态变化
2020-06-16朱文文刘北星
朱文文, 赵 娜, 刘北星
(中国医科大学基础医学院 病原生物学教研室,辽宁 沈阳 110122)
乳腺癌是全世界妇女中最常见的癌症类型,相关研究报告显示,我国乳腺癌发病率及死亡率逐年上升,对女性生命健康造成严重威胁[1]。肿瘤转移是乳腺癌患者死亡的最主要原因,而转移通常发生在淋巴结、肺、肝脏等组织[2]。在肿瘤发生发展及转移过程中,细胞因子发挥重要作用。细胞因子除能调控固有应答和适应性应答外,也可调节肿瘤细胞的生长及影响损伤组织修复。例如,一些细胞因子能通过自分泌或者旁分泌的形式直接干预肿瘤细胞的行为从而影响肿瘤进展[3-4];另一方面,细胞因子还能通过影响其他类型的细胞,例如癌旁的上皮细胞、纤维母细胞以及免疫细胞,影响癌细胞与宿主之间的关系,重塑肿瘤微环境,发挥促癌或者抑癌的作用[5-8]。近年来,Th1和Th2型细胞因子与肿瘤免疫的关系越来越受到人们的重视。研究发现,Th1型细胞主要介导细胞免疫反应,是机体抗肿瘤免疫的主要方式,所产生的Th1型细胞因子IFN-γ具有较强的抗肿瘤和免疫调节作用,而Th2型细胞主要介导体液免疫反应,所分泌的细胞因子如IL-4、IL-5、IL-10、IL-13可削弱机体对肿瘤所产生的免疫清除等作用,肿瘤患者体内呈现的Th2优势应答是肿瘤细胞发生免疫逃逸的机制之一[9-10]。正常情况下,Th1和Th2处于相对平衡的状态,这对于维持机体的免疫功能十分重要,体内Th1和Th2型细胞因子的失衡会导致免疫系统紊乱,进而发生疾病,如癌症、艾滋病以及自身免疫性疾病[11-14]。因此,在乳腺癌肺转移过程中,势必会造成Th1和Th2型细胞因子变化趋势不同。在研究过程中,动物模型是乳腺癌研究的基础。目前,移植瘤乳腺癌模型、乳腺癌细胞系及转基因工程小鼠常用于乳腺癌肺转移模型, 而尾静脉、皮下和乳垫原位是移植瘤乳腺癌模型常用的接种部位[15]。在以往的文献中,对于乳腺癌的基础研究,其移植瘤乳腺癌模型的建立一般都使用单一的接种部位,目前还未见文献报道在两种不同的建模途径下,乳腺癌肺转移过程中体内Th1/Th2型细胞因子的变化是否不同。为明确乳腺癌肺转移过程中Th1/Th2型细胞因子的变化趋势,本研究利用两种不同的转移模型,通过HE染色、墨汁染色、Real-time RT-PCR等技术,探讨在由皮下接种肿瘤细胞与尾静脉注射肿瘤细胞导致的乳腺癌肺转移的情况下,不同时间点小鼠体内IFN-γ、IL-13、IL-5、IL-4等细胞因子表达量的变化趋势。
1 材料与方法
1.1 材料
1.1.1 动物 6~8周龄雌性BALB/c鼠,购自辽宁本溪长生生物技术有限公司,在中国医科大学实验动物中心SPF级动物饲养室内常规饲养2周后用于实验研究。
1.1.2 细胞株 小鼠乳腺癌细胞4T1细胞为本实验室保存细胞株,用含10%FBS及1%双抗的DMEM培养基常规传代培养。
1.1.3 试剂 RNA提取试剂盒、逆转录试剂盒和荧光实时定量PCR试剂盒购自TaKaRa生物工程有限公司。
1.1.4 仪器与设备 CO2恒温培养箱(HERAcell 150i,美国Thermo公司);超高速制冷离心机(MULTIFUGE X3R,美国Thermo公司);实时荧光定量PCR仪(Applied Biosystems ABI 7500,美国ABI公司)。
1.2 方法
1.2.1 小鼠乳腺癌肺转移模型的构建 收集4T1细胞,PBS清洗1次,PBS稀释至1×107细胞/mL,取100 μL细胞悬液通过尾静脉和皮下分别接种于BABL/c小鼠,每只小鼠接种1×106个4T1细胞,制作小鼠乳腺癌肺转移模型。尾静脉和皮下分别接种9只,另设置2只空白对照。接种后每天给小鼠称重观察。
1.2.2 确立模型建立成功 分别在接种后第0、7、14、21天取出小鼠的肺组织后做HE染色和墨汁染色,确定肿瘤转移灶。
1.2.3 Real-time RT-PCR技术检测细胞因子 用RNAisoplus试剂盒提取肺组织总RNA,PrimeScriptTM逆转录试剂盒合成cDNA。按照SYBR Premix Ex TaqTMII试剂盒说明,采用Real-time RT-PCR技术检测接种第7、14、21天肺组织局部Th1/Th2型细胞因子IFN-γ、IL-4、IL-5、IL-13的mRNA表达水平。引物设计:IL-4-F:5′-TGTACCAGGAGCCATATCCA-3′,IL-4-R:5′-TTCTTCGTTGCTGTGAGGAC-3′;IL-5-F:5′-GGCTTCCTGTCCCTACTCAT-3′,IL-5-R:5′-TCCTCGCCACACTTCTCTTT-3′;IL-13-F:5′-AGCATGGTATGGAGTGTGGA-3′,IL-13-R:5′-TTGCAATTGGAGATGTTGGT-3′;IFN-γ-F:5′-TATCTGGAGGAACTGGCAAA-3′,IFN-γ-R:5′-GGTGTGATTCAATGACGCTT-3′;β-actin-F:5′-GGTCATCACTATTGGCAACG-3′,β-actin-R:5′-TCCATACCCAAGAAGGAAGG-3′。在ABI 7500系统下进行实时荧光定量PCR扩增。结果表示为2-ΔΔCT(fold change,即实验组目的基因的表达相对于对照组的变化倍数),ΔΔCT=实验组(CT目的基因-CT内参基因)-对照组(CT目的基因-CT内参基因)。
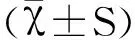
2 结果与分析
2.1 小鼠乳腺癌肺转移模型的建立
小鼠尾静脉注射4T1细胞后第7天取肺组织,HE染色发现肿瘤细胞浸润灶(图1A),提示尾静脉接种4T1细胞的乳腺癌肺转移模型成功建立。
图1 荷瘤鼠肺转移Fig.1 Lung metastasis of tumor-bearing miceA:尾静脉注射第7天肺组织及皮下荷瘤第7天肿瘤组织;B: 肺转移结节及数量;ND:未发现A: Lung tissues on day 7 after tail vein injection and tumor tissues on day 7 after subcutaneous inoculation;B: Lung metastasis nodules and nodules number;ND:not found
皮下原位注射4T1细胞后第7天,注射局部发现明显肿瘤块。分离肿瘤组织后做HE切片染色,结果发现肿瘤细胞浸润灶(图1A)。然而皮下接种4T1细胞的模型鼠,在接种后第7天及第14天,肺组织内未发现明显的肿瘤浸润灶及肺结节(图1B)。但皮下接种后第21天,模型鼠肺组织表面看到大量结节(图1B),证实皮下注射4T1细胞也能发生肺转移。
2.2 不同途径接种4T1细胞后小鼠体重及生存率的变化
接种4T1细胞后不同时间点称量小鼠体重,发现皮下接种组的小鼠在21 d内体重变化与正常小鼠并无太大区别,相反,尾静脉注射组的小鼠从第13天开始体重出现明显下降趋势(图2A),同时开始出现死亡。在尾静脉接种后21 d内,所有接种鼠全部死亡(图2B)。在此期间,皮下接种鼠无一例死亡,提示接种途径不同,对BALB/c鼠生存期限和预后有明显影响。
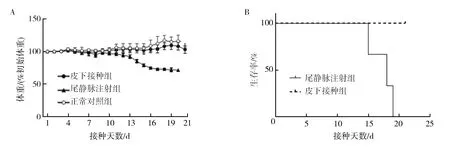
图2 荷瘤鼠体重(A)及生存率(B)的变化 Fig.2 Body weight (A) and survival (B) of tumor-bearing mice.
2.3 乳腺癌模型鼠肺组织内Th1/Th2型细胞因子表达水平
机体Th1/Th2应答在肿瘤发生发展中发挥关键作用,Th1/Th2型细胞因子的变化趋势一定程度上反映了机体的免疫应答类型。本研究提取了模型鼠肺组织总RNA,Real-time RT-PCR结果显示,尾静脉注射4T1的小鼠,其肺组织内Th2型细胞因子IL-4、IL-13表达水平呈现明显递增趋势(图3 A、B)。与Th2型细胞因子变化趋势不同,Th1型细胞因子IFN-γ虽在接种后第7天表达量有所升高,但随着时间的延长反而呈现下降趋势(图3D),提示随着肿瘤的发展,机体出现Th2优势应答。而优势的Th2型应答可能与模型鼠体重下降,进而发生死亡密切相关(尾静脉注射4T1细胞的BALB/c鼠21 d内全部死亡)。
提取皮下接种4T1细胞的小鼠肺组织总RNA,Real-time RT-PCR结果显示,其IL-5、IL-4、IL-13等细胞因子的表达趋势与尾静脉组趋势基本一致,但表达水平均较尾静脉组低。与尾静脉组不同的是IFN-γ在第7天表达量并未升高,此后也一直保持在低水平,但总体趋势均在下降。
对比两种途径在第7天细胞因子表达水平,结果显示尾静脉组IL-13、IL-4、IFN-γ表达水平明显高于皮下接种组,提示尾静脉注射组转移速度快,肿瘤在第7天便转移到肺,引起肺部强烈免疫应答,此时皮下荷瘤鼠肺组织内免疫应答尚不强烈。但在第14天,两种接种方式的模型鼠肺组织内细胞因子的mRNA表达水平已无明显差异。
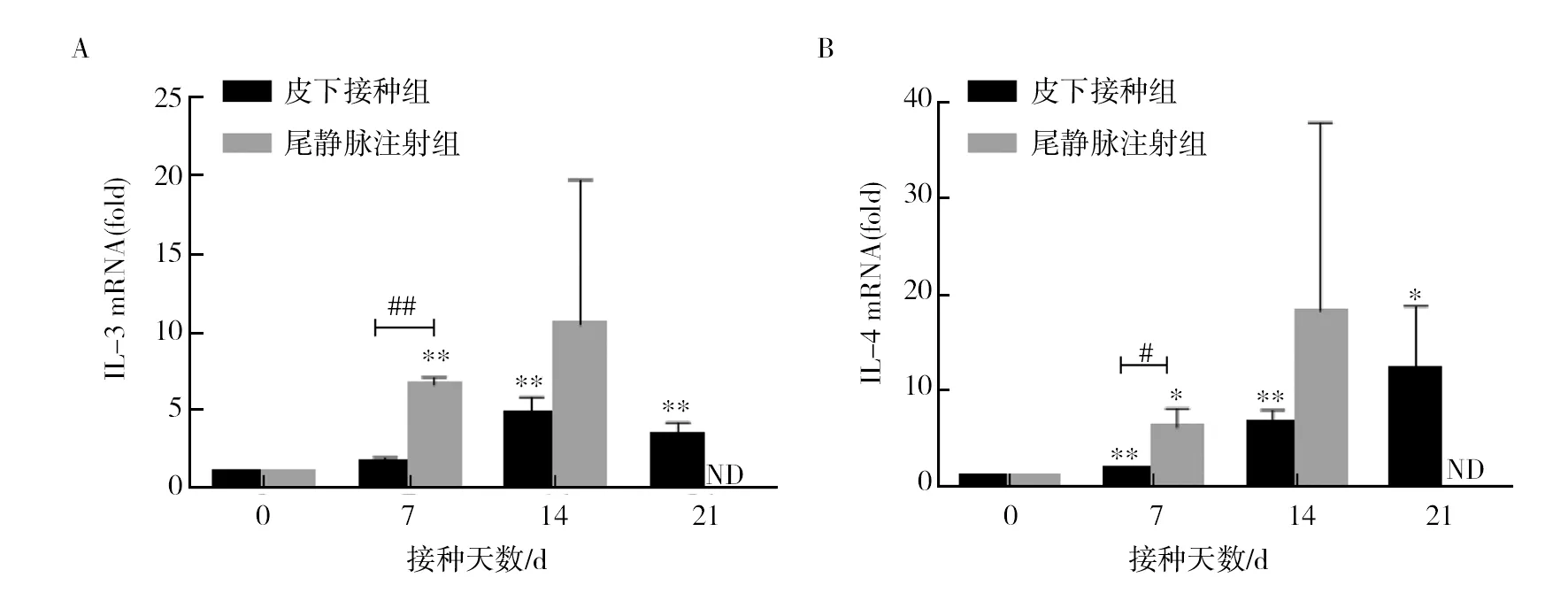
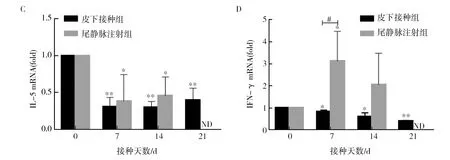
图3 荷瘤鼠肺组织内Th1/Th2型细胞因子表达水平的变化Fig.3 The relative expression of mRNAs for IL-13 (A), IL-4 (B), IL-5 (C), and IFN-γ(D) in the lungs of tumor-bearing mice与正常对照组相比,* P<0.05, ** P<0.01;与皮下接种组相比,# P<0.05, ## P<0.01;ND:未检测 * Significant difference (P<0.05), ** significant difference (P<0.01), compared with the normal control group;# Significant difference (P<0.05), ## significant difference (P<0.01), compared with the subcutaneous inoculation group;ND:not measured
3 讨 论
免疫应答在肿瘤的发生发展及转移过程中发挥重要作用[16]。肿瘤微环境中存在各种类型的免疫细胞如CD4+T细胞、CD8+T细胞、巨噬细胞、NK等,这些免疫细胞可通过分泌细胞因子和趋化因子,影响肿瘤的增殖、转移及血管新生[17]。
包括IL-5、IL-13、IL-4在内的多种Th2型细胞因子参与了乳腺癌的发生发展及转移的过程,文献报道,在乳腺癌组织内,IL-13的表达较癌周组织明显升高[18],另外,其高亲和力受体IL-13Rα2,作为诱导受体在乳腺癌中高表达,IL-13Rα2的耗竭可适度延缓原发肿瘤的生长,还可显著抑制体内肺转移[19]。本研究观察到IL-13在肺组织内表达水平随着接种时间延长而逐渐升高,提示IL-13可能参与了肿瘤的转移。而IL-13作为Th2型免疫应答的主要细胞因子,其升高一定程度上意味着肺组织内Th2应答增加。并且,与皮下接种组相比,尾静脉注射组在第7天时IL-13表达水平明显升高,此后一直处于高水平,最后尾静脉组小鼠出现死亡,而皮下接种组并未出现死亡小鼠,提示小鼠死亡也许与Th2高应答有关。
IL-5在癌症中的具体作用还不明了,研究表明,与ER+乳腺癌相比,ER-乳腺癌患者血液中IL-5水平明显增高[20],肿瘤间质IL-5的高水平分泌与乳腺癌患者的预后不良有关[21],但其在乳腺癌中的具体作用机制尚不明确。有文献报道,在膀胱癌患者肿瘤组织内IL-5水平明显升高,升高的IL-5主要是通过ERK1/2介导的MMP-9/NF-κB/AP-1途径作用于膀胱癌细胞,进而促进癌细胞的迁移和侵袭[22]。但是,也有研究发现IL-5信号的缺失以及中和IL-5会促进黑色素瘤的肺转移,究其原因可能与IL-5缺失导致嗜酸细胞肺浸润减少,进而削弱了机体抗肿瘤免疫有关[23]。本研究建立的乳腺癌肺转移模型中,无论是皮下接种还是尾静脉注射,IL-5在肺组织内表达水平一直没有明显改变,那么IL-5在乳腺癌转移过程中是否发挥作用,是抑瘤还是促瘤作用,尚需进一步研究。
IL-4在乳腺癌尤其是恶性乳腺癌中的表达明显升高,Rohani等[24]认为IL-4能加速乳腺癌的进展,并且与乳腺癌的死亡率有关,本研究的确观察到在乳腺癌发展过程中,IL-4水平逐渐升高,并且在体重开始明显下降的时间点其水平升高的更明显,之后很快便出现了小鼠的死亡,据Venmar等[25]报道,其机制也许是因为乳腺癌细胞表面表达高水平的IL-4R,而IL-4可以结合肿瘤细胞表面的IL-4R,从而激活JAK/STAT6信号通路。Zhang等研究显示,STAT6高表达的乳腺癌细胞相比STAT6缺失型其凋亡率下降, 且STAT6过表达细胞系中表达更多的抗凋亡蛋白, 说明STAT6的活化抑制凋亡[26],提示IL-4通过JAK/STAT6信号通路对肿瘤增殖及转移起促进作用。本研究中IL-4表达水平的升高,推测也有可能是通过这条信号通路发挥作用,但还不清楚,需要进一步探讨。
IFN-γ作为Th1型细胞因子,具有抗炎的作用[11],本研究在接种开始,尾静脉注射组的BALB/c鼠IFN-γ水平呈现上升状态,随着接种时间的延长,小鼠体内乳腺癌的进展,IFN-γ水平逐渐下降,但在皮下接种组,其水平一直处于明显的低水平状态,推测也许是因为皮下接种的4T1细胞进入机体后,在皮下局部逐渐浸润发展,进展较慢,还不足以引发机体强烈的免疫反应,而在乳腺癌发展过程中,Th1应答是逐渐朝着低水平发展的,所以在皮下注射组的BALB/c鼠中IFN-γ一直处于低水平。
在乳腺癌的发生发展及转移过程中,Th1型细胞因子在一开始升高,发挥着抗炎的作用,但随着时间的推移,Th2型应答逐渐占优势,形成了促进肿瘤发展的免疫微环境,Th2型细胞因子也都逐渐升高,在两种模型中并无明显差别。本研究利用BALB/c鼠,通过两种不同的模型,证实了乳腺癌肺转移过程中小鼠体内Th1/Th2型细胞因子是朝着相反的趋势改变,并且最后以Th2型应答占优势。
