自主运动介导Aβ降解酶调控Tg-APP/PS1小鼠海马Aβ沉积的机制研究
2020-06-15余锋贾芳芳徐波张宪亮
余锋 贾芳芳 徐波 张宪亮
摘 要:目的:探析β-淀粉样蛋白(β-amyloid, Aβ)降解酶在自主运动调节APP/PS1转基因(Tg-APP/PS1)小鼠海马Aβ沉积过程中的作用机制。方法:C57系Tg-APP/PS1小鼠和C57系野生小鼠各34只分别随机分为Tg-APP/PS1自主运动组(TE, n=17),Tg-APP/PS1安静对照组(TC, n=17),野生自主运动组(E, n=17)和野生安静对照组(C, n=17)。TE组和E组小鼠从3月龄开始,除给予日常饮食和饮水,施以16周自主运动,TC组和C组小鼠仅给予正常饮食、饮水。实时定量RT-PCR实验检测海马Aβ降解酶脑啡肽酶(neprilysin, NEP)、胰岛素降解酶(insulin degrading enzyme, IDE)、血管紧张素转化酶(angiotensin-converting enzyme, ACE)、内皮素转化酶(endothelin-converting enzyme, ECE)、基质金属蛋白酶-9(matrix metalloproteinase 9, MMP-9)和纤溶酶(Plasmin, PL)的mRNA表达水平,Western blot实验检测NEP、IDE、ACE和MMP-9的蛋白表达,免疫组化实验检测Aβ斑块沉积情况。结果:1)16周自主运动促进了Tg-APP/PS1小鼠海马NEP和IDE mRNA表达的极显著性上调(P<0.01),促进了ACE、MMP-9和PL mRNA表达的显著性上调(P<0.05);2) 16周自主运动促进了Tg-APP/PS1小鼠海马IDE蛋白表达极显著性上调(P<0.01),促进了NEP、ACE和MMP-9的蛋白表达显著性上调(P<0.05);3) 16周自主运动显著性下调了Tg-APP/PS1小鼠海马Aβ沉积(P<0.01)。结论:自主运动可通过上调海马内Aβ降解酶的基因和蛋白表达进而抑制Tg-APP/PS1小鼠海马内的Aβ沉积。
关键词:自主运动;阿尔茨海默病;APP/PS1轉基因小鼠;Aβ沉积;Aβ降解酶
中图分类号:G804.2 文献标识码:A 文章编号:1006-2076(2020)06-0072-09
Abstract:Objective: To observe the effects and mechanism of Aβ degradation enzyme on the hippocampal Aβ deposition in transgenic mice of Alzheimers disease (AD) after 16 weeks voluntary wheel running. Methods: 34 Male Tg-APP/PS1 mice and 34 wild type mice of three-month-old C57BL/6 strain were randomly divided into Tg-APP/PS1 voluntary wheel running group (TE, n=17), Tg-APP/PS1 quiet control group (TC, n=17), wild type voluntary wheel running group (E, n=17) and wild type quiet control group (C, n=17). Mice in group TE and group E were subjected to wheel running with ad libitum access to food and water for 16 weeks from 3 months of age. Mice in group TC and group C were subjected to food and water ad libitum, without exercise. Real-time RT-PCR test was used to detect mRNA level of Aβ degradation enzyme, including NEP, IDE, ACE, ECE, MMP-9 and PL. Western blot test was used to detect protein level of NEP, IDE, ACE and MMP-9. Immunohistochemistry test was used to determine hippocampal Aβ deposition. Results: 1) After 16 weeks voluntary wheel running, the mRNA expression of NEP and IDE were very significant up-regulated (P<0.01), and the mRNA expression of ACE, MMP-9 and PL were significant up-regulated (P<0.05) in the hippocampus of Tg-APP/PS1 mice. 2) After 16 weeks voluntary wheel running, the protein expression of IDE was very significant up-regulated (P<0.01), and the protein expression of NEP, ACE, MMP-9 were significant up-regulated (P<0.05) in the hippocampus of Tg-APP/PS1 mice. 3) After 16 weeks voluntary wheel running, the Aβ deposition in the hippocampus of Tg-APP/PS1 mice was very significant down-regulated (P<0.01). Conclusion: Voluntary wheel running decreased the deposition of Aβ by promoting the expression of Aβ degradation enzyme in the hippocampus of Tg-APP/PS1 mice.
Key words:voluntary wheel running; Alzheimers disease; Tg-APP/PS1 mice; Aβ deposition; Aβ degradation enzyme
认知和学习记忆是脑的重要高级功能,决定着人类认识自然和改造社会的深刻程度。脑的认知和学习记忆能力的增龄性减弱,是导致神经退行性疾病的重要归因。阿尔茨海默病(Alzheimers disease, AD)是一种脑的认知下降和学习记忆损害相关的神经退行性疾病,被称为世界第一大神经退行性疾病。AD主要的病理标志是脑内β-淀粉样蛋白(β-amyloid, Aβ)沉积产生老年斑(senile plaque, SP),tau蛋白过度磷酸化形成神经纤维缠结及由Aβ沉积和tau蛋白过度磷酸化所导致的神经细胞的缺失等[1]。其中,Aβ沉积是AD发病的主要病因之一。Aβ具有很强的神经毒性,能诱导脑组织的免疫炎症反应、神经细胞的异常凋亡、氧化应激损伤、诱导钙离子稳态以及导致线粒体的能量供应系统功能紊乱,致使神经细胞异常死亡和神经系统的退行性病变[2]。
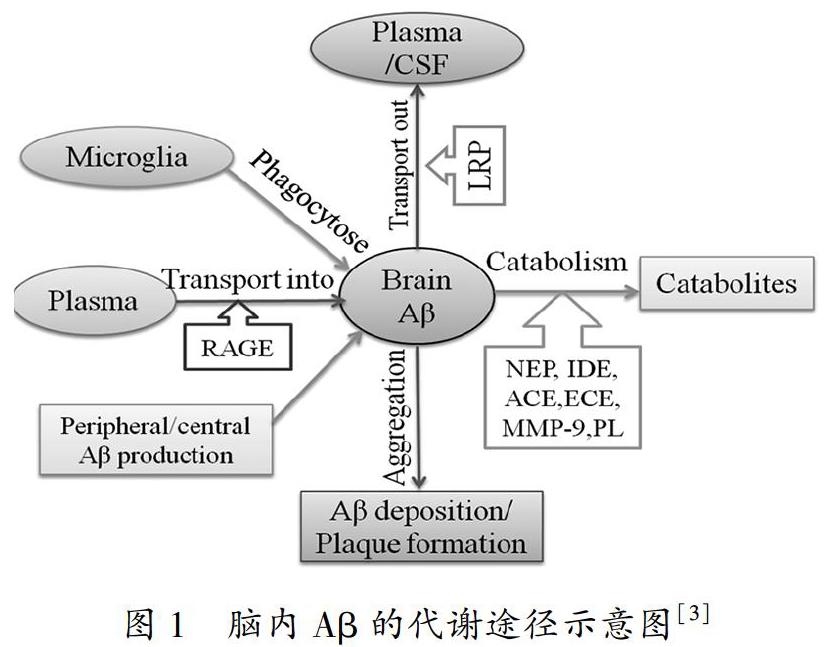
正常脑内Aβ的产生和降解呈动态平衡,故不会沉积。AD脑内Aβ的产生和清除之间的平衡被打乱,Aβ不能被及时清除,而在神经细胞外聚积,导致其沉积,进而引发一系列神经毒性和病理学改变,阻碍神经细胞正常生理功能的发挥。正常情况下脑内生成的Aβ主要是通过三种方式清除(如图1):即经神经细胞内Aβ降解酶的降解清除、血脑屏障中Aβ转运蛋白的转运出脑清除和小胶质细胞对其进行吞噬降解清除[2],三种清除方式中Aβ降解酶占主导作用。研究发现,脑内的Aβ降解酶包括脑啡肽酶(neprilysin, NEP)、胰岛素降解酶(insulin degrading enzyme, IDE)、血管紧张素转化酶(angiotensin-converting enzyme, ACE)、內皮素转化酶(endothelin-converting enzyme, ECE)、基质金属蛋白酶-9(matrix metalloproteinase 9, MMP-9)和纤溶酶(Plasmin, PL)等主要几种。
随着对AD风险防控意识的增强及其病症临床实践和实验研究的逐步深入,人们对AD病理干预手段的认识也在改变,开始由对病症治疗向积极预防转变。体育科学研究发现,经常参与体育运动或体力活动可提高老年人的认知功能[4-6],降低AD的患病风险[7-9]。动物实验亦发现,运动干预可预防和改善AD病理,其机制涉及运动诱导Aβ沉积的减少[4, 10-16],抑制tau蛋白的过度磷酸化[17-19],促进神经细胞的抗氧化[18, 20-21]、缓解神经细胞死亡[22-24]和神经炎症[13, 25]等生物学机制。其中,运动调节Aβ沉积的研究居多,运动可通过调节Aβ生成相关分泌酶的表达或活性来抑制Aβ的生成[10, 14, 26-27],通过抑制APP的表达水平来抑制Aβ的产生[12, 28-29]等。但目前并未发现运动作为独立影响因素的研究证明其可通过调节Aβ降解酶进而降低Aβ沉积,仅有的Maesako等[30]结合饮食控制和运动干预的研究及Lazarov等[31]通过内设跑轮运动装置丰富环境干预的研究表明:运动结合其他干预方式可促进NEP与IDE的表达减少脑内Aβ沉积。关于运动干预通过介导ACE、ECE、MMP-9和PL等几种降解酶而调节Aβ沉积,预防和缓解AD的研究,以及运动干预作为独立因素调控Aβ降解酶介导AD病理的研究均未见报道,相关机制更缺乏深入研究。本研究拟探讨16周自主运动能否通过上调Aβ降解酶的表达,进而下调Tg-APP/PS1小鼠海马Aβ沉积,解释自主运动调节脑Aβ沉积的可能机制。
1 材料与方法
1.1 实验对象与材料
从南京生物医药研究院实验动物模式研究所选购3月龄C57系APP/PS1转基因雄性小鼠34只(体重19.56±1.48 g)与3月龄野生型C57系小鼠34只(体重20.24±1.02 g),单独饲养。小鼠饲料、垫料购自上海斯莱康公司,自由饮水和饮食,垫料定期更换。饲养环境为清洁级。
1.2 实验对象分组与干预方案
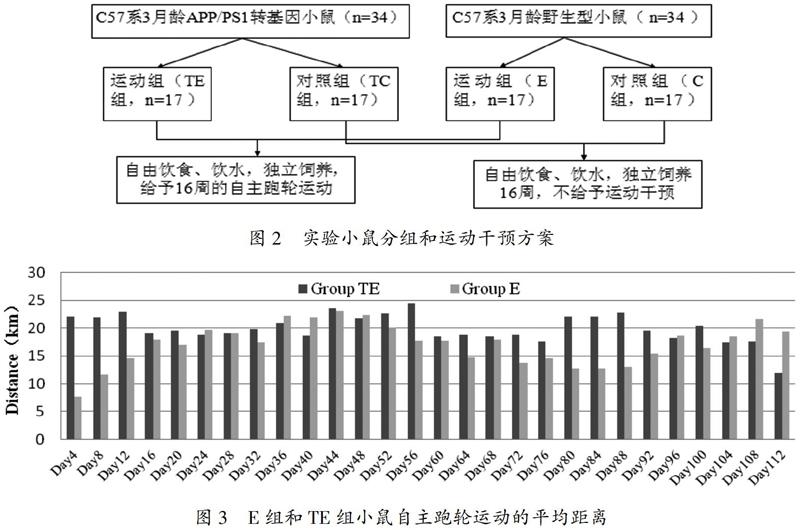
将APP/PS1转基因小鼠随机分为运动组(TE)和对照组(TC),将野生C57小鼠亦随机分为运动组(E)和对照组(C)。其中,TE组和E组小鼠除给予正常饮食和饮水之外,为其提供自主跑轮装置,使其进行16周的自主运动(如图2、图3)。
1.3 实时荧光定量实验(RT-PCR)
运动干预实验结束24小时后,每组随机选取12只实验小鼠麻醉、断颈处死,取海马组织迅速置于液氮保存,后转移至-80℃冰箱冷冻待测。
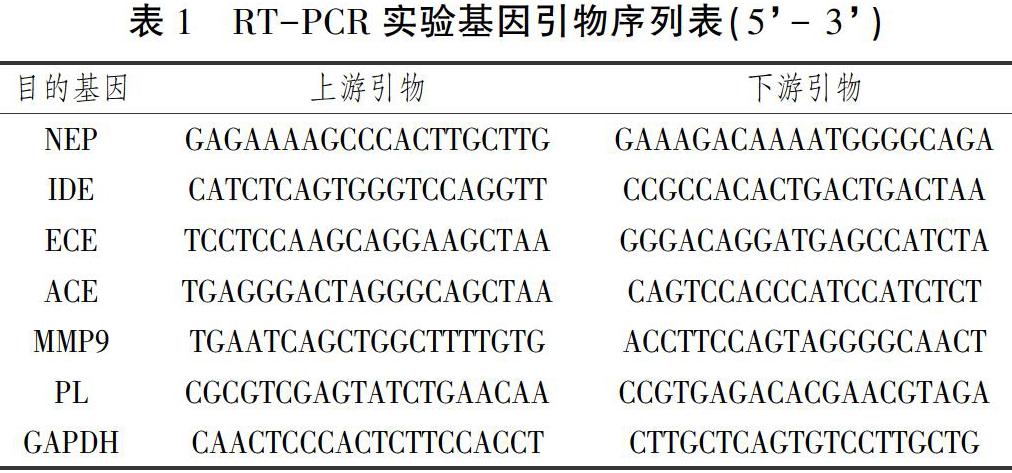
所有实验小鼠海马组织取完后,每组取6只小鼠海马组织于冰上进行实验操作,按照Invitrogen Trizol法提取总RNA,采用Toyobo Fsq101反转录试剂盒和实时荧光定量PCR仪检测相关基因相对含量[14]。各目的基因和内参基因的引物序列如下表(引物设计与合成均由上海生工生物公司完成)。
1.4 免疫印迹实验(Western blot)
每组取剩余的6只小鼠海马组织于冰上进行实验操作,剪碎放入研磨管中,按照Beyotime P0013 Western及RAP裂解液说明书进行操作。采用8%分离胶电泳,通过Millipore ECL超敏试剂盒显影和Alpha FC2型凝胶成像系统进行冷光扫膜。所有抗体购于CST公司,采用Flour Chem FC2软件分析图像灰度值,冷光扫膜。实验所用抗体购于CST和Abcam公司,使用Flour Chem FC2软件对所捕捉图像进行灰度值分析,具体实验步骤参照文献[18]进行。
1.5 免疫组化实验(Immunohistochemistry)
运动干预实验结束24小时后,每组余下5只小鼠按0.1ml/20 g体重的剂量经腹腔注射1.5%的戊巴比妥纳麻醉,剪开腹腔至胸腔,暴露出心脏,从心脏左心室尖处灌注0.9%的生理盐水(4℃)冲洗血液,至大鼠肝脏发白、流出液基本无血后,换成4%的多聚甲醛溶液(4℃)继续灌注,至头、四肢均已僵硬后迅速断头取脑,于-80℃冰箱保存。采用OCT包埋剂进行冰冻包埋,于冰冻切片机切片,厚度为20 μm。先后通过小鼠Aβ抗兔单克隆抗体(I抗,1∶200)和兔抗小鼠IgG抗体(II抗,1∶400)孵育切片。每只小鼠取6张切片,各随机取相应海马区的2个视野进行分析。采用二氨基联苯胺(DAB)显色液染色,于显微镜下观察。Aβ沉积阳性免疫反应产物呈棕黄色或棕褐色,集中分布于胞浆及核膜周围,呈斑块状,计算其在所选视野中的面积百分比,百分比值高,Aβ蛋白表达多,反之则少。实验所用抗体购自CST和Abcam公司,具体实验步骤参照文献[10]进行。
1.6 数据统计
采用SPSS 18.0数据统计软件、Image J图像处理软件、GraphPad绘图分析软件以及Excel 2010办公软件分析实验数据。所有实验数据均以(平均值±标准差)表示,组间比较采用采用单因素分析法(One-Way ANOVA),事后检验采用LSD 法。记P<0.05为具有显著性差异,记P<0.01 为具有极显著性差异。
2 结果分析
2.1 各组小鼠海马Aβ降解酶 mRNA表达的比较
与C组相比,TC组小鼠海马NEP、IDE和ECE mRNA表达均极显著性降低(P<0.01),ACE、MMP-9和PL mRNA表达均显著性降低(P<0.05)。与TC组相比,TE组小鼠海马NEP和IDE mRNA表达均极显著性上调(P<0.01),ACE、MMP-9和PL mRNA表达均显著性上调(P<0.05),ECE mRNA表达呈上调趋势,但两组间无显著性差异。与E组相比,TE组小鼠海马NEP、IDE、ACE和PL mRNA表达均显著性降低(P<0.05),ECE mRNA表达极显著性降低(P<0.01),TE组小鼠海马MMP-9 mRNA表达呈下调趋势,但两组之间不具有显著性差异。与C组相比,E组小鼠海马NEP mRNA表达极显著性上调(P<0.01),ECE mRNA表达显著性上调(P<0.05),而IDE、ACE 、MMP-9和PL mRNA表达呈上调趋势,但两组间不具有显著性差异(如表2、图4)。
2.2各组小鼠海马Aβ降解酶蛋白表达的比较
与C组相比,TC组小鼠海马NEP、IDE和ACE蛋白表达显著性降低(P<0.05),MMP-9蛋白表达极显著性降低(P<0.01)。与TC组相比,TE组小鼠海马NEP、ACE和MMP-9蛋白表达均显著性上调(P<0.05),IDE蛋白表达极显著性上调(P<0.01)。与E组相比,TE组小鼠海马NEP和ACE蛋白表达均呈下降趋势,但两组间无显著性差异,TE组小鼠海马IDE和MMP-9蛋白表达均显著性降低(P<0.05)。与C组相比,E组小鼠海马NEP、ACE和 MMP-9蛋白表达均有上调趋势,但两组间无显著性差异,而E组小鼠海马IDE蛋白表达显著性上调(P<0.05)(如表3、图5)。
2.3 各组小鼠海马Aβ沉积的比较
与C组相比,TC组小鼠海马Aβ沉积的面积百分比极显著性上调(P<0.01);与TC组相比,TE组小鼠海马Aβ沉积的面积百分比极显著性降低(P<0.01);与E组相比,TE组小鼠海马Aβ沉积的面积百分比显著性上调(P<0.05);与C组相比,E组小鼠海马Aβ沉积的数量显著性降低 (P<0.05)(如表4、图6)。
3 讨论
本研究所选用的APP/PS1 双转基因小鼠是通过表达人类突变型基因PS1(DeltaE9)和小鼠与人类APP(APPSwe)基因嵌合体的双转基因小鼠,自南京大学——南京生物医药研究院的模式动物研究所引进,该小鼠相关的基因型为Tg(APPswe,PSEN1dE9)85Dbo,其种源来自美国的Jackson实验动物中心。研究发现,APP/PS1转基因小鼠在4月龄时脑内便可发现老年斑的出现,在6月龄时则可在大脑皮层及海马区发现Aβ的沉积,Aβ沉积与AD实验动物的年龄密切相关[32]。与同品系野生型小鼠相比,在10~12月龄时可出现行为学的空间记忆能力缺陷[33],因此,APP/PS1转基因AD小鼠模型是研究脑的功能紊乱性疾病,特别是AD相关疾病最为理想的实验动物模型。在AD实验动物生长的适当年龄进行干预是控制Aβ沉积的重要靶点。研究[34]发现,Tg-APP/PS1小鼠在6-7月龄脑内开始出现Aβ沉积。Liu等[12]从3月龄开始对Tg-APP/PS1小鼠的进行跑台干预实验,发现5个月的跑台运动抑制了转基因小鼠海马Aβ沉积和tau蛋白过磷酸化,表明从3月龄起对Tg-APP/PS1小鼠进行运动干预可以达到调控AD病理的作用。本研究从3月龄对Tg-APP/PS1小鼠施加运动干预,7月龄提取脑组织,符合运动干预Aβ沉积的生理条件。
3.1 自主运动对Tg-APP/PS1小鼠海马Aβ降解酶的影响
3.1.1 自主运动对Tg-APP/PS1小鼠海马NEP和IDE表达的调控
NEP和IDE是研究最多也是最重要的两种Aβ降解酶,受到大量关注。研究[35-36]发现,脑内NEP水平和Aβ表达及神经细胞外淀粉样斑块沉积的程度之间关系密切。对NEP基因敲除小鼠和其他Aβ降解酶基因敲除小鼠比较发现,NEP基因敲除小鼠脑内Aβ40和Aβ42的水平均显著增加[37-38]。本研究发现,Tg-APP/PS1小鼠海马NEP mRNA表达低于野生小鼠,但两者之间差异不显著,Tg-APP/PS1小鼠海马NEP蛋白表达则显著低于野生小鼠,说明Tg-APP/PS1小鼠NEP基因转录水平与正常小鼠无差异,但其蛋白表达低于野生小鼠。16周自主运动上调了Tg-APP/PS1小鼠海马NEP mRNA和蛋白水平,说明自主运动可有效促进Tg-APP/PS1小鼠海马NEP的基因转录和蛋白表达。研究[39]发现,AD转基因小鼠脑内IDE mRNA和蛋白表达受Aβ40和Aβ42表达的调控,二者呈正相关性变化。而Tg2576小鼠脑内IDE的表达在Aβ斑块周围显著升高,且脑内IDE的蛋白表达随小鼠年龄的增大呈上升的趋势[40]。本研究发现,Tg-APP/PS1小鼠海马IDE mRNA和蛋白表达均显著低于野生小鼠,说明Tg-APP/PS1小鼠在IDE的基因转录和翻译水平上均存在缺陷性;而16周自主运动后,Tg-APP/PS1小鼠海马IDE mRNA和蛋白表达均显著增加,说明自主運动可有效抵抗Tg-APP/PS1小鼠海马IDE表达的下降;运动对野生小鼠海马IDE mRNA表达调节作用不显著,但运动上调了野生小鼠海马IDE蛋白表达,说明自主运动可上调野生小鼠海马IDE的蛋白翻译,促进脑内合成较多的IDE,有助于脑内Aβ产生和清除动态平衡的维持。
先前对运动干预AD实验动物脑内NEP和IDE影响的研究并不多见,仅有两篇研究报道了自主运动或内设自主跑轮装置的丰富环境干预对这两种Aβ降解酶的调节作用,所得结论尚不具代表性,此亦本实验选择研究运动对转基因小鼠海马Aβ降解酶进行干预的主要原因。如Maesako等[30]给予APP转基因小鼠高脂饮食,同时采用20周的自主运动干预,发现自主运动促进了该小鼠脑内的NEP的活性增加进而抑制了Aβ沉积。Lazarov等[31]发现,5个月自主运动促进了Tg-APP/PS1小鼠海马NEP和IDE的蛋白表达,抑制了Aβ沉积。Adlard等[10]发现1个月的自主运动降低了TgCRND8小鼠APP 蛋白片段(α-CTF和β-CTF),但未改变海马和皮质内的Aβ40和Aβ42表达,NEP与IDE的mRNA和蛋白表达亦未见显著变化,其原因可能与1个月的运动时间较短有关,这也是本研究采用16周中长期运动干预的直接原因,较长时程的运动可能起到重复刺激的效果,能够强化脑对运动干预的适应性变化。
3.1.2 自主运动对Tg-APP/PS1小鼠海马ACE和MMP-9表达的调控
本实验发现,Tg-APP/PS1小鼠海马ACE mRNA和蛋白表达均显著低于野生对照组小鼠;Tg-APP/PS1小鼠海马MMP-9 mRNA表达较野生小鼠下调,但不具有显著性差异,Tg-APP/PS1小鼠海马MMP-9蛋白表达显著低于野生小鼠;16周自主运动显著上调了转基因小鼠海马ACE和MMP-9的 mRNA和蛋白表达。提示,Tg-APP/PS1小鼠海马内ACE和MMP-9的表达被抑制,而16周自主运动可促进ACE 和MMP-9的表达。ACE和MMP-9也是重要的Aβ降解酶,可协同NEP和IDE对Aβ的降解,促进对Aβ的清除。ACE水平和Aβ沉积诱导AD发病之间显著相关,研究[41]发现,ACE可通过降解Aβ多肽内天冬氨酸第7位点到丝氨酸第8位点的Aβ蛋白。脑内ACE的增多可促进对Aβ的降解,而ACE抑制剂可阻断其对体外培养的Aβ降解[42]。MMP-9可在离体或在体条件下降解Aβ沉积[43]。外源性MMP-9可直接作用于α-分泌酶的APP降解位点,降低体外的Aβ多肽,而且外源性MMP-9可在离体或在体条件下降解聚积的Aβ纤维[44]。过表达MMP-9基因的转基因小鼠海马和皮质内APP的降解产物sAPPα水平显著升高,突触分枝的密度显著增加[45],表明MMP-9的表达上调,可促进对Aβ的降解清除。
3.1.3 自主运动对Tg-APP/PS1小鼠海马ECE和PL表达的调控
本实验发现,与野生小鼠相比,Tg-APP/PS1小鼠海马ECE mRNA表达显著降低,而16周自主运动未能上调转基因小鼠海马ECE mRNA表达,但运动干预上调了野生小鼠海马ECE mRNA表达。实验还发现,转基因小鼠海马PL mRNA表达与野生小鼠相比亦显著下调,16周自主运动上调了转基因小鼠海马PL mRNA表达,但对野生小鼠海马PL mRNA表达的调节并不显著。本实验表明,Tg-APP/PS1小鼠海马内ECE和PL基因表达均受到转基因造模的影响而被抑制,16周自主运动未能有效上调转基因小鼠海马内ECE基因表达,但上调了PL基因表达。ECE和PL也参与了脑内Aβ的降解过程,对调节脑内Aβ水平具有积极作用。体外试验发现重组的ECE可在3个位点降解合成的Aβ40,产生Aβ1-16、Aβ1-17、Aβ1-19以及Aβ20-40等Aβ片段[46]。ECE基因缺陷小鼠脑内Aβ40和Aβ42 表达均显著上调[47]。PL在AD发病过程中其含量及其活性亦处于较低水平,在离体条件下抑制PL可增强Aβ聚积所导致的神经细胞损伤[48],而脑内PL增多可促进Aβ的降解[49]。
目前运动科学领域尚未发现通过运动干预介导AD实验动物脑内ACE、MMP9、ECE和PL等的文献可供参考,因此,本研究探讨自主运动对Tg-APP/PS1小鼠海马中ACE、MMP9、ECE和PL等Aβ降解酶的影响,是一种探索性研究,有望为今后该领域的研究提供参考。
3.2 自主运动对Tg-APP/PS1小鼠海马Aβ沉积的影响
免疫组化实验发现,与野生小鼠相比,Tg-APP/PS1小鼠海马Aβ沉积较为密集,所占面积百分比显著大于野生小鼠。与其对照组比较,Tg-APP/PS1运动组小鼠海马Aβ沉积显著减少,提示16周主运动能够有效抑制Tg-APP/PS1小鼠海马Aβ的沉积。与野生运动组小鼠相比,Tg-APP/PS1运动组小鼠海马Aβ沉积和Aβ沉积数量上均显著性增多,表明16周自主运动虽然能够显著抑制Tg-APP/PS1小鼠海马Aβ沉积,但由于转基因小鼠脑内APP与PS1基因[26]的过表达导致海马Aβ沉积显著增多,可能在一定程度上抵消了运动干预的获益,导致运动组转基因小鼠海马Aβ沉积仅下调到野生对照组小鼠的水平。大量研究表明,Aβ沉积可诱导脑神经元的退行性病理改变,损害脑的认知和学习记忆能力。Adlard等[10]发现,5个月自主运动降低了TgCRND8小鼠海马的Aβ沉积。Cracchiolo等[50]发现,7个半月自主运动和相同时间内设跑轮的丰富环境干预降低了Tg-APP/PS1小鼠海马Aβ沉积。Yuede等[51]发现,自主运动和跑台运动均促进了Tg2576转基因小鼠海马Aβ沉积。Liu等[12]发现,5个月跑台运动降低了Tg-APP/PS1小鼠海马Aβ沉积和Aβ40与Aβ42的蛋白表达。Llort等[20]发现5周跑台运动降低了3xTg-AD小鼠海马Aβ42/Aβ40的比值,但运动干预后该小鼠海马区的Aβ斑块沉积与对照组小鼠相比无显著变化。Ke等[11]发现,4周短期跑台运动下调了Tg-APP/PS1小鼠海马Aβ的表达,但免疫组化实验发现运动对海马Aβ沉积的调节作用不显著。综上研究表明,运动干预可降低实验动物脑内的Aβ沉积,且長期运动干预效果更佳。16周自主运动下调了Tg-APP/PS1小鼠海马Aβ的沉积与上文所述运动促进了Aβ降解酶的表达具有直接联系,说明自主运动可通过上调Aβ降解酶的表达,促进其对Aβ的降解,进而下调转基因小鼠脑内的Aβ沉积。
4 结论
本研究表明Tg-APP/PS1小鼠海马内主要的Aβ降解酶的mRNA和蛋白表达较同月龄野生型小鼠显著性降低,其海马Aβ沉积显著性增加;而16周的自主运动显著性上调了Tg-APP/PS1小鼠海马内Aβ降解酶的mRNA和蛋白表达,下调了海马Aβ沉积。提示:自主运动可能通过促进脑内Aβ降解酶的表达,进而抑制Aβ沉积,改善AD病理。
参考文献:
[1]Swerdlow R H. Pathogenesis of Alzheimer′s disease[J]. Clin Interv Aging,2007, 2(3):347-359.
[2]余锋,徐波,季瀏,等. 跑轮和跑台运动干预模式对AD动物模型脑内β-淀粉样蛋白的影响[J]. 上海体育学院学报,2014, 38(5):50-55.
[3]Wang D S, Dickson D W, Malter J S. beta-Amyloid degradation and Alzheimer′s disease[J]. J Biomed Biotechnol,2006(3):58406.
[4]余锋,徐波,何标,等. 运动缓解阿尔茨海默症与改善认知功能的生物学机制[J]. 上海体育学院学报,2017, 41(1):25-31.
[5]Ahlskog J E, Geda Y E, Graff-Radford N R, et al. Physical exercise as a preventive or disease-modifying treatment of dementia and brain aging[J]. Mayo Clin Proc,2011, 86(9):876-884.
[6]Smith P J,Blumenthal J A,Hoffman B M,et al.Aerobic exercise and neurocognitive performance:a meta-analytic review of randomized controlled trials[J].Psychosom Med,2010,72(3):239-252.
[7]Buchman A S, Boyle P A, Yu L, et al. Total daily physical activity and the risk of AD and cognitive decline in older adults[J]. Neurology,2012, 78(17):1323-1329.
[8]Okonkwo O C, Schultz S A, Oh J M, et al. Physical activity attenuates age-related biomarker alterations in preclinical AD[J]. Neurology,2014, 83(19):1753-1760.
[9]Scarmeas N, Luchsinger J A, Brickman A M, et al. Physical activity and Alzheimer disease course[J]. Am J Geriatr Psychiatry,2011, 19(5):471-481.
[10]Adlard P A, Perreau V M, Pop V, et al. Voluntary exercise decreases amyloid load in a transgenic model of Alzheimer′s disease[J]. J Neurosci,2005, 25(17):4217-4221.
[11]Ke H C, Huang H J, Liang K C, et al. Selective improvement of cognitive function in adult and aged APP/PS1 transgenic mice by continuous non-shock treadmill exercise[J]. Brain Res,2011(1403):1-11.
[12]Liu H L, Zhao G, Zhang H, et al. Long-term treadmill exercise inhibits the progression of Alzheimer′s disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice[J]. Behav Brain Res,2013(256):261-272.
[13]Nichol K E, Poon W W, Parachikova A I, et al. Exercise alters the immune profile in Tg2576 Alzheimer mice toward a response coincident with improved cognitive performance and decreased amyloid[J]. J Neuroinflammation,2008(5):13.
[14]余锋,徐波,季浏. α-分泌酶在自主运动调节APP/PS1转基因小鼠海马APP与Aβ42中的作用研究[J]. 体育科学,2016(7):49-55.
[15]Li B, Liang F, Ding X, et al. Interval and continuous exercise overcome memory deficits related to beta-Amyloid accumulation through modulating mitochondrial dynamics[J]. Behav Brain Res,2019(376):112171.
[16]闫清伟,赵娜,夏杰,等. 跑台运动通过激活AMPK减少APP/PS1小鼠海马Aβ沉积[J]. 中国体育科技,2019, 55(4):71-80.
[17]Belarbi K, Burnouf S, Fernandez-Gomez F J, et al. Beneficial effects of exercise in a transgenic mouse model of Alzheimer′s disease-like Tau pathology[J]. Neurobiol Dis,2011, 43(2):486-494.
[18]Leem Y H, Lee Y I, Son H J, et al. Chronic exercise ameliorates the neuroinflammation in mice carrying NSE/htau23[J]. Biochem Biophys Res Commun,2011, 406(3):359-365.
[19]Leem Y H, Lim H J, Shim S B, et al. Repression of tau hyperphosphorylation by chronic endurance exercise in aged transgenic mouse model of tauopathies[J]. J Neurosci Res,2009, 87(11):2561-2570.
[20]Gimenez-Llort L, Garcia Y, Buccieri K, et al. Gender-Specific Neuroimmunoendocrine Response to Treadmill Exercise in 3xTg-AD Mice[J]. Int J Alzheimers Dis,2010(2010):128354.
[21]Yu F, Xu B, Song C, et al. Treadmill exercise slows cognitive deficits in aging rats by antioxidation and inhibition of amyloid production[J]. Neuroreport,2013, 24(6):342-347.
[22]Kang E B, Kwon I S, Koo J H, et al. Treadmill exercise represses neuronal cell death and inflammation during Abeta-induced ER stress by regulating unfolded protein response in aged presenilin 2 mutant mice[J]. Apoptosis,2013, 18(11):1332-1347.
[23]Um H S, Kang E B, Koo J H, et al. Treadmill exercise represses neuronal cell death in an aged transgenic mouse model of Alzheimer′s disease[J]. Neurosci Res,2011, 69(2):161-173.
[24]Um H S, Kang E B, Leem Y H, et al. Exercise training acts as a therapeutic strategy for reduction of the pathogenic phenotypes for Alzheimer′s disease in an NSE/APPsw-transgenic model[J]. Int J Mol Med,2008, 22(4):529-539.
[25]Herring A, Donath A, Yarmolenko M, et al. Exercise during pregnancy mitigates Alzheimer-like pathology in mouse offspring[J]. FASEB J,2012, 26(1):117-128.
[26]余鋒,徐波,季浏. 自主跑轮运动抑制APP/PS1转基因AD小鼠海马Aβ生成的机制[J]. 北京体育大学学报,2016(6):84-89.
[27]Xia J, Li B, Yin L, et al. Treadmill exercise decreases beta-amyloid burden in APP/PS1 transgenic mice involving regulation of the unfolded protein response[J]. Neurosci Lett,2019(703):125-131.
[28]Fallah-Mohammadi Z, Ebrahimzadeh M, Hajizadeh-Moghaddam A. The Effect of Six Weeks-Voluntary Wheel Running on Brain Amyloid Beta (1-42) Levels of Diabetic Rats[J]. Majallah-i taqīqāt-i ulūm-i pizishkī-i Zāhidān,2013, 15(5):39-42.
[29]吴冰洁,姜建勇,孙咏虹,等. 运动对快速老化小鼠海马β-淀粉样蛋白及淀粉样蛋白前体蛋白的影响[J]. 中华物理医学与康复杂志,2011, 33(1):2-5.
[30]Maesako M, Uemura K, Kubota M, et al. Exercise is more effective than diet control in preventing high fat diet-induced beta-amyloid deposition and memory deficit in amyloid precursor protein transgenic mice[J]. J Biol Chem,2012, 287(27):23024-23033.
[31]Lazarov O, Robinson J, Tang Y P, et al. Environmental enrichment reduces Abeta levels and amyloid deposition in transgenic mice[J]. Cell,2005, 120(5):701-713.
[32]Perin E C, Silva G V, Vela D C, et al. Human hepatocyte growth factor (VM202) gene therapy via transendocardial injection in a pig model of chronic myocardial ischemia[J]. J Card Fail,2011, 17(7):601-611.
[33]Savonenko A, Xu G M, Melnikova T, et al. Episodic-like memory deficits in the APPswe/PS1dE9 mouse model of Alzheimer′s disease:relationships to beta-amyloid deposition and neurotransmitter abnormalities[J]. Neurobiol Dis,2005, 18(3):602-617.
[34]Jankowsky J L, Fadale D J, Anderson J, et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo:evidence for augmentation of a 42-specific gamma secretase[J]. Hum Mol Genet,2004, 13(2):159-170.
[35]Caccamo A, Oddo S, Sugarman M C, et al. Age- and region-dependent alterations in Abeta-degrading enzymes:implications for Abeta-induced disorders[J]. Neurobiol Aging,2005, 26(5):645-654.
[36]Wang D S, Iwata N, Hama E, et al. Oxidized neprilysin in aging and Alzheimer′s disease brains[J]. Biochem Biophys Res Commun,2003, 310(1):236-241.
[37]Farris W, Schutz S G, Cirrito J R, et al. Loss of neprilysin function promotes amyloid plaque formation and causes cerebral amyloid angiopathy[J]. Am J Pathol,2007, 171(1):241-251.
[38]Iwata N, Tsubuki S, Takaki Y, et al. Metabolic regulation of brain Abeta by neprilysin[J]. Science,2001, 292(5521):1550-1552.
[39]Vepsalainen S, Hiltunen M, Helisalmi S, et al. Increased expression of Abeta degrading enzyme IDE in the cortex of transgenic mice with Alzheimer′s disease-like neuropathology[J]. Neurosci Lett,2008, 438(2):216-220.
[40]Leal M C, Dorfman V B, Gamba A F, et al. Plaque-associated overexpression of insulin-degrading enzyme in the cerebral cortex of aged transgenic tg2576 mice with Alzheimer pathology[J]. J Neuropathol Exp Neurol,2006, 65(10):976-987.
[41]Turner A J, Hooper N M. The angiotensin-converting enzyme gene family:genomics and pharmacology[J]. Trends Pharmacol Sci,2002, 23(4):177-183.
[42]Hemming M L, Selkoe D J. Amyloid beta-protein is degraded by cellular angiotensin-converting enzyme (ACE) and elevated by an ACE inhibitor[J]. J Biol Chem,2005, 280(45):37644-37650.
[43]Haass C, Selkoe D J. Soluble protein oligomers in neurodegeneration:lessons from the Alzheimer′s amyloid beta-peptide[J]. Nat Rev Mol Cell Biol,2007, 8(2):101-112.
[44]Yan P, Hu X, Song H, et al. Matrix metalloproteinase-9 degrades amyloid-beta fibrils in vitro and compact plaques in situ[J]. J Biol Chem,2006, 281(34):24566-24574.
[45]Fragkouli A, Papatheodoropoulos C, Georgopoulos S, et al. Enhanced neuronal plasticity and elevated endogenous sAPPalpha levels in mice over-expressing MMP9[J]. J Neurochem,2012, 121(2):239-251.
[46]Eckman E A, Reed D K, Eckman C B. Degradation of the Alzheimer′s amyloid beta peptide by endothelin-converting enzyme[J]. J Biol Chem,2001, 276(27):24540-24548.
[47]Eckman E A, Watson M, Marlow L, et al. Alzheimer′s disease beta-amyloid peptide is increased in mice deficient in endothelin-converting enzyme[J]. J Biol Chem,2003, 278(4):2081-2084.
[48]Ledesma M D, Da S J, Crassaerts K, et al. Brain plasmin enhances APP alpha-cleavage and Abeta degradation and is reduced in Alzheimer′s disease brains[J]. EMBO Rep, 2000, 1(6):530-535.
[49]Tucker H M, Kihiko-Ehmann M, Wright S, et al. Tissue plasminogen activator requires plasminogen to modulate amyloid-beta neurotoxicity and deposition[J]. J Neurochem, 2000, 75(5):2172-2177.
[50]Cracchiolo J R, Mori T, Nazian S J, et al. Enhanced cognitive activity--over and above social or physical activity—is required to protect Alzheimer′s mice against cognitive impairment, reduce Abeta deposition, and increase synaptic immunoreactivity[J]. Neurobiol Learn Mem,2007, 88(3):277-294.
[51]Yuede C M, Zimmerman S D, Dong H, et al. Effects of voluntary and forced exercise on plaque deposition, hippocampal volume, and behavior in the Tg2576 mouse model of Alzheimer′s disease[J]. Neurobiol Dis,2009, 35(3):426-432.
