外排泵抑制剂研究进展
2020-06-15顾觉奋
顾觉奋
(中国药科大学生命科学与技术学院,南京 210009)
细菌耐药性,是21世纪威胁人类健康最重要的元凶之一,也是全球关注的热点。2016年WHO发布的全球耐药菌报告中指出,耐药细菌已蔓延至每一个国家,病原微生物对抗菌药物耐药的形势越来越严峻,控制耐药菌已经成为刻不容缓的公共卫生问题[1]。连续多年的全国细菌耐药监测(CARSS)数据显示,耐亚胺培南肺炎克雷伯菌(IMP-RKPN)、耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素屎肠球菌(VREFM)、多重耐药的铜绿假单胞菌和广泛乃至全耐药的鲍曼不动杆菌的出现,且检出率不断增加,因其所致感染病死率高引起临床广泛关注[2]。人们着手研究病原微生物的耐药性机制,已知的细菌耐药的分子和生化机制包括微生物可以通过产生耐药性酶类催化抗生素失活、靶位的改变、细胞膜通透性的改变、生物膜形成以及外排泵(efflux pumps,EPs)等将抗生素排出细胞外,是临床上固有耐药和获得性多药耐药性(multidrug resistance,MDR)的主要机制[3],尤其存在于耐药革兰阴性菌,如肠杆菌科,不动杆菌属和假单胞菌属中[4]。药物学家们针对这些机制研制药物,克拉维酸等β-内酰胺酶抑制剂已经成功应用到临床上。近年来,以病原微生物细胞膜上的外排泵为靶点研制外排泵抑制剂(effl ux pump inhibitors,EPI)也受到了重视,本文从其作用机制、各类外排泵抑制剂、筛选方法等方面进行了综述,及对三维结构的解析将有助于发现新的外排泵抑制剂。
1 外排泵
外排泵(efflux pumps)是指细菌将胞内的药物或毒性物质排出胞外的蛋白转运系统,在外排过程中需要进行质子交换或水解ATP提供能量。根据氨基酸序列同源性和底物特异性,一般将这些外排泵分为5大类[5]:多药及毒性化合物外排分子家族(multiantimicrobial and toxic compound extrusion,MATE);主要促进剂超家族(major facilitator superfamily,MFS);小多重耐药转运分子家族(small multidrug resistance family,SMR);耐药性结节化细胞分化分子家族(resistance nodulation division family,RND);以及ATP结合盒超家族(ATP-binding cassette superfamily,ABC)(图1)[6]。所有的外排泵家族均由质粒或染色体编码,具有不同的结构形态与底物特异性。在真菌和人体中,涉及药物外排的大多数转运蛋白属于ABC家族外排泵,通常被称为主要转运蛋白,利用ATP水解的能量从细胞中泵出药物。相应的,MFS和SMR,RND和MATE超家族被称为次级多药转运蛋白,利用跨膜质子动力(PMF)或钠/水合氢离子电化学梯度来促使药物从细胞内泵出。
在这些外排泵中,RND家族研究得最为透彻。RND外排泵可以将大环内酯类、氯霉素、四环素类、喹诺酮类和β-内酰胺类药物泵出细菌体外。革兰阴性菌大肠埃希菌有7个不同的RND外排转运蛋白(表1)。转运蛋白可分为两种不同的亚家族,为疏水性和两亲性外排RND(HAE-RND)和重金属外排RND(HME-RND)[7]。
2 外排泵抑制剂作用机制
2.1 已知的5类外排泵的组成和一般作用机制
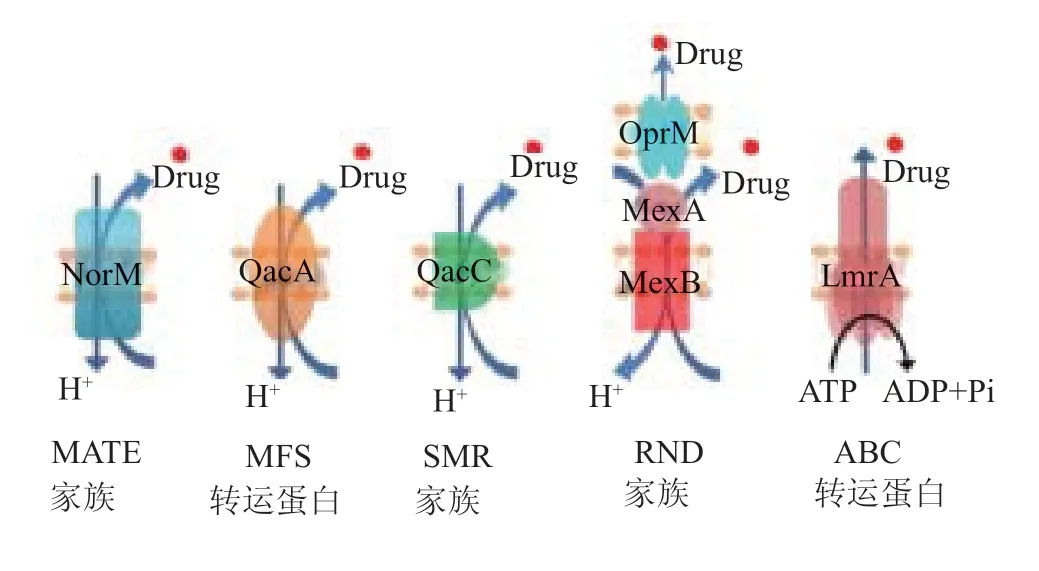
图1 5类外排泵的简单模式图
(1)MATE家族具有12个穿膜结构域,面朝外的构象具有两个向内膜外边层开放的入口,有一个较宽的中心底物结合腔,其作用机制是由质子势能和钠离子浓度梯度共同提供能量将药物泵出胞外[8-9]。例如奥美拉唑(omeprazole)、泮托拉唑(pantoprazoIe)和兰索拉唑(lansoprazole)皆为质子泵(又称H+.K+-ATP酶)抑制剂,它们能迅速穿过细胞膜破坏跨膜电化学梯度,阻断外排泵的能量来源,从而避免药物的外排[10]。
(2)MFS家族由两种不同的蛋白结构域构成,即12碳和14碳跨膜结构,14碳跨膜结构由12碳跨膜结构与输水中央环组成。12碳跨膜蛋白是由一个编码6碳跨膜结构的基因重复表达并在膜内外以轴对称方式形成。两个6碳穿膜α螺旋被称为N、C蛋白结构域,结构域中的多个带电荷氨基酸残基能够与质子结合,利用胞内外的质子浓度梯度提供的化学势能为跨膜转运供能,实现底物在胞内外的转运,其作用机制实质上是一种交替通路机制。
(3)SMR家族转运蛋白较小,只有4个跨膜区。是H+偶联外排泵,即由质子驱动供能的转运蛋白,EmrE是其代表成员之一。其作用机制是前三个跨膜区中保守的氨基酸残基侧链与底物疏水部位结合,药物与带电荷残基的质子交换驱动药物进出输水通道,孔蛋白OmpW参与跨越外膜的EmrE特异性底物的流出[11]。阻断位于外膜蛋白(outer membrane protein,OMP)上的通道分子(如Tolc,OprlvI)来抑制外排泵,是指通过一种纳米 小分子能特异性地结合在外排通道的活性部位上,形成空间位阻,从而更有效地阻碍外排泵通道。
(4)RND家族由36个跨膜的α螺旋构成的三聚体结构,三个单体分别是内膜蛋白(inner membrane protein,IMP)、外膜蛋白(outer membrane protein,OMP)和周质膜融合蛋白(periplasmic membran fusion proteins,MFP)。其作用机制是因IMP决定了外排泵作用底物的广泛性,OMP与IMP为物质转运形成通道,二者与MFP相互作用,促使外排泵系统形成稳定结构,通过进入、结合、外排三个步骤实现底物的转运,药物与活性部位的结合形成过渡态中间产物,降低反应的活化能,促进底物的外排。
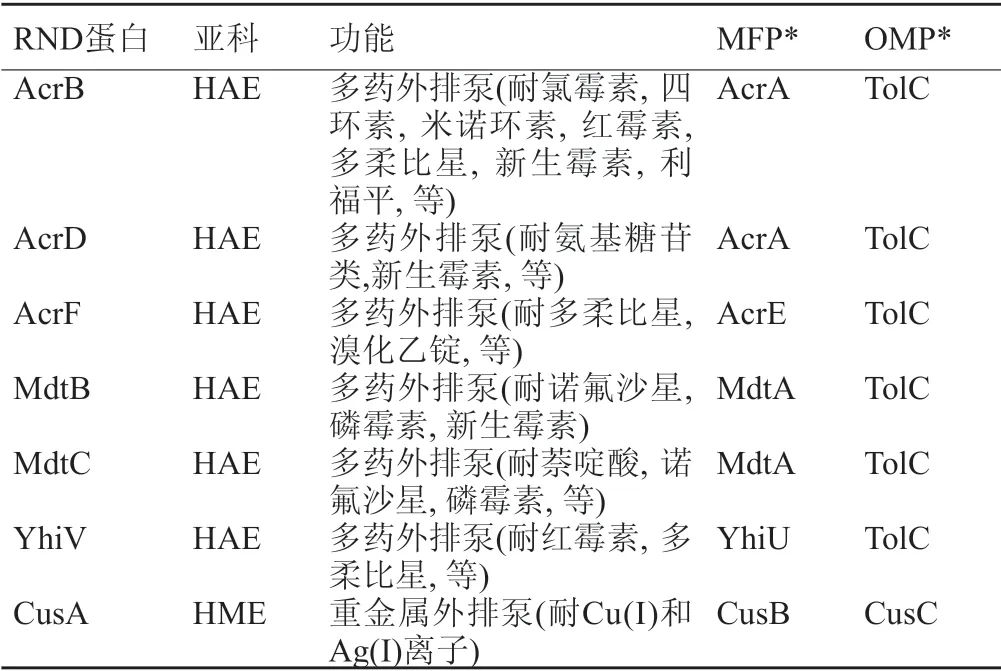
表1 大肠埃希菌的RND外排泵
(5)ABC家族由两个疏水跨膜结构域(TMD)及两个亲水细胞质ATP结合域(NBD)组成。其作用机制是NBD水解ATP为细胞跨膜转运提供能量,TMD与底物特异性结合形成中间产物,通过构象的改变将底物转运至膜外。
2.2 竞争性阻断外排泵上的结合位点
有一类抑制剂与外排泵的活性部位具有较高的亲和力,通过与抗生素竞争细菌外排泵的活性部位来减少药物的外排,人们针对外排泵设计并合成了不同的抑制剂。这些药物并不会直接作用于外排泵产生的多重耐药菌株,而是以抗生素分子通过竞争性地在外排泵上的结合位点,以避免药物的外排。例如,13-CPTC是四环素的一个结构类似物,能竞争性地与细菌B型四环素外排泵结合,阻断外排泵对四环素类抗生素的外排作用,从而躲避细菌将其泵出胞外,胞内最终使浓度达到有效值范围而杀死细胞。
2.3 基因水平抑制外排泵的表达
反义核苷酸或小分子RNA选择性的抑制编码外排泵基因的表达。Liu等[12]报道了铜绿假单胞菌(Pseudomonas aeruginosa,PA)外排泵MexAB-OprM的功能受到了siRNA抑制,分析认为铜绿假单胞菌中可能存在RNA诱导基因特异沉默现象。据此,龚凤云等[13]针对铜绿假单胞菌外排泵MexAB-OprM设计两条siRNA序列,合成了与两条siRNA一致的DNA序列,通过分子生物学的方法将双链DNA序列克隆到pGPU6/GFP/Neo-siRNA载体中,构建siRNA表达载体,采用电穿孔方法转化PA01细胞,通过E-test检测siRNA2干扰PA01,PA01对美罗培南(Meropenem)、头孢他啶(Ceftazidime)、环丙沙星(Ciprofloxacin)的耐药性都明显降低,进一步RT-PCR方法证实siRNA2干扰PA01后外排泵MexAB-OprM中MexB基因的mRNA表达明显下降,上述结果说明应用siRNA分子干扰铜绿假单胞菌外排泵MexAB-OprM的MexB基因,可以降低细菌对抗生素的耐药性,提高铜绿假单胞菌对抗生素的敏感性。
3 外排泵抑制剂
3.1 化学合成来源EPIs(Effl ux Pumps Inhibitors)
3.1.1 化合物Tariquidar
Tariquidar[14]是目前为止第三代MDR调节物中最具前景的代表性药物。它是在筛选哺乳动物ABC族外排泵抑制剂时发现的,特别对P-糖蛋白(P-gp)和哺乳动物乳癌细胞耐药蛋白(BCRP,ABCG2)有很好 的抑制作用。最新报道,第三代P-糖蛋白抑制剂Tariquidar对细菌多重耐药性的抑制作用,将金黄色葡萄球菌29213(SA29213)和1199B(SA1199B,NorA过表达)、铜绿假单胞菌27853、嗜麦芽寡养单胞菌BAA-85分别置于环丙沙星+Tariquidar及无抑制剂条件下,来评估其P-糖蛋白抑制剂的作用。Tariquidar的活性效果在SA1199B中最明显,通过加入tariquidar使环丙沙星的MIC值降低了10倍。Tariquidar本身不是P-糖蛋白的底物,它与P-糖蛋白的结合是特异性的,非竞争性的,它结合在P-糖蛋白的ATP结合位点上,通过抑制ATP酶活性起作用。临床试验表明,联合本品可使多柔比星、紫杉醇、长春瑞滨的IC由2.57,27.4和15.5mmol/L分别降到1.67,20.6和9.5mmol/L,其优点在于其不影响CYP3/A4的代谢。已开发到Ⅱ/Ⅲ临床研究阶段,能恢复癌细胞对化疗制剂的敏感性。
3.1.2 维拉帕米(Verapami,VER)及其类似物
维拉帕米(Verapami,VER)是钙通道阻断剂,近年来用于治疗高血压、心绞痛、心律失常等,研究证明,维拉帕米阻断结核分枝杆菌(M.tuberculosis)的外排泵,能够降低各种抗分枝杆菌药物的最小抑制浓度(MIC)[15]。维拉帕米的原核外排泵抑制机制尚未完全阐明,一些研究认为维拉帕米在生理pH下是质子化的两亲性分子(pKa 9.68),使维拉帕米能溶解在脂质双分子层中,其蓄积可增加细菌膜通透性并干扰膜蛋白的功能。Chen等[16]就维拉帕米与抗结核分枝杆菌药物的协同作用证实了这一研究机制。与一些膜活性剂类似,VER破坏膜功能并诱导膜应激反应,从而与抗结核杆菌药物如利福平或贝达喹啉产生协同作用,为此人们仍将维拉帕米作为开发可用的EPI先导化合物。进一步研究表明R-Verapamil和去甲维拉帕米(Norverapamil,图2)与Verapamil对于降低感染巨噬细胞模型中巨噬细胞诱导的药物耐受性同样有效,在机制层面上也说明了逆转耐药性的机制与维拉帕米类似物的哺乳动物钙通道活性并无直接关系。随后合成了一系列维拉帕米类似物并计算了抑制浓度指数(FICI),对接研究发现其中的化合物7d(图2)显示出最好的协同活性(FICI=0.3),对照组维拉帕米的 FICI为0.5。
3.1.3 化合物PAβN
很多EPI的重要先导化合物,P-糖蛋白抑制剂像利血平和维拉帕米等,金黄色葡萄球菌等革兰阳性菌的外排泵抑制剂而被广泛研究,能减少阿霉素,嘌呤霉素等的泵出。MexB和AcrB革兰阴性菌RND泵具有最广泛的底物特异性,既可泵出中性化合物(如氯霉素)又可泵出酸性化合物(如β-内酰胺类)。Opperman等[17]报道PAβN(MC-207 110,苯丙氨酸-精氨酸β-萘酰胺,Phenylalanyl arginyl β-naphthylamide)作为广谱抑制剂,可抑制铜绿假单胞菌中3种主要RND泵:MexAB-OprM,MexCD-OprJ和MexEFOprN,能有效减少氟喹诺酮等的外排,也可抑制大肠埃希菌的AcrAB-TolC泵。浓度为20μg/mL的PAβN存在时,各种抗生素对MexAB-OprM过量表达的铜绿假单胞菌菌株的MIC均有不同程度的下降,例如氯霉素和司帕沙星的MIC降低128倍,红霉素和左氧氟沙星的MIC降低32倍。其抑制作用可能是运输过程中与药物竞争结合位点的结果。Lamers[18]虽曾报道了PAβN外膜透化活性的理论,随后Misra等[19]最终认为:PAβN的主要作用机制是抑制外排泵活性,而后延长PAβN温育时间,才体现较弱的膜去稳定作用,可能在未充分表达外排泵的细胞中,PAβN的细胞壁透化作用才会被放大。尽管对PAβN结构进行修饰,试图改善活性、血清稳定性,将其急性毒性降低至可耐受的水平,但其结构中固有的两种阳离子基团,导致在组织中长时间的积聚而无法重复给药,以致引起严重的肾毒性,因此,一系列的结构改造均没有取得实质性进展。
3.1.4 化合物SILA421
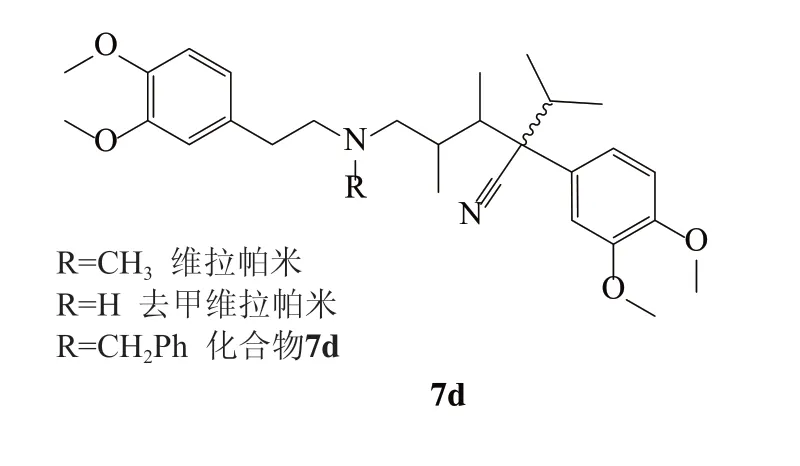
图2 维拉帕米及其衍生物结构
最早由Martins等[20]发现一种对多药耐药、广泛耐药结核(MDR/XDR-TB)有杀灭作用的化合物SILA421,试验了体内外抗XDR-TB活性,发现SILA 421(MIC<3.5mg/L)使非杀伤巨噬细胞转变为有效吞噬细菌杀手,它不仅抑制敏感结核菌和XDR-TB菌,还抑制肿瘤细胞的外排泵活性,使得吞噬体内钾离子和钙离子浓度过高而增加肺巨噬细胞的杀菌效果,且未对人体细胞显示出任何毒性,展现出有潜力成为一种新型抗耐药结核药物。
四年后,Simons等[21]报道,体外单独使用时,SILA-421显示出浓度依赖性和时间依赖性的杀菌活性,能增强异烟肼(Isoniazid,INH)和利福平(Rifampicin,RIF)的对耐多药结核病的疗效,且与INH有良好的协同作用,可防止出现INH暴露后的INH抵抗。然而SILA-421并不能增强莫西沙星(Moxifloxacin,MXF)或阿米卡星(Amikacin,AMK)的效果。此外,SILA-421还可增强RIF对抗RIF菌株的活性,并能够完全清除抗RIF分枝杆菌。遗憾的是,在基因型菌株诱导的结核病小鼠中,异烟肼-利福平-吡嗪酰胺治疗方案中添加SILA-421,13周后并没有观察到增强的疗效[22]。
3.1.5 吡喃并吡啶化合物(MBX2319)及其类似物D13-9001
近二十年来,人们不断尝试开发可用于临床的RND外排泵抑制剂。最早的是拟肽EPI家族,包括化合物PAβN。革兰阴性菌EPIs开发的第二个重要的里程碑便是一系列吡啶并嘧啶EPIs,其代表是D13-9001,作为先导化合物已进入临床前开发阶段。吡啶并嘧啶EPIs对于铜绿假单胞菌的MexAB外排泵具有较强的特异性,对MexXY泵没有活性,这可能是导致其在2007年发展停滞的一个主要原因[23]。MBX2319不具有膜破坏性或内在的抗菌活性,还可增强AcrB底物抗生素的活性,包括氟喹诺酮类,β-内酰胺类,红霉素,氯霉素以及利奈唑胺等,而且对肺炎克雷伯菌、肠炎沙门菌、阴沟肠杆菌和弗氏志贺菌等其抑制活性谱全部涵盖。MBX2319在大肠埃希菌中的主要靶标是完整的膜转运蛋白AcrB。为了深入了解MBX2319抑制的分子机制,Vargiu等[24]利用分子动力学模拟确定MBX2319在AcrB底物结合口袋中的结合位点,并预测MBX2319同D13-9001一样,与AcrB结合在“疏水阱”。不久,Sjuts(法兰克福歌德大学) [25]获取了与AcrBper(一种工程蛋白,由可溶形式的AcrB周质“搬运工”结构域组成)结合的MBX2319的晶体复合物结构,发现MBX2319与T原体的疏水阱结合,在疏水阱中,与深层结合口袋和疏水阱内部的疏水残基相互作用。
3.1.6 Timcodar(VX-853)
Grossman 等[26]关于P-糖蛋白抑制剂Timcodar(VX-853)的研究历久弥新,在体外研究中,当Timcodar单独使用时,对肉汤培养的耐多药结核分枝杆菌(MTB)有着较弱的抑制作用(MIC=19μg/mL);同样条件下,Timcodar与利福平(RIF),贝达喹啉(Bedaquiline)和氯法齐明(Clofazimine)合用,则显示出良好的协同作用;而以巨噬细胞为宿主培养结核杆菌时,Timcodar与RIF,莫西沙星或Bedaquiline联合使用,对耐多药结核病抑制作用 更是提高了约10倍(50%抑制浓度为1.9μg/mL)。Timcodar在小鼠模型中可增强RIF和异烟肼(INH)的作用,减少肺部Mtb负荷,并降低慢性感染的复发率,G rossman等认为,这种增强作用可能是由Timcodar自身的抗菌活性和宿主靶向机制相结合的结果。然而,De等[27]使用时间-杀菌动力学测定法,却发现维拉帕米和Timcodar均不能提高莫西沙星+利奈唑胺抗结核感染的活性。
3.2 微生物代谢来源EPIs
3.2.1 米尔贝霉素(Milbemycins)
米尔贝霉素(Milbemycins)是由几种链霉菌产生的一种十六员大环内酯类抗生素,具有强烈的杀虫和杀螨等生物学活性。ATP结合盒(ABC)多药外排转运蛋白的过表达是对唑类抗真菌剂的临床抗性的重要原因,Niimi等[28]证实米尔贝霉素是真菌多药耐药外排泵潜在的广谱有效抑制剂,他们报道了识别和表征米尔贝霉素抗白念珠菌和光滑念珠菌的多药耐药外排泵,选定酿酒酵母菌株表达,使用了CaCdr1p、CaCdr2p、CgCdr1p、CgPdh1p和ScPdr5p等,每个转运蛋白回应以独特的方式进行了试验。发现细胞过度CaCdr1p抑制突变体(10株)或CaCdr2p (4株)对Milbemycin alpha25呈抗性,每个CaCdr1p抑制突变对其他3个外排泵抑制剂(他克莫司、恩镰孢菌素、白僵菌素)导致不同的反应,也影响了其底物特异性。说明了米尔贝霉素alpha25是通过稳定这些转运蛋白的开放构象来抑制CaCdr1p和CaCdr2p泵的功能。
3.2.2 大观霉素类似物
大观霉素(Spectinomycin)是链霉菌产生的一种氨基糖苷类的抗生素,具有较强的细菌核糖体亲和力,与传统氨基糖苷类抗生素类似,能选择性结合细菌核糖体亚基,从而抑制蛋白质的合成。出乎意料的是,大观霉素抗结核分枝杆菌的活性远不如氨基糖苷类,这可能归因于外排泵Rv1258c对大观霉素大量外排。Lee等[29]通过用各种酰胺羰基连接的官能团取代糖上的酮基,设计了一系列大观霉素类似物(Spectinamides),企图避免细菌的主动外排,其中吡咯和哌啶环,特别是卤素取代的哌啶类似物表现出最好的抗分枝杆菌和抑制外排泵的活性。后续研究获得了酰胺衍生物1599(Spectinamide1599),能够大幅降低各种抗分枝杆菌抗生素(包括克拉霉素,多西环素和克林霉素)的MIC,然而酰胺衍生物1599并不能增强大观霉素的活性,这表明Spectinamide1599并不是通过抑制Rv1258c的外排功能来规避其介导的耐药性[30]。
3.3 天然产物来源EPIs
3.3.1 利血平(Reserpine,RES)
利血平(RES)是被广泛用于治疗轻度或中度高血压且伴有镇静作用的吲哚生物碱。早期的研究表明,RES可以抑制耐甲氧西林金黄色葡萄球菌(MRSA)的四环素外排泵Tet(K),并使四环素对MRSA的MIC从128μg/mL降低至32μg/mL,针对多药耐药性革兰阳性菌,利血平显示的EPI活性涵盖了ATP结合盒(ABC多药外排)超家族和主要促进剂超家族(MFS)。随后,一些学者认为RES可能通过抑制MmpL7,IniA和P27-P55外排泵来逆转MTB对INH和溴乙锭(EtBr)的耐药性。Sun等[31]的研究也证实RES能够降低甚至逆转广泛耐药(XDR)MTB、多药耐药(MDR)MTB对氧氟沙星的耐药性。
3.3.2 粉防己碱(Tetrandrine)
粉防己碱是来源于植物粉防己块根中提炼的治疗支气管哮喘的双苄基异喹啉类生物碱。与维拉帕米类似,粉防己碱是L-型钙通道和P-糖蛋白抑制剂,因此,很可能与维拉帕米相似的机制调节结核分枝杆菌外排泵的活性[32]。Zhang等[33]发现粉防己碱可降低异烟肼(INH)和乙胺丁醇(EMB)对多重耐药MTB的MIC,有效率高达82%,认为将INH或EMB与粉防己碱联合使用不仅提高抗TB效果,且有助于减少药物剂量和副作用。也有报道粉防己碱能提高铜绿假单胞菌对氧氟沙星的敏感性。
3.3.3 小檗碱(Berberine)
小檗碱与胡椒碱在结构上很相似,具有微弱的抗微生物活性,是广泛存在于小檗属植物中的两亲性异喹啉生物碱,也是目前公认的外排泵底物。与抗生素联用时,小檗碱的细胞内浓度增加,抗菌效果增强。由于竞争性抑制外排泵,抗生素效应也有所增强[34]。晶体学研究证实,小檗碱可以通过结合NorA和RamR外排泵,从而抑制多药耐药金黄色葡萄球菌甚至MTB细菌的生长[35]。然而,小檗碱的口服生物利用度明显较低,口服给药后由于胃肠道吸收差,加之严重的首过代谢及P-糖蛋白介导的外排而导致血浆水平低下,因此对小檗碱进行结构改造引起了不少研究人员的重视。
3.3.4 辣椒素和胡椒酚乙酸酯(Capsaicin acetoxychavicol acetates,ACA)
Kalia等[36]用辣椒素(8-甲基-N-香草基-6-壬烯酰胺)与环丙沙星联合测试对金黄色葡萄球菌SA-1199B(NorA过表达),SA-1199(野生型)和SAK1758(NorA敲除)的活性。发现辣椒素显著降低环丙沙星对金黄色葡萄球菌SA-1199和SA-1199B的MIC。此外,辣椒素在MIC浓度下也延长了环丙沙星的抗生素后效应1.1h。证明一种新型的EPI—辣椒素,可以抑制金葡菌的NorA外排泵。
Roy等[37]发现分离自高良姜茎块的苯丙素类调制因子也可以作为耻垢分枝杆菌的外排泵抑制剂。其中1′-S-1′-乙酰氧基胡椒酚乙酸酯(1′-S-1′-acetoxychavicol acetate),反式-对-香豆醇酯(transp-coumaryl diacetate)和1′-S-1′-乙酰氧丁香酚乙酸酯(1′-S-1′-acetoxyeugenol acetate)被认为是强效调节剂,其浓度分别为2.5,6.25和5.0mg/L时,能使溴化乙锭的MIC降低64倍。
3.3.5 锥丝碱(Conessine)
止泻木(Holarrhena antidysenterica)是用作治疗痢疾、发热和细菌感染的传统中草药,其主要活性成分均具有抗腹泻和抗疟原虫的活性。Siriyong等[38]对止泻木的提取物锥丝碱(Conessine)研究发现,本品能够提高广泛耐药鲍曼不动杆菌对抗生素的敏感性,进一步的实验证实MexAB-OprM外排泵参与该机制。在MexAB-OprM过表达的菌株中,Conessine使抗生素的MIC降低至少8倍,对头孢噻肟,左氧氟沙星和四环素的敏感性甚至达到野生型菌株的水平。而在MexB缺陷型菌株中观察到的Conessine与抗生素之间的协同作用则表明,Conessine很可能会抑制铜绿假单胞菌中存在的其他外排系统。
另外,复方清热颗粒能抑制鲍曼不动杆菌的外排泵[39]、穿心莲内酯具有抑制铜绿假单胞菌外排泵MexAB OprM的作用[40]、连翘酯苷B可抑制肺炎克雷伯菌外排泵的活性[41]等都被发现具有外排泵作用。
4 EPIs的筛选方法
随着蛋白质的三维晶体结构的深入研究,人们根据药物与外排泵蛋白的相互作用设计一些外排泵抑制剂(EPI)。经过众多课题组的努力已经完成了一些多药耐药外排泵的X射线蛋白质晶体结构解析工作,为这一领域的研究做出很好的贡献和铺垫。
大肠埃希菌的多药外排泵AcrAB-TolC系统是目前研究比较清楚的一种细菌外排泵。Du等[42]报道AcrAB-TolC系统主要有3个部分组成:膜融合蛋白(AcrA)、外排转运蛋白(AcrB)和外膜通道蛋白(TolC)如图3所示。
4.1 基于药效团数据库的虚拟筛选EPIs
从研究得最透彻的RND(Resistance Nodulation Division)家族出发,RND蛋白超家族多药耐药外排泵的过度表达其中主要原因是微生物耐药性。了解这个过程的分子基础是现代生物医学研究的主要挑战之一,涉及到范围广泛的实验和计算技术。首先可利用药效团模型筛选针对AcrB和MexB外排泵的抑制剂,Ruggerone等[43]报道了用分子动力学计算机模拟RND多药耐药外排泵研究状态,以获得大肠埃希菌和铜绿假单胞菌耐药介导的外排泵功能机制。Aparna等[44]采用基于药效团数据库的虚拟筛选,努力识别对铜绿假单胞菌MexB蛋白(图4)有活性的化合物。根据已知的抑制剂MC-207,110(图5)创建了药效团假说,用药效团模型从数据库筛选了392个天然化合物和195000个合成化合物,根据软件的评分显示出入围的化合物与活性位点的相互作用(图6),使用Glide_XP将入围的化合物与靶蛋白铜绿假单胞菌的MexB对接。
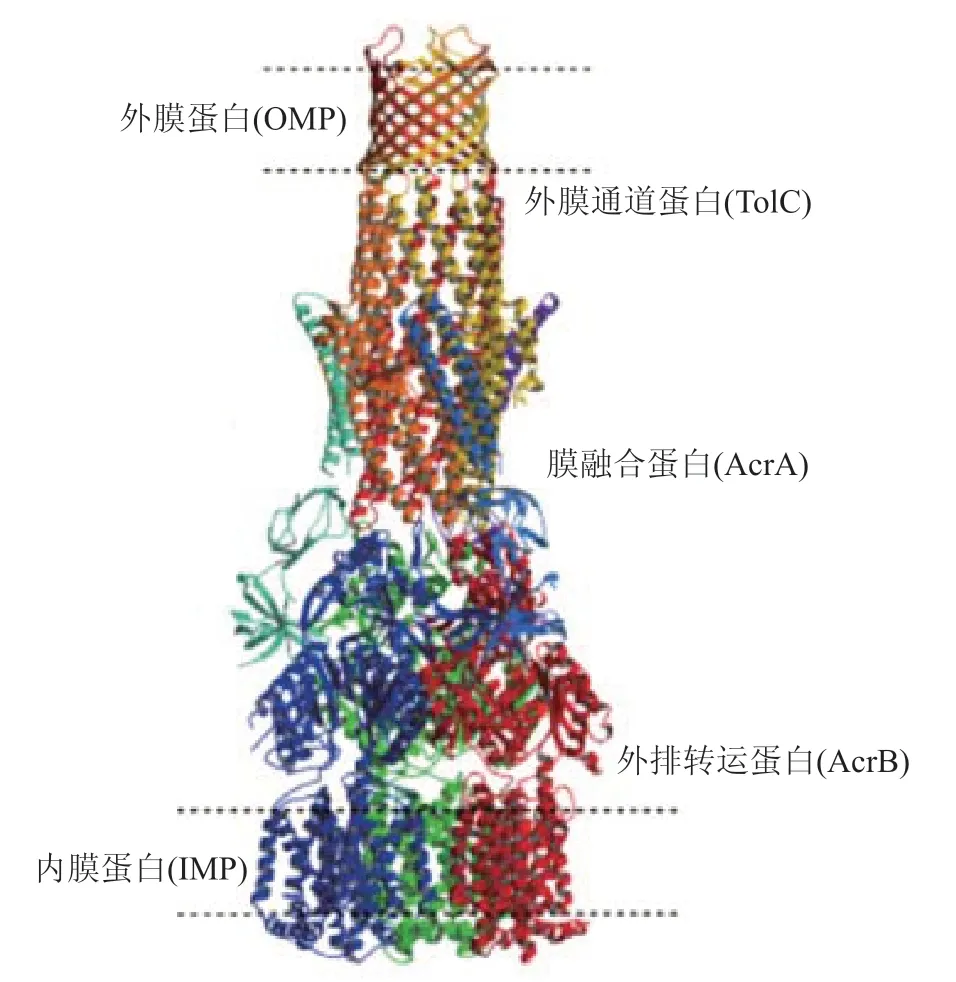
图3 AcrAB-TolC复合物的模型
Aparna团队[45]使用高通量虚拟筛选技术,利用药效团模型筛选针对AcrB和MexB外排泵的抑制剂,最终确定两种对大肠埃希菌和铜绿假单胞菌中AcrB和MexB蛋白有较好抑制活性的天然产物—毛花苷C(lanatoside C)和大豆苷元(Diadzein)。Astolfi等[46]也通过开发两种新型3D药效团模型,筛选出了3个有效抑制金黄色葡萄球菌中NorA外排泵的化合物。当然,模拟筛选出的物质还要用实验进行验证。
4.2 基于定量构效关系(QSAR)的计算机辅助药物设计
分子机制和定量构效关系(quantitative structureactivity relationship,QSAR)的研究对于理性设计、合理修饰,是对先导化合物的结构改造、优化其活性的重要方法。以革兰阴性菌严重耐药的RND外排泵为例,最具临床研究价值的抑制剂是以MBX2319为代表吡喃并吡啶化合物,基于定量构效关系的研究,Nguyen等[47]合成了一系列MBX2319衍生物,并证实化合物22d~f,22i和22k在增强左氧氟沙星和哌拉西林抗大肠埃希菌活性方面比原药更有效。随后该课题组绘制了MBX2319骨架结构的分子活性图谱,鉴别出对外排泵抑制活性至关重要的结构中心,以及可以被修饰以提高活性、代谢稳定性和溶解度结构域,新获得的几个衍生物结构,在原有活性的基础上,具有更优的药代动力学性质[48]。然而,除了吡喃并吡啶类EPIs,由于毒性等因素停滞在临床前或者体外实验的众多EPIs,都需要进一步的结构改进,以获得溶解度更好、清除机制较慢的新化合物以达到体内活性的优化。定量构效关系(QSAR)模型已被证明对预测化合物的活性具有良好的预测能力。
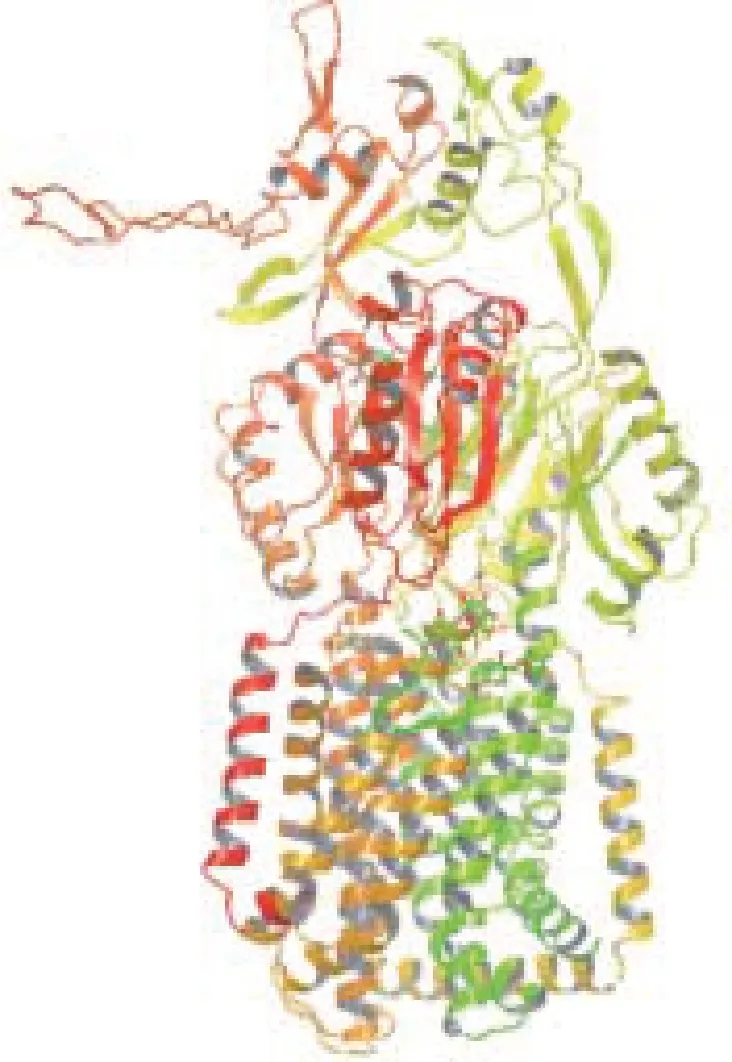
图4 铜绿假单胞菌MexB蛋白质的结构
5 结语
病原菌的多药耐药性是目前临床感染中非常棘手的问题,其中常见的原因之一是细菌的外排泵系统对多种药物的 外排作用。多药耐药外排泵广泛存在于各种病原菌中,对于细菌来说,外排基因占所有转运蛋白基因的6%~18%,如外排系统的过度表达主导革兰阴性菌铜绿假单胞菌耐药性发生,尤其MexAB-OprM在耐药形成中起最主要作用,所以外排基因编码的外排泵是导致其多重耐药的重要机制。大量针对大肠埃希菌的多药外排泵RND型AcrAB-TolC和Mex泵的研究,金黄色葡萄球菌的NorA外排蛋白等,有益于加深人们对细菌多药耐药性机制的认识,揭开了MDR泵的耐药机制的结构与生化基础,更好地理解外排泵之间以及与其他耐药机制之间的协同相互作用,可以为药物的发现提供更多的靶点,对三维结构的解析将有助于发现活性更好的新型外排泵抑制剂。开发安全有效的外排泵抑制剂对提高抗菌药物的抗菌活性和改善临床治疗细菌感染疾病的现状具有重要的意义。
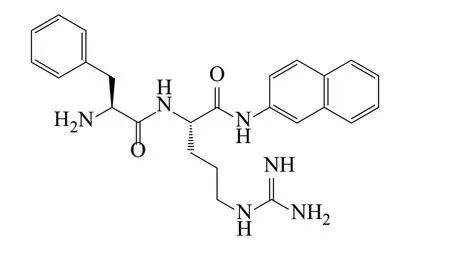
图5 MexB-OprM外排泵抑制剂MC-207,110的结构
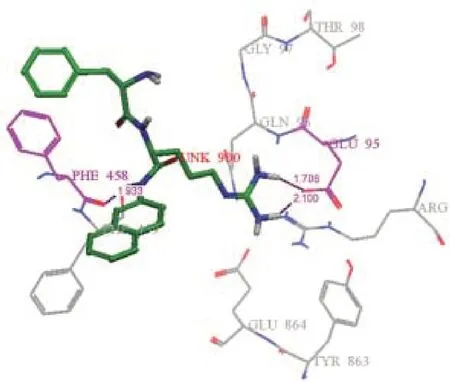
图6 对接显示MexB的活性残基与MC-207,110的相互作用
已经报道的这些来源于化学合成、微生物代谢以及天然产物的各类第三代外排泵抑制剂,有的甚至是广谱外排泵抑制剂(如PAβN),具有逆转广泛耐药性,有的已开发到Ⅱ/Ⅲ临床研究阶段(如Tariquidar),还通过基于药效团数据库的虚拟筛选、基于定量构效关系(QSAR)的计算机辅助药物设计等,来寻找新型外排泵抑制剂。但多数还处于临床前阶段或体外试验,开发能够规避MDR的新型抗生素或临床有效的外排泵抑制剂时,我们仍要接受着无数的挑战,鉴于许多外排泵具有广泛的底物特异性,而临床分离菌株在治疗期间出现的EP快速选择性过表达,我们必须再一次强调优化抗菌药物联合使用和减少抗生素滥用的重要性。
