谷氨酸棒杆菌增强型表达载体构建及牛α-干扰素表达
2020-06-15孙曼曼方求武刘秀霞杨艳坤白仲虎
孙曼曼, 高 雄, 方求武, 严 豪, 刘秀霞, 杨艳坤, 白仲虎
(1. 江南大学 粮食发酵工艺与技术国家工程实验室; 2. 江南大学 工业生物技术教育部重点实验室; 3. 江南大学 生物工程学院, 无锡 214122)
谷氨酸棒杆菌(Corynebacteriumglutamicum)是一种兼性厌氧的革兰氏阳性工业微生物,广泛用于一些有机酸的合成[1]。因具有无内毒素、抗逆性强、蛋白酶水平较低等优势,近年来谷氨酸棒杆菌也正逐渐被开发用于外源重组蛋白的表达[2]。
目前能够用于谷氨酸棒杆菌重组蛋白表达的载体较少,常用的有pXMJ19、pEC-XK99E等载体,这些载体大部分仍是基于经典的大肠杆菌Ptac或者Ptrc启动子来表达外源蛋白。尽管近年来也有一些内源启动子以及合成启动子的筛选及应用研究,但总体来看强度高于Ptac启动子的很少,并且基本也都是非诱导型启动子。一些内源诱导型启动子,如对数末期自诱导的Pcg3141以及碳代谢诱导的PmalE1和Pgit1等[3-4],综合本底控制、表达强度以及诱导幅度等方面来看往往无法有效替代Ptac启动子。为进一步提高Ptac启动子在谷氨酸棒杆菌中的表达能力,通过对Ptac启动子进行突变,得到了更强的PtacM启动子[5-6]。而本研究选择对Ptac启动子的5′末端非翻译区进行改造,在出发载体pXMJ19的lacO之后、多克隆位点(Multiple cloning site, MCS)前加入了一段谷氨酸棒杆菌的内源双顺反子结构,使得Ptac启动子能够以双顺反子(Bicistronic)模式表达。改造后的增强型表达载体命名为pSM19。
干扰素(Interferon, IFN)是动物细胞产生的一类具有广谱抗病毒活性的细胞因子,主要分为Ⅰ型、Ⅱ型和近年来新发现的Ⅲ型。Ⅰ型干扰素主要包括IFN-α、IFN-β、IFN-ε和IFN-δ等。其中IFN-α是目前所知抗病毒活性最强的细胞因子,在细胞中扮演着“清道夫”的角色,牛α-干扰素(BoIFN-α)对牛鼻气管炎病毒、牛腹泻病毒、口蹄疫病毒等在内的多种病毒的复制起抑制作用[7]。
BoIFN-α在巴斯德毕赤酵母、昆虫细胞、大肠杆菌中都已有表达的先例,但总的来说真核系统产量较低、大肠杆菌包涵体表达需要复性以及内毒素等问题的存在使其研制始终停留在实验室阶段[8-10]。对于在大肠杆菌表达系统中折叠困难的蛋白,通常会利用助溶标签、分子伴侣共表达或改变培养条件等手段提高可溶性蛋白比例。蛋白诱导表达时降低培养温度有助于诱导分子伴侣的产生从而帮助重组蛋白折叠。张弦等[10]利用pCold Ⅱ冷诱导系统在大肠杆菌中成功实现了BoIFN-α的部分可溶性表达,诱导温度为15 ℃,纯化后折算产量为36 mg/L菌液。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
谷氨酸棒杆菌CGMCC1.15647(CorynebacteriumglutamicumCGMCC1.15647)、大肠杆菌DH5α、质粒pXMJ19,含有EGFP片段的质粒pMD19-EGFP[11],水疱性口炎病毒(VSV)由本实验室保藏。质粒pSM19,pSM19-EGFP,pXMJ19-EGFP,pSM19-BoIFN-α在本研究中构建。所用到的引物见表1,引物、BoIFN-α基因(GenBank: EU276064.1)的合成以及测序工作均由苏州金唯智公司完成。

表1 本研究所用的引物
1.1.2 酶和试剂
所有限制性内切酶均购自Thermo Fisher Scientific;Q5超保真DNA聚合酶购自New England Biolabs;2×EsTaqMasterMix(Dye)购自康为世纪公司;DNA高效连接液、末端转移酶、总RNA提取、反转录试剂购自TaKaRa公司;同源重组酶购自诺唯赞公司;质粒提取试剂盒、PCR产物纯化试剂盒及胶回收试剂盒等购自Axygen公司。
1.2 方法
1.2.1 培养基和摇瓶培养条件
大肠杆菌使用LB培养基在37 ℃培养。如无特殊说明,谷氨酸棒杆菌使用LBB(LB+1%脑心浸出液)培养基在100 mL 摇瓶中培养,装液量10 mL,接种量2%,培养温度为30 ℃,转速为200 r/min。表达BoIFN-α的谷氨酸棒杆菌分别在16 ℃和30 ℃培养,其它条件同上。
抗生素使用氯霉素,终浓度在大肠杆菌中为30 mg/L,在谷氨酸棒杆菌中为20 mg/L。IPTG终浓度为1 mmol/L,接种4 h后添加。
1.2.2 质粒的构建
为得到增强型表达载体pSM19,首先用引物P1/P2对谷氨酸棒杆菌CGMCC1.15647基因组扩增。随后将扩增片段与HindⅢ内切酶线性化过的pXMJ19质粒利用同源重组酶重组,转化大肠杆菌感受态。过夜培养长出单克隆后,挑单克隆做菌落PCR验证,正确后送基因测序。
用内切酶HindⅢ和EcoRⅠ线性化质粒pSM19。利用引物P3/P4对质粒pMD19-EGFP扩增,所得EGFP片段与线性化后的pSM19重组,转化大肠杆菌感受态挑单克隆测序验证得到质粒pSM19-EGFP。
利用引物P4/P5对质粒pMD19-EGFP扩增,所得EGFP片段以及质粒pXMJ19分别用HindⅢ/EcoRⅠ双酶切后连接,转化大肠杆菌感受态挑单克隆测序验证得到质粒pXMJ19-EGFP。
质粒pSM19-BoIFN-α由苏州金唯智公司合成密码子优化的BoIFN-αDNA片段后(C端添加6×组氨酸标签),通过Hind III/EcoR I亚克隆到pSM19中得到。
1.2.3 增强型绿色荧光蛋白强度的测定
将待测的谷氨酸棒杆菌培养物用PBS缓冲液洗涤2次,重悬并将OD600调至0.5左右,使用荧光分光光度计测定荧光强度。激发波长为488 nm,发射波长为507 nm。
1.2.4 RNA提取及转录起始位点的鉴定
4 ℃离心收集菌体,用预冷的PBS缓冲液洗涤2遍,尽量吸去离心后上清。用1 mL Trizol试剂将菌体重悬入含有约1 cm3玻璃珠的破碎管中,并通过Precellys 24高通量细胞破碎仪破碎6次,每次30 s,间隔期间用液氮迅速冷却。破碎后12 000 r/min 4 ℃离心10 min,吸取上清转移至无RNA酶污染的1.5 mL EP管中。随后步骤依照TaKaRa RNAiso Plus(#9108)说明书进行RNA抽提。
提取质量较好,无DNA污染的谷氨酸棒杆菌总RNA,利用cDNA末端加多聚脱氧核糖核苷酸尾法的5′RACE实验进行基因NCgl2826的转录起始位点(Transcription Start Point, TSP)鉴定[12]。反转录引物为P6,PCR鉴定引物为P7和P8。
1.2.5 BoIFN-α干扰素的表达、纯化
将经过密码子优化后的BoIFN-α基因直接合成连接至pSM19载体,电转至谷氨酸棒杆菌CGMCC1.15647中。挑单克隆过夜活化后1∶50转接至新鲜的LBB培养基中。30 ℃培养4 h后开始诱导,IPTG终浓度为1 mmol/L。
利用Applicon 5 L发酵罐放大培养。将BoIFN-α表达菌株过夜活化后以1∶50转接至100 mL LBB培养基中过夜培养,随后将100 mL二级种子全部接至1.9 L A medium(添加4%葡萄糖)培养基[13]。在反应器中以30 ℃、pH 7、溶氧30%、转速400~1000 r/min的条件培养4 h后开始降温,待温度稳定至16 ℃后加入终浓度为1 mmol/L的IPTG诱导表达。
离心收集100 mL发酵液,PBS洗涤1遍,充分悬浮于40 mL裂解缓冲液中。超声破碎后使用AKTA蛋白纯化系统过镍柱纯化。收集纯化后的蛋白,采用BCA法测定蛋白浓度。
1.2.6 BoIFN-α干扰素活性的初步测定
采用MDBK-VSV(牛肾细胞-水泡性口炎病毒)系统测定纯化的BoIFN-α生物活性。1个活性单位(U)定义为抑制50%细胞病变(CPE)的最高稀释度。观察记录CPE,采用Reed-Muench法计算干扰素活性[14]。
2 结果与分析
2.1 NCgl2826 转录起始位点的鉴定
本实验室的前期工作中已经证明了在谷氨酸棒杆菌中将部分内源启动子以双顺反子形式表达后较单顺反子形式更强[15]。相关表达元件结构示意图(图1)显示:核糖体在内源启动子自身的5′端非翻译区(5′ Untranslated region, 5′UTR)被募集并起始内源基因翻译一段小肽,随后移动到额外引入的保守Shine-Dalgarno序列(SD序列)内部时识别终止密码子TAA而脱离,并在这一SD序列的募集作用下从与TAA紧密相连的ATG处起始目的基因翻译。这一结构的增强作用与核糖体的富集以及mRNA二级结构有关[16]。
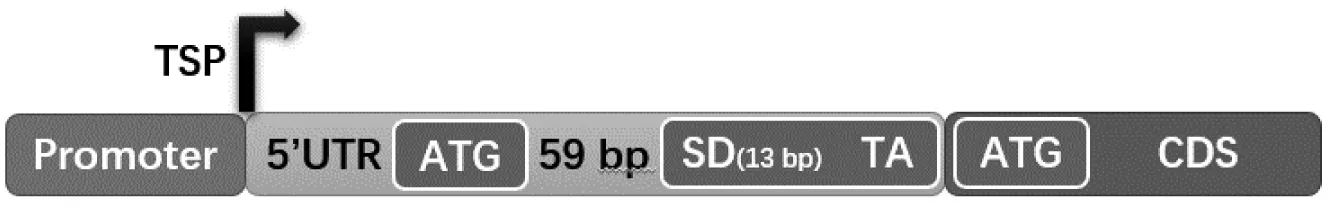
TSP: transcription start point; SD: Shine-Dalgarno sequence
图1双顺反子表达元件结构示意图
Figure 1 Architecture diagram of bicistronic expression elements
同时,在内源启动子的筛选、比较中,我们发现基因NCgl2826启动子双顺反子化表达EGFP时转录水平并没有提高,而表达强度相比单顺反子提高了约2倍[15]。由此推测该基因的双顺反子UTR元件可能具有独立的提高翻译效率的能力,从而与Ptac启动子融合后更好地促进外源蛋白的表达。
为了规避内源启动子序列对双顺反子UTR元件的干扰,我们首先对该基因的TSP进行鉴定,以确定转录出mRNA的完整的5′UTR。如图2所示,5′RACE-PCR扩增后在约300 bp处有一个特异性条带,测序比对后得知该条带对应的TSP位于ATG之前26 bp处。
2.2 增强型表达载体pSM19的构建
出发载体pXMJ19是一个谷氨酸棒杆菌/大肠杆菌穿梭载体[17],其Ptac启动子以及操纵子lacO之后没有核糖体结合位点。为保留其Ptac启动子的IPTG诱导特性,我们选择将NCgl2826的UTR-顺反子元件加入到pXMJ19的lacO之后,MCS之前。
如图3所示,利用引物扩增基因组得到NCgl2826的5′UTR以及ATG之后59 bp的对应DNA片段,引物在该片段5′末端引入一个XhoI酶切位点以方便后续酶切验证,在3′末端引入了一个含有保守SD序列的接头(AAAGGAGGACAACTAATG),使得前顺反子的翻译会在25个氨基酸后遇到终止密码子而停止,脱落的核糖体随即能在SD序列的作用下起始后顺反子的翻译。将该片段以同源重组的方式克隆到pXMJ19的MCS之前,得到了增强型表达载体pSM19。
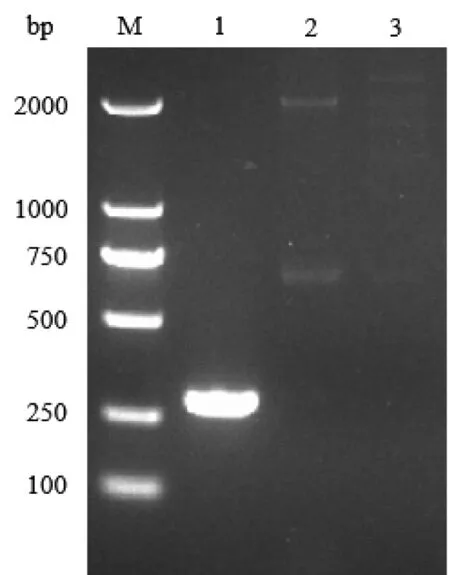
M: TaKaRa DL2000 DNA marker; 1: 5′RACE-PCR amplification products; 2: Single primer amplification control of primer P7; 3: Single primer amplification control of primer P8
图2NCgl28265′RACE鉴定转录起始位点
Figure 2 TSP identification ofNCgl2826 by 5′ RACE

图3 pSM19的构建流程
2.3 EGFP表达对比
如图3所示,由于双顺子UTR元件的引入,pSM19自身已经会从MCS前的ATG处开始表达,因此用经典的酶切连接方式加入目的基因CDS序列时,最少会产生编码两个氨基酸的酶切位点冗余(由HindⅢ酶切位点编码的两个氨基酸)。为了体现比较的一致性,pSM19载体经HindⅢ和EcoR I双酶切后,利用5′端不含HindⅢ酶切位点的同源臂,将EGFP片段引入以消除5′端的HindⅢ酶切位点冗余,得到pSM19-EGFP。与pXMJ19-EGFP载体相比,二者的Ptac启动子、直接启动EGFP表达的SD序列以及CDS部分均完全相同。并且由于pSM19保留了乳糖操纵子lacO,因此理论上仍会受IPTG调控。
将两种质粒分别转入谷氨酸棒杆菌表达菌株中后,分别测定EGFP表达情况。可见pSM19本底(不添加IPTG)略高于原始载体pXMJ19,但在添加IPTG情况下,pSM19的EGFP表达量在24 h高出pXMJ19约99.5%(图4)。

图4 pXMJ19与pSM19 EGFP表达水平比较
2.4 牛α-干扰素的表达
谷氨酸棒杆菌密码子优化的BoIFN-α成熟蛋白基因序列经公司合成后,直接通过Hind III/EcoR I亚克隆到pSM19中。将pSM19-boIFNα质粒转入谷氨酸棒杆菌中进行表达,SDS-PAGE结果(图5)显示,实验组相比对照,在约16 ku处有明显的重组表达条带,但30 ℃培养时,大部分都是包涵体表达,而16 ℃培养时,BoIFN-α大部分能够以可溶形式表达。

图5 SDS-PAGE检测BoIFN-α的表达
2.5 牛α-干扰素的纯化与活性测定
在5 L发酵罐中扩大培养,检测不同时间点的重组蛋白表达情况,可见24 h后BoIFN-α基本不再有积累。发酵结束后离心收集100 mL菌体,破碎后上清过镍柱得到初步纯化后的重组BoIFN-α,其SDS-PAGE电泳结果如图6所示。利用BCA蛋白定量试剂盒测定蛋白浓度,估算重组牛α-干扰素的产量为68 mg/L。利用MDBK-VSV系统测定纯化后重组BoIFN-α的活性为(1.35±0.23)×106U/mg。

图6 5 L反应器中不同时间BoIFN-α的表达情况(a)以及纯化后BoIFN-α的SDS-PAGE分析(b)
3 讨论与结论
本课题对谷氨酸棒杆菌的常用表达载体pXMJ19的5′-UTR部分进行了改造,使得Ptac启动子在保留了IPTG诱导特性的同时又能得到显著增强。改造载体pSM19的MCS与出发载体完全一致,基本能够直接应用后者的克隆和引物设计方式,为谷氨酸棒杆菌中重组蛋白的高效表达奠定了基础。
本研究显示出所使用的5′-UTR双顺反子元件或许能够作为一种独立的蛋白表达增强元件被开发,但其独立性和通用性仍需从3个方面进行考量:不同的5′-UTR双顺反子元件、待表达蛋白以及启动子从转录起始位点前的替换。即不同基因的5′-UTR双顺反子元件是否具有不同幅度的增强功能,它们增强能力的高低趋势是否又会因从转录起始位点处替换不同的启动子,或者从MCS处替换不同CDS而发生变化。
本研究首次在食品级工业微生物谷氨酸棒杆菌中实现了BoIFN-α的部分可溶、且有较强抗病毒生物学活性的重组表达,纯化后产量预估为68 mg/L菌液。然而,革兰氏阳性菌的谷氨酸棒杆菌相比大肠杆菌较难破壁,若能进行分泌性表达则更易于发酵后续的纯化步骤,从而为重组BoIFN-α的研发和生产提供更好的解决方案。Tu等已在巴斯德毕赤酵母中对BoIFN-α进行了分泌表达,产物经纯化后浓度为200 mg/L[8]。谷氨酸棒杆菌同样具有很强的蛋白分泌能力,且发酵周期要比毕赤酵母等真核生物更短。因此,重组BoIFN-α在谷氨酸棒杆菌中的分泌表达是下一步需要解决的问题。
