Protamex 蛋白酶水解大豆蛋白制备啤酒糖浆复配液的研究*
2020-06-15周泓江黄隽光罗建勇史一白黄立新
周泓江 黄隽光 罗建勇 史一白 钱 芳, 黄立新*
1(华南理工大学食品科学与工程学院,广东广州 510640)
2(广州双桥股份有限公司,广东广州 510280)
Protamex 复合蛋白酶是诺维信等生物技术公司从芽孢杆菌属微生物开发生产的一种蛋白酶最适pH 值5.5~7.5,温度35 ℃~60 ℃,是一种被广泛应用的蛋白酶酶制剂。前期研究表明,用Alcalase碱性蛋白酶水解大豆蛋白,其水解液苦味相对较大,对其应用有不良影响,而Protamex 复合蛋白酶即使在低水解度下,水解液苦味不明显,因此被用于酶解鸡蛋蛋白、动物蛋白以及小麦、玉米和大豆等植物蛋白,以及保健食品和医药等领域。
在企业开发啤酒用糖浆和前期试验基础上,发现Alcalase 蛋白酶酶解大豆蛋白的水解原液存在一定的苦味。本文采用Protamex 蛋白酶在不同水解条件下酶解大豆蛋白,研究测定其大豆蛋白酶解液的蛋白质回收率、水解度、α-氨基酸含量、隆丁(Lundin)区分的变化及其SDS-PAGE 凝胶电泳,探讨水解制备大豆蛋白酶解发酵液条件,使之接近或相当于麦芽汁隆丁区分的一般要求:高分子含氮物质占25%,中分子含氮物质占15%,低分子含氮物质占60%,以期具有更好的风味,同样能够与啤酒用麦芽糖浆复配使用,更适于啤酒酿造。
1 材料与方法
1.1 材料
大豆蛋白,山东香驰豆业科技有限公司;Protamex 蛋白酶,活力1.5 AU/g,诺维信公司。
1.2 仪器设备
PHS-3C 型pH 计;FA1004 电子分析天平;KHW-D-1 电热恒温水浴涡;79-3 型恒温磁力搅拌器;JJ-1 增力电动搅拌器;KDN-2C 型凯氏定氮仪;KDN 型消化炉;TDL-5-A 型低速台式离心机;DYCG-30 型电泳槽。
1.3 大豆蛋白酶解液的制备
1.3.1 步骤
准确称量大豆蛋白,加入一定量蒸馏水,搅拌均匀,在80 ℃±2 ℃处理15 min,冷却至预定温度后恒温水浴,调节pH 值至设定值。加入一定量的蛋白酶,配制成设定底物浓度的反应液,缓慢搅拌,反应过程用0.5 mol/L NaOH 溶液滴定维持体系在预定pH 值。反应到预定时间后,立即放入85 ℃水浴中加热15 min 钝化蛋白酶,冷却后在4 800 r/min离心20 min,取上清液,于冰箱冷藏。采用pH-state 法测定大豆蛋白酶解过程的水解度(DH)。
1.3.2 装置图
大豆蛋白酶法水解的装置简图,见图1。
1.4 测定方法
1.4.1 干固物
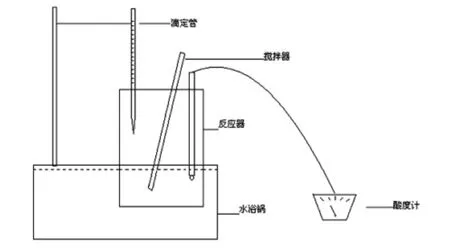
图1 制备大豆蛋白酶解液的试验装置简图
参照参考文献[13]方法测定。
1.4.2 蛋白质
参照GB 5009.5 的标准检测测定,换算系数为5.71。
1.4.3 可溶蛋白回收率(NR)
大豆蛋白粉水解后,计量水解离心后上清液的质量,准确称取约1.000 g 的蛋白水解液,用凯氏定氮法消化、定氮,测定出上清液中蛋白含量,公式为:
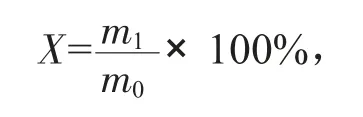
式中:X——蛋白质回收率;
m1——上清液中蛋白质含量;
m0——底物蛋白质含量
1.4.4 SDS-PAGE 凝胶电泳
标准蛋白样和未知样品在同一块凝胶上进行电泳,用标准蛋白迁移率与相对分子质量对数作图,可以获得一条mR-lgMr 标准曲线,根据未知蛋白迁移率,可得到未知样品相对分子质量。
2 结果与讨论
2.1 酶用量对大豆蛋白水解产物的影响
在底物质量浓度5%,反应温度50 ℃,pH 值6.5,酶用量分别为750 U/g、1 000 U/g 和1 500 U/g条件下进行酶解。随着水解的进行,体系pH 值逐渐下降,滴加0.5 mol/L 的NaOH 保持pH 值为6.5。取不同时间段水解液,测量其NR 值、DH 值,以及酶解液Lundin 分布和电泳后分子量分布,测定结果分别见下页图1~图3。
由下页图1(b)可知,随着酶用量和酶解时间增加,水解度呈现逐渐增加的变化趋势。在水解初期,DH 值上升很快,2 h 后上升速度逐渐缓慢,基本保持稳定;当酶用量从750 U/g 增至1 000 U/g时,最终DH 值变化较小,对水解度影响减弱。
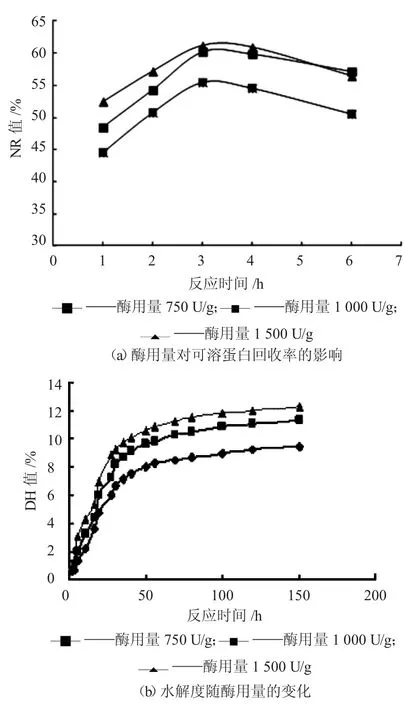
图1 酶用量对可溶蛋白回收率和水解度的影响
由图1(a)可知,随着酶用量增加,NR 值相应增加,当酶用量大于1 000 U/g 时,NR 增加速率降低,与DH 值变化一致。反应时间为3 h 时,NR接近峰值,此后随着时间的延长,NR 值有所减小。该水解是一个复杂的变化过程,在大分子蛋白被水解成小分子蛋白和多肽的同时,这些小分子蛋白和多肽经过相互作用,再次聚集成分子量稍大的蛋白质,使得NR 值减小。
由图2 可知,C 区分在酶解时间超过2 h 后,其含量比例基本都超过60%;酶添加量为1 000 U/g和1 500 U/g,C 区分在酶解1 h 时,其含量比例均超过60%。在A 区分,随着酶用量和酶解时间的增加,其含量比例下降明显,酶用量的影响比较显著;在酶用量相同时,Protamex 蛋白酶酶解大分子蛋白的能力比Alcalase 蛋白酶弱,其A 区分含量比例都相应较高。
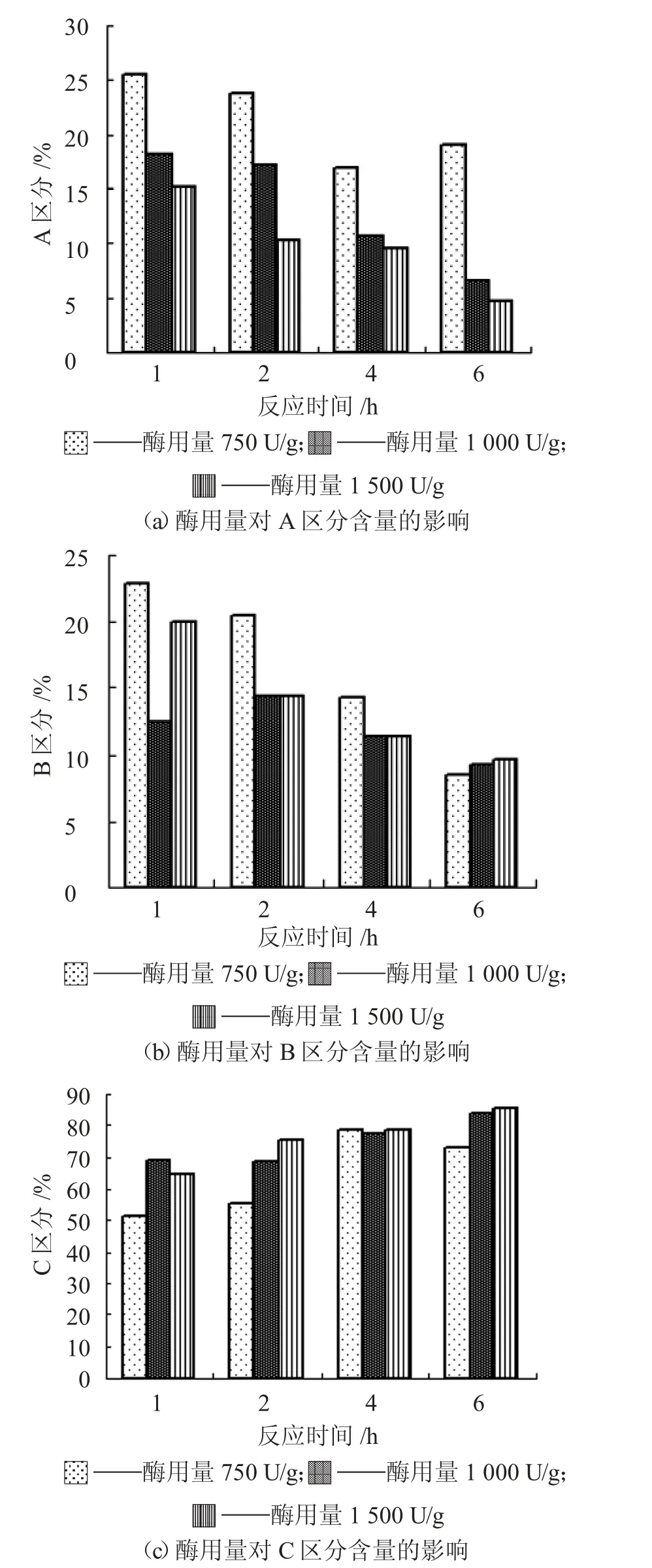
图2 酶用量对Lundin A、B 和C 区分分布的影响
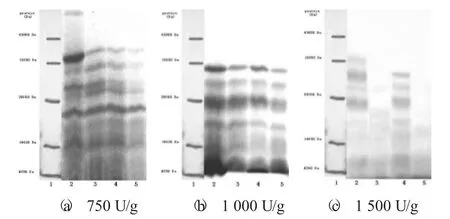
图3 不同酶用量随反应时间变化所得酶解液的SDS-PAGE 凝胶图谱
由下页图3 可知,随着酶用量的增加,酶解液中大分子蛋白呈下降趋势。当酶用量为750 U/g时,反应1.5 h 时仍然有分子量约30×104Da 的蛋白质分子;当酶用量为1 000 U/g,反应1.5 h 时,蛋白分子量几乎都在2.5×104Da 以下;当酶用量达到1 500 U/g,反应1 h 后,酶解液中分子量都在2.0×104Da 以下。
综合成本、NR 值、DH 值,以及反应所得酶解液的Lundin 分布和电泳图的结果,选择加酶量1 000 U/g 为宜。
2.2 pH 值对大豆蛋白水解产物的影响
在底物浓度5%,反应温度50 ℃,酶用量1 000 U/g,pH 值分别在6.0、6.5、7.0 条件下反应,过程中滴加0.5 mol/L 的NaOH 溶液保持pH 值不变。取不同时间段的水解液,测量其NR 值、DH值,以及酶解液Ludin 分布和电泳后分子量分布,测定结果见图4~图6。
由图4 可知,Protamex 属于中性蛋白酶,在中性至微酸性条件下,水解效果较好。随着pH 值的升高,NR 值也逐渐上升;反应初期,NR 值、DH值皆随着反应时间的延长而升高;继续酶解,DH值的增加减缓,到2 h 后趋于平缓;酶解3 h 时,NR 值达到最高值,随后降低,原因可能是部分中小分子多肽重新发生了聚集。
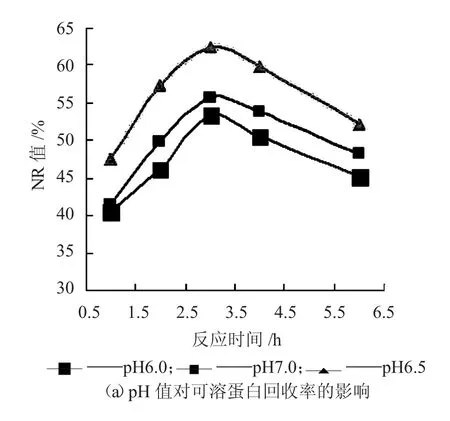

图4 pH 值对蛋白质回收率和水解度的影响

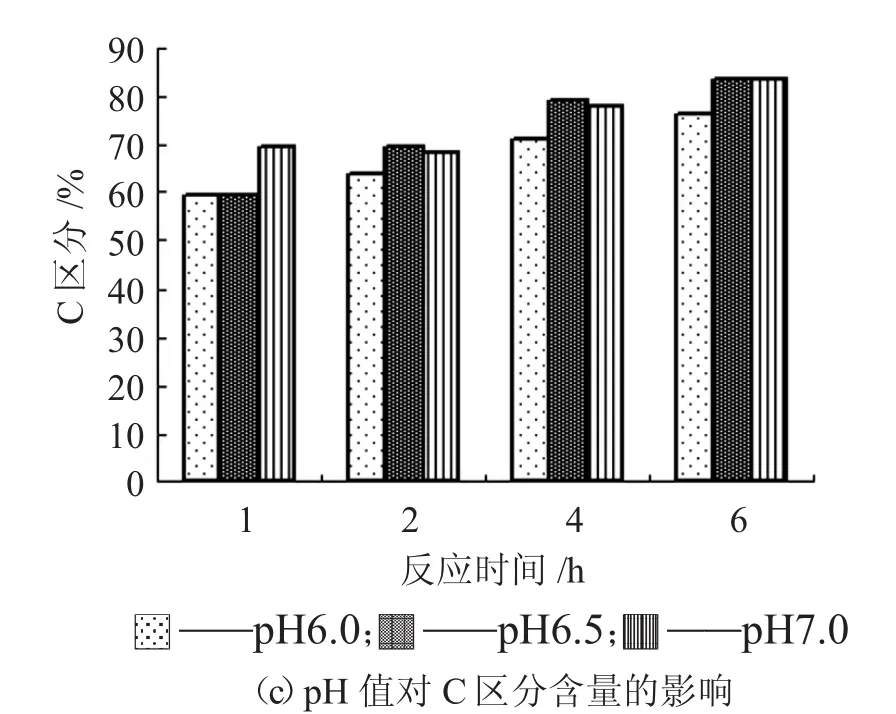
图5 pH 值对LundinA、B 和C 区分分布的影响
由图5 可知,pH 值对Protamex 蛋白酶的影响比Alcalase 的影响大。酶解pH 值增大,随反应的进行,A 区分含量比例降低,C 区分含量增加,1 h后都超过60%。反应2 h~4 h 时,B 区分含量为15%左右。Protamex 对大豆蛋白的水解效果从蛋白的分子量分布上看优于Alcalase 蛋白酶,水解1 h时A 区分含量较接近发酵液要求。

图6 不同pH 酶解下随反应时间所得的酶解液的SDS-PAGE 电泳图谱
由图6 可知,当酶解pH 值为6.0 或7.0 时,反应2 h 后,在2.01×104~3.1×104Da 区间,依然有多条明显的凝胶谱带。在啤酒发酵过程当中,B 区分含量决定了啤酒持泡性和泡沫质量,对B 区分含量要求相对较高。因此,综合考虑NR 值、DH 值和Lundin 分布等情况,选择pH6.5 条件较为适合。
2.3 酶解温度对大豆蛋白水解产物的影响
在底物浓度5%,酶用量1 000 U/g,pH 值6.5,分别在45 ℃、50 ℃、55 ℃条件下进行酶解,过程中滴加0.5 mol/L NaOH 溶液保持pH 值不变。取不同时间段的水解液,测量其NR 值、DH 值,以及酶解液Lundin 分布和电泳后分子量分布,测定结果见图7~图9。
由图7 可知,温度对NR 值、DH 值的影响变化一致,且影响都较显著。Protamex 蛋白酶水解大豆蛋白的机理及动力学研究表明,酶解温度为45℃~50 ℃水解效果较好。酶解温度50 ℃时反应3 h可得到较高的蛋白质回收率值,为63.7%(湿基)。
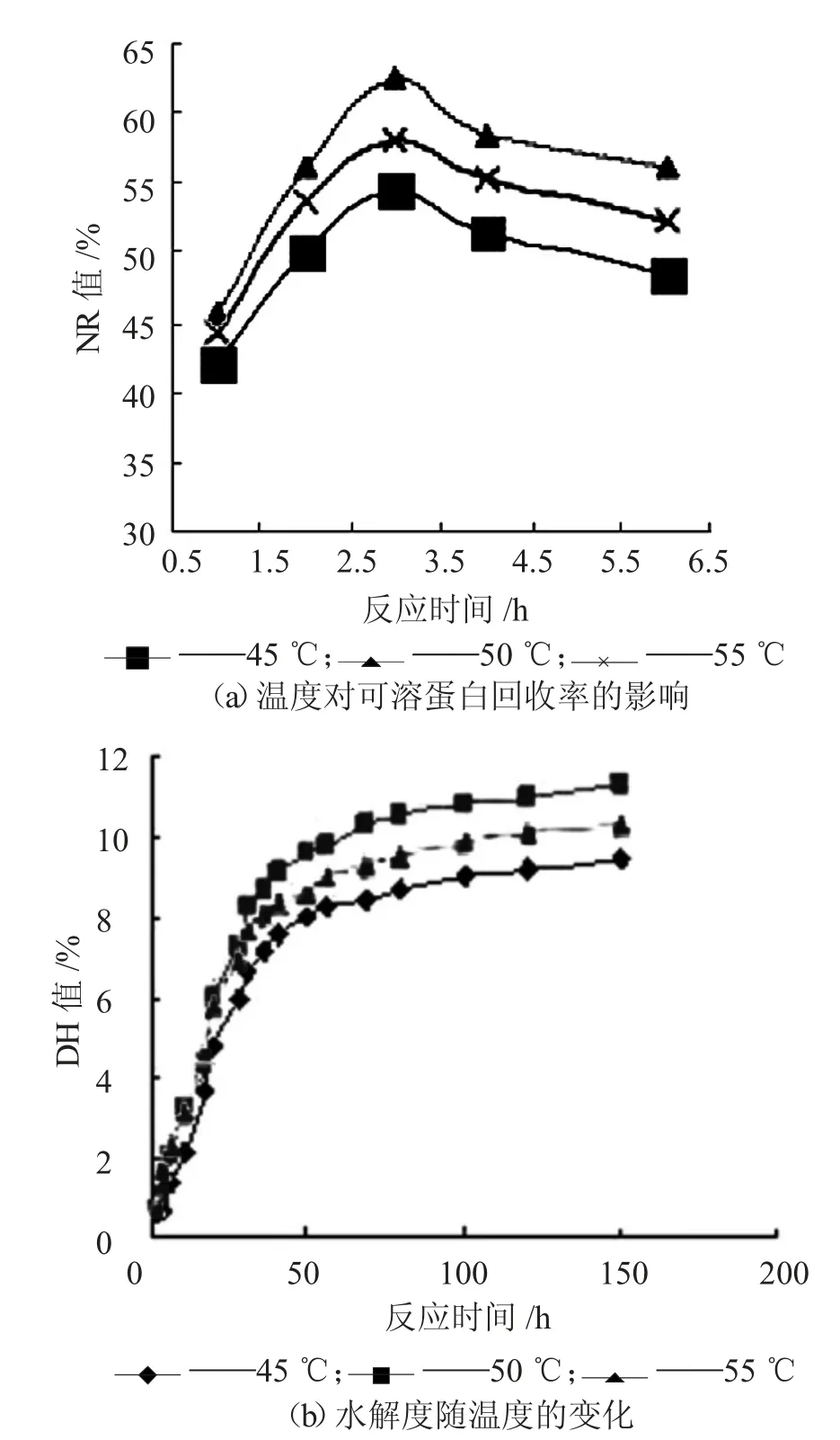
图7 反应温度对蛋白质回收率和水解度的影响
由图8 可知,在本试验温度条件下,酶解1 h~6h,所有酶解液的C区分都大于60%。与45℃和55 ℃相比,在50 ℃的酶解,其Lundin A 和B 区分含量比例最小,C 区分最大,酶解6 h 时,其C 区分含量超过80%,表明50 ℃的酶解效果较好。
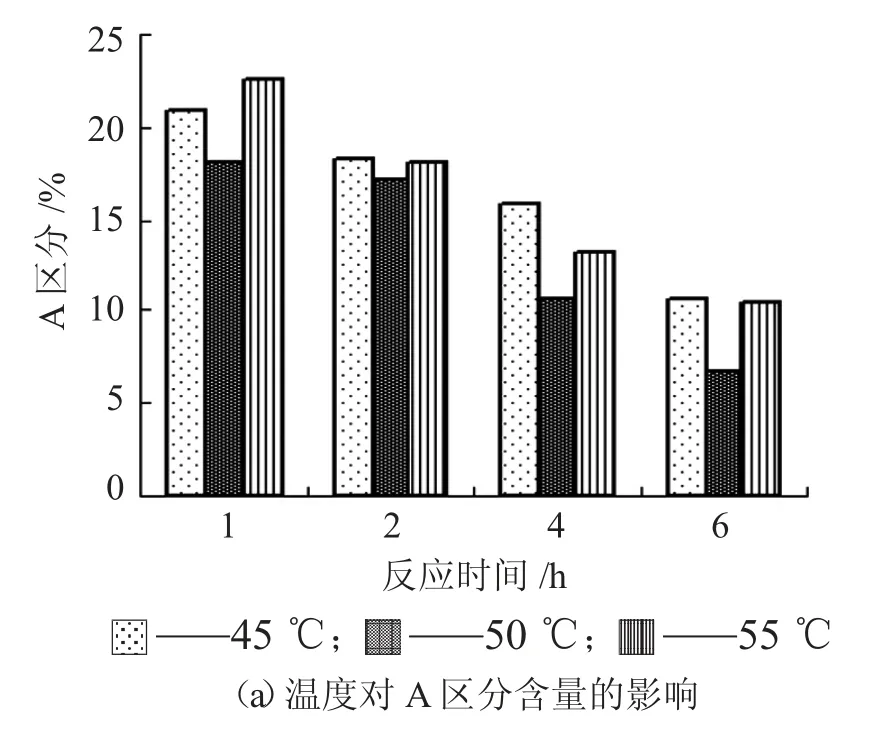
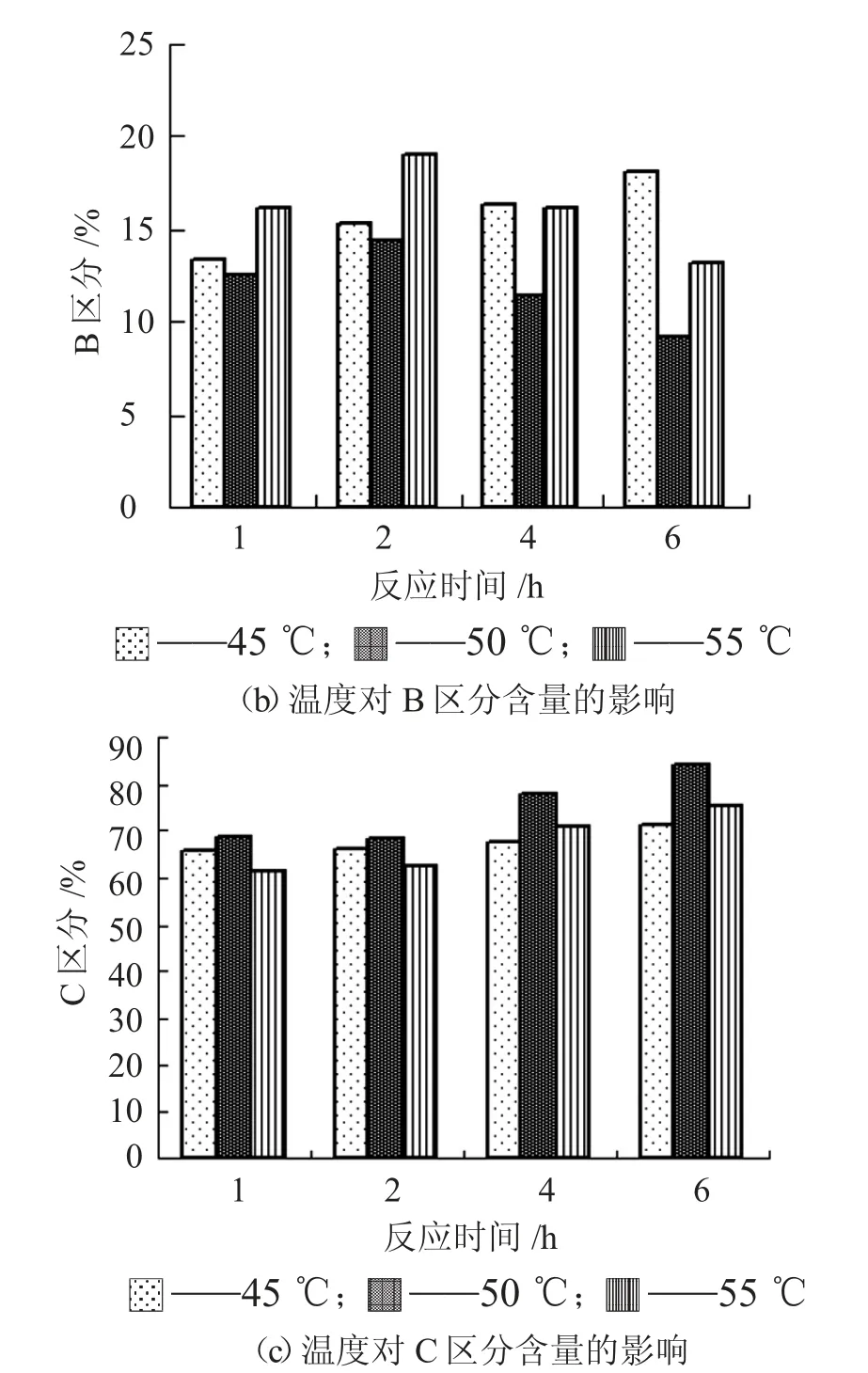
图8 温度对酶解液LundinA、B 和C 区分分布的影响
酶解温度为45 ℃时,A 区分含量随酶解时间的延长而减少,B 区分含量则随时间的延长而增加。酶解时间以1 h~6 h 时,B 区分含量从13%升至17.5%,表明B 区分中分子多肽水解为C 区分小分子肽的数量,小于A 区分高分子肽水解成B 区分中分子肽的数量。
酶解温度为50 ℃和55 ℃时,A 和B 区分含量变化趋势比较一致。其中,B 区分含量都随酶解时间的延长,呈现先增加后减少的趋势,在2 h 时,B 区分含量比例最大,接近或大于15%。

图9 不同温度条件下随反应时间所得SDS-PAGE 电泳图谱
从图9 电泳图可见,随着温度的增加,反应所得酶解液的分子量在3.0×104Da、2.0×104Da、0.6×104Da 均有分布,符合啤酒发酵液所要求的Lundin 分布。综合考虑NR 值、DH 值、Ludin 分布等结果,酶解温度控制在50 ℃~55 ℃之间较为适宜。
2.4 底物浓度对大豆蛋白水解产物的影响
在酶用量1 000 U/g,pH 值6.5,温度50 ℃,底物浓度分别为4%、5%、6%和7%条件下酶解,过程中滴加0.5 mol/LNaOH 溶液保持pH 值不变。取不同时间段的水解液,测量其NR 值、DH 值,以及酶解液Lundin 分布和电泳后的分子量分布,测定结果分别见图10、图11。

图10 底物浓度对蛋白质回收率和水解度的影响
由图10 可知,4%~6%大豆蛋白质量浓度对NR值、DH 值的影响不大,大豆蛋白含量5%~6%的水解效率较高,以后随着蛋白浓度的增大,酶水解效率逐渐下降。蛋白质量浓度超过7%,水解效果变得较差。但是,生产时提高浓度可以减少能耗、提高设备利用率,在保证达到所需水解度的条件下,可根据实际情况选用较高底物浓度。

图11 不同底物浓度条件下随反应时间所得的酶解液的SDS-PAGE 电泳图谱
由图11 可知,随着底物浓度的增加,高分子含量的部分不断增加,当底物浓度在5%时,分子量主要分布在0.7×104Da、1.8×104Da、2.0×104Da和2.8×104Da 左右,当底物浓度为7%的时候,分子量出现超过4.3×104Da 的部分。综上所述,为了实现与麦汁组分相近的酶解液,选择底物浓度为5%较为适宜。
3 结论
通过实验可知,Protamex 酶对大豆分离蛋白有较好的水解效果。为了得到可以用于部分或全部替代麦汁的与糖浆复配的酶解液,所选取的酶解条件并不是最佳水解度的酶解条件。Protamax 蛋白酶水解大豆蛋白的产物,其分子量分布范围较为广泛,当反应时间在1.0 h~1.5 h 时,所得到的酶解液的Lundin 分布较为接近麦汁Lundin 区分分布的要求,而此时的NR 值也在63.7%(湿基)左右。因此,采用Protamex 酶来制取含氮复合糖浆的蛋白复配液是可行的。
Protamex 酶制取糖浆复配含氮酶解液的最佳条件是:底物浓度5%,酶用量1 000 U/g,温度50 ℃,pH 值6.5,反应时间1.0 h~1.5 h。在此条件下所得的酶解液为浅黄色,略带苦味,但弱于Alcalase 蛋白酶酶解大豆蛋白所得酶解液的苦味。
