工业大麻中大麻二酚提取工艺优化和生物活性分析
2020-06-14严江涛常丽张江江黄思齐潘根李建军唐慧娟李铮张翠萍赵立宁李德芳
严江涛,常丽,张江江,黄思齐,潘根,李建军,唐慧娟,李铮,张翠萍,赵立宁,李德芳
(中国农业科学院麻类研究所,湖南 长沙410205)
工业大麻(Cannabis sativa L.)属荨麻目,大麻科,大麻属,一年生雌雄异株的草本植物,偶有雌雄同株。根据古籍记载和出土文物表明[1],大麻是人类栽培利用最早的韧皮纤维作物之一,而中国是大麻的起源地,也是世界上栽培利用大麻最早的国家,野生品种分布广泛,栽培种中的变种和品种最多,品种资源极为丰富。几千年来,人类生活的衣食住行用等各个方面与大麻联系密切,已被广泛应用于粮食、鱼网、绳索、服饰等多个方面。大麻作为我国的原产作物之一,在世界上均有种植,可分为纤维用、药用和籽用。大麻籽中含油量最高可达到36%,主要由不饱和脂肪酸组成。大麻花叶中含有四氢大麻酚(THC),曾一度受到世界范围内的严格管制。药理研究表明,大麻中的主要活性成分是大麻素,目前已知的天然大麻素有110余种,其中四氢大麻酚(THC)、大麻二酚(CBD)是大麻中的主要化学成分,为大麻的次级代谢产物[2]。据文献报道[3-10],目前,CBD(一种淡黄色树脂或者结晶)是大麻产品中应用前景最广阔的一种提取物,具有抗肿瘤、神经保护、代谢和免疫调节、抗炎、抗氧化、保护心血管、抗菌等作用。
当前,CBD的主要提取方法有热回流提取法[11]、酶解法[12]、超声辅助提取法[13]、超临界 CO2萃取法[14]等。CBD是由大麻二酚酸(CBDA)脱羧转化产生,加热对CBD含量有一定的影响;酶法和超临界萃取法条件要求严格、成本高;相比之下,超声辅助提取法最为简便经济。常规分析方法主要有高效液相色谱法(HPLC)[15]、气相色谱法(GC)[16]、超高效液相色谱-串联质谱法(UPLCMS)[17]。但目前关于CBD的生物活性研究还不够深入。因此,对工业大麻中CBD的提取、鉴定以及活性测定对加速其药用进程,具有重要意义。ElSohly等[18]对大麻叶中的化学成分进行统计,共得到528种化合物。到目前为止,己经从大麻叶中分离的化合物包括大麻酚类、萜类、黄酮类、多酚类、生物碱、多糖、有机酸等化学成分,其中大麻酚类含有大麻酚类化合物及其衍生物。目前,从大麻植物中分离得到的大麻素有70多种,主要有四氢大麻酚(THC)、大麻二酚(CBD)、大麻环萜酚(CBC)、大麻酚(CBN)、大麻萜酚(CBG)及其丙基同系物 THCV、CBDV、CBCV和 CBGV等,含有精神活性成分的THC和非精神活性成分CBD为大麻素的主要成分[4]。大麻除了具有抗炎症作用外还有抗肿瘤、抗氧化、抗精神病及神经保护作用。
本研究采用单因素试验,通过检测提取溶剂种类、提取时间、提取次数、提取料液比4个因素对CBD含量的影响,确定工业大麻中CBD的最佳提取工艺,建立CBD的高效液相分析方法,并采用酶联免疫法测定CBD对黄嘌呤氧化酶、多酚氧化酶、ABTS自由基抑制率观测其酶抑制活性和抗氧化能力,以期为CBD的综合利用提供参考。
1 材料与方法
1.1 材料与仪器
供试品种“云麻7号”和“大麻CY”样品采自湖南省长沙市望城坡中国农业科学院麻类研究所试验基地,自然阴干或高温烘干至恒重、粉碎后经100目筛选得到粉末待用;CBD标准品购自上海源叶生物科技有限公司;甲醇、无水乙醇、正己烷、乙酸乙酯均为分析纯,购自国药集团化学试剂有限公司;自由基清除试剂盒、酶抑制试剂盒购自南京建成生物科技有限公司。
KQ5200DV型数控超声清洗器(昆山市超声仪器有限公司);TD5离心机 (长沙英泰仪器有限公司);移液枪(德国艾本得股份公司);电热鼓风烘箱(上海一恒有限公司);Agilent1260高效液相色谱仪(安捷伦有限公司);酶标仪(美国博腾仪器有限公司);0.45μm有机滤膜(津隆)。
1.2 实验方法
1.2.1 色谱条件
色谱柱:Water Xbrige(250mm×4.6mm i.d.,5μm);流动相:0.1%乙酸溶液 ∶乙腈=(25∶75);流速:0.8 mL/min;柱温:25°C;进样量:10μL;检测波长:220 nm。
1.2.2 大麻二酚标准曲线的制作
准确称取0.01 g大麻二酚标准品,以甲醇定容制成母液 (1 mg/mL),用移液枪分别移取1 mg/mL CBD甲醇溶液50μL、100μL、200μL、300μL、400μL加入到容量为5 mL的棕色容量瓶中,-10°C下保存定容至刻度待用。在1.2.1的液相色谱条件下进样分析,以CBD浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.3 初始提取条件下工业大麻中大麻素的提取
经85°C干燥后的大麻花叶粉碎过100目筛,准确称取0.2 g(±20 mg)大麻叶粉末,以料液比为1∶35(g∶mL)加入甲醇溶剂7 mL,初始超声辅助提取3 min,提取一次,静置30 min,超速离心机4000 r/min下离心3min,移取所有的上清液至10mL容量瓶,甲醇定容,摇匀,用2.5mL一次性注射器吸取甲醇提取液过0.45μm有机滤膜至1.5 mL液相瓶备用。利用下列公式计算大麻叶中大麻二酚含量。

x:CBD含量(%)
c:测得样品峰面积带入工作曲线所得的浓度值(μg/mL)
v:溶剂体积(mL)
1.2.4 单因素实验
1.2.4.1 溶剂种类对CBD含量的影响
固定反应条件为:料液比为1∶35(g∶mL),提取次数为2次,提取时间5 min,考察不同提取溶剂(乙醇、甲醇、正己烷与乙酸乙酯混合液V:V=9∶1)对大麻二酚含量(%)的影响。
1.2.4.2 提取时间对CBD含量的影响
固定反应条件为:提取溶剂为甲醇,料液比为1∶35(g∶mL),提取次数为2次,观察不同提取时间(3 min、5 min、10 min、15 min)对大麻二酚含量(%)的影响。
1.2.4.3 提取次数对CBD含量的影响
固定反应条件为:提取溶剂为甲醇,料液比为1∶35(g∶mL),提取时间为5 min,观察提取次数(1次、2次)对大麻二酚含量(%)的影响
1.2.4.4 料液比对CBD含量的影响
固定反应条件为:提取溶剂为甲醇,提取时间为5 min,提取次数为2次,观察料液比(1∶20、1∶35、1∶50)对大麻二酚含量(%)的影响。
工程结构是工程管理专业基础必修课程之一。然而由于该课程的知识体系的复杂性、抽象性和实践性,使得传统的授课方式——黑板板书和口头讲解已经不能让学生将相关知识掌握透彻。因此,如何有效解决工程结构课程教学的这一问题,已成为工程结构课程教学中的一个重要问题。
1.2.5 生物活性试验
1.2.5.1 黄嘌呤氧化酶(XOD)抑制试验
配制1mg/mL的黄嘌呤溶液底物并离心取上清液,配制1×10-6mol/L XOD溶液,移液枪移取1 mL蒸馏水、20μL XOD、1 mL黄嘌呤底物作空白对照加入到比色皿中,其次加入浓度为100μg/mL的 CBD甲醇溶液 xμL(x=20、40、60、80、100)、(1000-x)μL蒸馏水、20μL XOD、1 mL黄嘌呤底物于比色皿中,紫外动力学测定295 nm处溶液的OD值,设定动力学时长为80 s,分别读取0 s、40 s、60 s的OD值。按下列公式计算出ΔA值,将空白对照的ΔA0保持不变,以加入样品的体积为横坐标,抑制率为纵坐标绘制标准曲线。

其中 ΔA1=A40S-A0S,ΔA2=A60S-A0S
1.2.5.2 多酚氧化酶(PPO)抑制试验
首先配制浓度为500μg/mL的L-DOPA溶液作为反应底物,然后配制浓度为1mg/mL的络氨酸酶溶液。移液枪分别移取0μL、900μL、950μL、980μL、1000μL、1010μL CBD液加入到比色皿中,再向比色皿中加入20μL络氨酸酶和1980μL多巴胺底物,在波长为475 nm处测定吸光度,读取0 s、200 s时的OD值,记录下A0s,A200s时的OD值,按下列公式计算出各个浓度下的ΔA值。以加入CBD的体积为横坐标,抑制率为纵坐标,绘制多酚氧化酶抑制活性曲线。
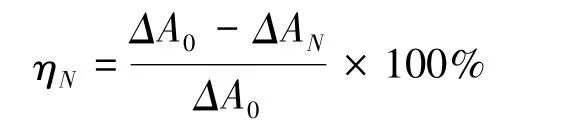
其中ΔA=A200s-A0s
1.2.5.3 ABTS自由基清除实验
配制ABTS原液(7 mmol/L的ABTS溶液与2.45 mmol/L等体积过硫酸钾溶液混合)在室温、避光条件下静置孵育成ABTS储存液,稀释(约50倍)后使得OD734=0.7±0.02。用甲醇配制成10、60、100μg/mL不同浓度的大麻二酚溶液。取100μL样品溶入2000μL ABTS工作液,振荡混合,放置于暗处5 min测定OD734值,重复3次,取平均值,用超纯水代替样品作为对照。按下列公式计算样品的ABTS自由基清除能力。
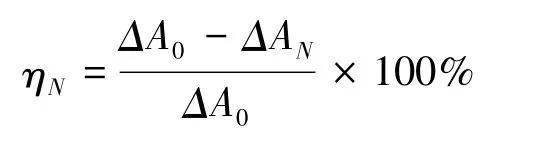
式中:A0为对照品的吸光度,A1为样品的吸光度
2 结果
2.1 大麻二酚标准曲线
以CBD质量浓度为横坐标,高效液相色谱峰面积为纵坐标绘制CBD标准曲线,见图1。由图可知:CBD浓度与峰面积在10~100μg/mL之间存在良好的线性关系,标准曲线回归方程为y=44.814x+14.125(R2=0.9995)。图2为工业大麻花叶中大麻素成分的高效液相分离图谱,CBD的保留时间为10.8 min。
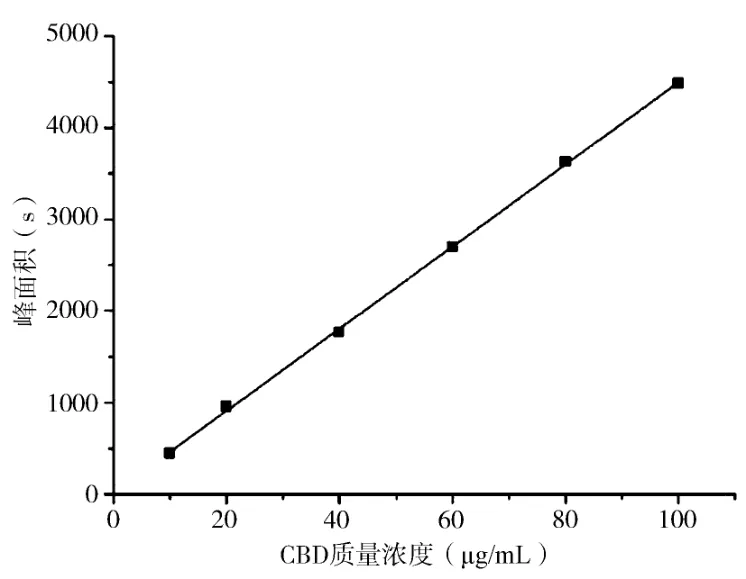
图1 大麻二酚标准曲线Fig.1 Standard curve of CBD

图2 大麻二酚标准溶液系列色谱图Fig.2 HPLC of CBD series
2.2 初始提取条件下大麻中大麻二酚的提取
利用公式计算大麻叶中大麻二酚含量发现:初始提取条件(料液比1∶35、提取溶剂甲醇、提取1次、超声时间3 min)下,大麻二酚含量为0.15%±0.001%。
2.3 单因素试验结果
2.3.1 溶剂种类对CBD含量的影响
在料液比为1∶35(g∶mL),提取次数2次,提取时间5 min条件下,观察不同溶剂对CBD含量的影响。结果发现:正己烷:乙酸乙酯(9∶1)的提取效果略好于甲醇(图3,综合考虑色谱基线稳定、杂质效应影响、试剂成本、试剂毒性及提取效率等因素,我们选择甲醇作为CBD提取的最佳溶剂。

图3 不同提取溶剂对CBD含量的影响Fig.3 Effects of different solvents on the content of CBD
2.3.2 提取时间对CBD含量的影响
用甲醇作为提取溶剂,在料液比 1∶35(g∶mL)条件下提取 2次,观察提取时间(3 min、5 min、10 min、15 min)对CBD含量的影响。由图4可知,不同超声时间对CBD含量的影响较大,超声10 min时CBD的提取效率最佳,含量最高。继续延长超声时间反而降低了CBD的含量。因此,超声10 min为CBD提取的最佳条件。

图4 不同提取时间对CBD含量的影响Fig.4 Effects of different extraction time on the content of CBD
2.3.3 提取次数对大麻二酚含量的影响
用甲醇作为溶剂,在料液比为1∶35(g∶mL),提取时间为10 min的条件下,观察提取次数(1次、2次)对CBD含量的影响。结果见图5。“云麻7号”和“大麻CY”第一次提取CBD的含量占各自提取总量的92%和95%,增加一次提取次数CBD含量仅有轻微增加,表明两次提取便能充分得到工业大麻花叶中的CBD。
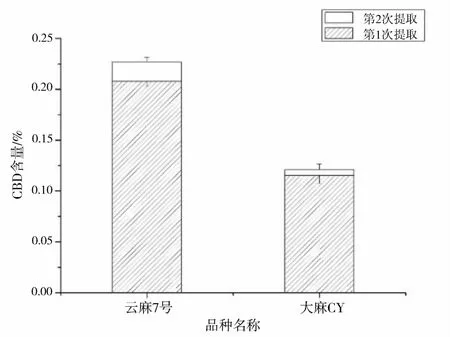
图5 不同品种不同提取次数对CBD含量的影响Fig.5 Effects of different varieties and extraction times on the content of CBD
2.3.4 料液比对大麻二酚含量的影响
用甲醇作为溶剂,提取10 min,提取次数2次,考察料液比(1∶20、1∶35、1∶50)对CBD含量的影响,结果发现:随着料液比的增加,CBD的提取含量逐渐下降(图6),推测相同质量的大麻花叶使用的溶剂量的增多在一定程度上能抑制对CBD的提取。因此,1∶20的料液比为CBD提取的最佳选择。

图6 不同料液比对CBD含量的影响Fig.6 Effects of differentmaterial-liquid ratio on the content of CBD
2.3.5 方法验证试验
为了验证单因素分析的可靠性,采用上述最佳工艺参数进行验证试验,3次平行实验结果表明:优化后大麻二酚成分得率的平均值为0.171%±0.004%,相对于初始提取条件下得率提高了14%。
2.3.5.1 稳定性试验
按2.3项方法对2 mL大麻提取液在0 h、2 h、4 h、6 h、8 h、10 h的含量进行测定,共6次,测得RSD为0.82%,表明提取液在10 h内稳定。对提取液每隔24 h测定一次含量,共三次,测得平均RSD为6%,表明提取液随时间延长稳定性降低。
2.3.5.2 重复性试验
准确称取一定量处理过的大麻叶片6份,按照上述提取优化条件,在1.2.1色谱条件下进样分析,测得大麻二酚峰面积,计算大麻二酚含量,RSD为1.8%,表明优化方法重复性好。
2.3.5.3 加标回收率试验
向已知量的提取液中加入大麻二酚标样,定容至10 mL,在2.3的色谱条件下进样分析。结果表明平均加标回收率为97.38%,RSD为1.5%,表明优化方法准确度高。
2.4 CBD体外生物活性分析
2.4.1 黄嘌呤氧化酶(XOD)抑制试验结果
由图7、图8可知,由40 s和60 s的抑制率曲线得到线性方程分别为:y=40.14x+3(R2=0.9479);y=39.04x+9.94(R2=0.8873),计算得出 IC50(40s)为 1.18μg/mL,IC50(60s)为1.03μg/mL。CBD对黄嘌呤氧化酶的抑制能力随着其质量浓度的增加而增加,成正比例关系,与张晨辉[18]总结的药用植物中黄嘌呤氧化酶抑制剂的研究进展一文中各类药用植物对比,大麻二酚对XOD的抑制活性大于沉香树叶(1.35μg/mL)和荷叶总生物碱提取物(IC50为3.313μg/mL)以及其它各类中药提取物(IC50为8.3~46.7μg/mL),说明CBD具有较强的黄嘌呤氧化酶(XOD)抑制能力。

图7 40s CBD对XOD的抑制率曲线Fig.7 The surppression curve of CBD against XOD
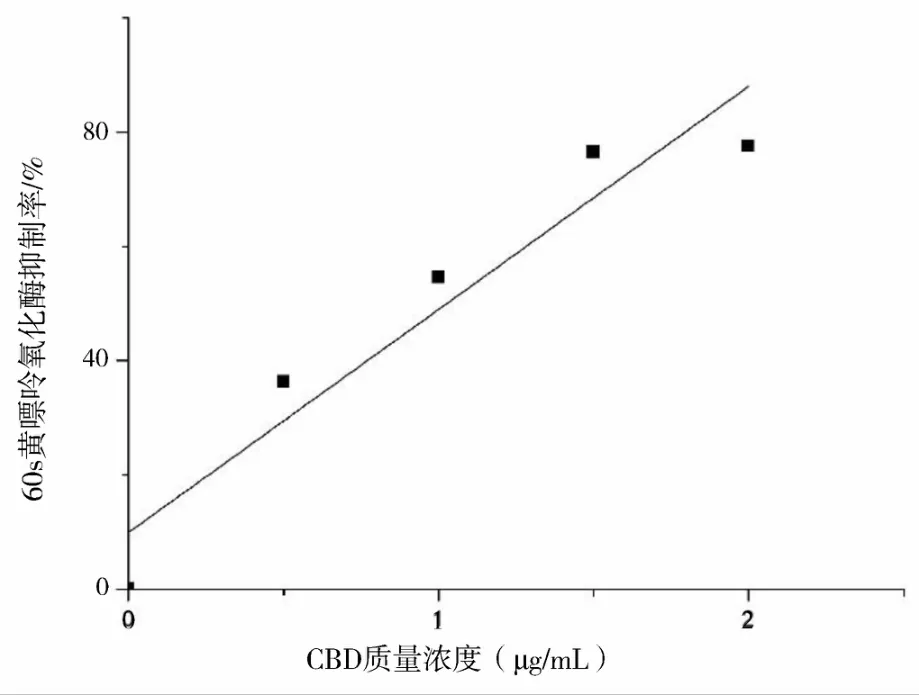
图8 60s CBD对黄嘌呤氧化酶抑制率曲线Fig.8 The surppression curve of CBD against XOD
2.4.2 多酚氧化酶(PPO)抑制试验结果
由图9可知CBD对多酚氧化酶酶抑制活性线性方程为:y=10.012x+0.068(R2=0.9999),计算得到IC50为4.99μg/mL,CBD对多酚氧化酶的抑制能力类似黄嘌呤氧化酶的情况,其抑制能力随着CBD质量浓度的增加而增加,成正相关,表明大麻二酚具有较好的多酚氧化酶(PPO)抑制能力[19]。

图9 CBD对多酚氧化酶抑制率曲线Fig.9 The inhibiting curve of CBD against polyphenol oxidase
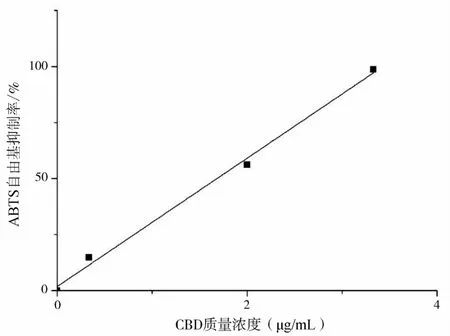
图10 CBD对ABTS自由基清除率曲线Fig.10 The clearance curve of CBD against ABTS
2.4.3 ABTS自由基清除实验结果
由图10可知大麻二酚多酚氧化酶酶抑制活性线性方程为:y=28.605x+1.869(R2=0.9955),计算得出 IC50=1.68μg/mL,其抑制效果强于虾青素对 XOD的抑制效果(IC50为1.84μg/mL)[20]。大麻二酚对ABTS自由基清除率随着其质量浓度的增加而随之增加,成正比例关系,说明低浓度的大麻二酚清除ABTS自由基能力弱,抗氧化能力弱,高浓度的CBD对ABTS自由基清除能力较强,抗氧化能力强。
3 讨论与结论
张爱芝等[21]通过超高效液相色谱-串联质谱(PLC-MS/MS)内标法测定食用油中痕量四氢大麻酚、大麻酚和大麻二酚。吴忠平等[22]采用气相色谱-质谱(GC-MS)结合准确质量测定方法,利用保留指数、特征碎片丰度以及高分辨准确质量数据信息,快速鉴定样品中的合成大麻素组分。本研究中,通过溶剂种类、提取时间、提取次数及料液比优化工业大麻中大麻二酚(CBD)超声提取工艺[24];另外使用HPLC外标法检测大麻二酚(CBD)进行方法验证,通过稳定性、重复性及回收率试验建立大麻花叶中大麻二酚(CBD)的HPLC定性定量检测方法。最后,通过对大麻二酚进行XOD、PPO酶抑制和ABTS自由基清除试验对其活性进行研究,表明大麻二酚具有一定的酶抑制活性和自由基清除能力。
采用单因素试验优化工业大麻中CBD的超声提取工艺,其优化条件为:溶剂为甲醇,提取时间10 min,提取次数2次,料液比为1∶20(g∶mL)。建立大麻中CBD的高效液相分析方法,在此优化条件下通过验证试验测得CBD含量为0.171%±0.004%,相对于初始提取条件下的得率提高了14%,验证试验表明,该方法重复性好,准确度高(RSD=1.8%),加标回收率高,平均回收率为97.38%(RSD=1.5%),适用于工业大麻花叶中CBD的定性和定量分析。
CBD的生物活性研究表明,CBD对 XOD、PPO、ABTS自由基的 C50分别1.18μg/mL(40s),1.03μg/mL(60s)、4.99μg/mL和 1.68μg/mL,CBD对 XOD、PPO具有一定的抑制能力,高浓度的CBD对ABTS自由基也具有很强的清除能力,说明CBD具有很大的药用价值。该研究结果为大麻二酚的体外生物活性研究提供了前期基础。
