美国药品风险评估与减轻策略的简介及启示
2020-06-13蔡洋洋
蔡洋洋,梁 毅
(中国药科大学,南京 211198)
1 美国药品风险评估与减轻策略概述
1.1 风险评估与减轻策略的发展历程
美国药品风险评估与减轻策略(Risk Evaluation and Mitigation Strategy,REMS)是FDA衡量药品效益大于风险的有效措施,是管理药品和生物制品的已知或潜在相关风险的策略。2005年,FDA发布了风险最小化行动计划(Risk Minimization Action Plan,RiskMAP)指南文件,旨在最大程度地降低药品已知风险,同时保留其治疗效果[1]。
2007年9月27日,美国发布《2007年食品药品管理法修正案》(FDAAA),在“上市后研究与监测”章节增加“505-1 REMS”条款,指出FDA有权在必要情况下,要求药品上市许可持有人在新药注册时递交REMS评估报告,以确保各处方药和生物制品的效益大于风险。对于已获得批准上市的药品,如果有新的药品安全方面的信息,FDA也有权要求药品上市许可持有人递交REMS[8]。由此,REMS项目正式启动。
2011年,FDA启动了REMS整合计划(REMS Integration Initiative),旨在评估和改进REMS的实施。该计划的参与者包括患者、制药企业、医疗保健提供者等,通过各方参与者的反馈来了解REMS的实施情况以及需要改进的目标[1]。2013年12月,在线REMS门户网站(online REMS pharmacy portal)的推出为附REMS要求的药品的使用带来了更大的便利性,有效缩短REMS的管理时间[2]。2015年6月15日,REMS@FDA网站创建完成,真正实现了REMS资源的整合。2019年4月4日,FDA发布《REMS:FDA在确定何时需要REMS时对法定因素的应用》最终指南[3],REMS项目日趋完善。
1.2 REMS实施范围
REMS适用于处方药的新药申请(new drug application,NDA)、生物制品许可申请(biologics license application,BLA)和简略新药申请(abbreviated new drug application,ANDA),但不适用于非处方药[4]。REMS在实施过程中会增加医疗保障的负担,因此并不是所有的药品都需要实施REMS。FDA会通过评估确定该药品是否符合FDAAA 505(a)(1)条款下的6个因素,来确定是否需要REMS以及需要哪类REMS。
这6个因素包括:① 与药物有关的任何已知或潜在不良事件的严重性,以及此类事件在可能使用该药物的人群中的背景发生率。② 药品对疾病或症状的预期效益。在评估药物对特定疾病或症状的预期效益时,FDA会评估药物有效性的有关信息,药物是否治疗严重疾病或症状,是否填补了未满足的医疗需求,以及是否可以治愈疾病或缓解症状。③ 药品所治疗疾病或症状的严重性。待治疗的疾病或症状越严重,在效益-风险评估中,该药物所测疗效的潜在效益就越大。④ 药品是否是新分子实体。由于新分子实体使用风险的不确定性,FDA可能需要REMS来帮助确保该药物的益处大于其风险。⑤ 药品治疗的预期或实际持续时间。长期治疗的药物、短期治疗的药物、只服用一次或两次的药物、治疗完成后发生严重不良反应的药物,FDA按照不同的决策依据决定是否要求REMS[10]。⑥ 可能使用该药品的患者人数估计值。
1.3 REMS要素
如果FDA确定需要执行REMS,则FDA可能会要求REMS包含一个或多个要素,其中包括药物指南(medication guide)、患者手册(patient package insert)、沟通计划(communication plan)、用药安全保障措施(elements to assure safe use,ETASU)、实施系统(implementation system)[6]。
药物指南或患者手册包括药品相关的重要安全信息,需由药师在发放药品时一同发放。某些情况下,药物指南会用说明书代替。沟通计划由持有人提供,向医疗服务人员提供有关药物风险的信息和培训,包括医护人员信函、安全措施相关的针对性信息和专业组织机构针对药物风险和安全使用提供的信息等。用药安全保障措施是REMS计划中最广泛的组成部分,是医护人员在开具处方、分发和使用药物前执行的具体行动。对于通过药物指南或患者手册不能减轻已知严重风险的药品,则需要使用ETASU来减轻用药风险。ETASU要求REMS申请人采用严格的控制系统或者提出要求来确保药品的适当使用。实施系统通常要求包括ETASU及如何实施ETASU,通常要求REMS申请人对负责ETASU部分的医护人员进行评估和监测[5]。最后,REMS通常还需要包括一个评价报告时间表(time table for submission of assessments),需要申请人在REMS首次获得批准后第18个月和第3年提交评价报告,以及在批准上市后第7年提交评价报告[7]。
2 REMS实施现状
2.1 附REMS要求获批的新药
通过查阅美国FDA官网有关新药注册审批和REMS政策进展等内容,总结得到相关数据(见表1)。2011~2018年,有309个新药获得FDA批准,其中包括236个NDA和56个BLA。在此期间,附REMS要求获批的NDA有57个,占总获批NDA的24.2%;附REMS要求获批的BLA有13个,占总获批BLA的23.2%。
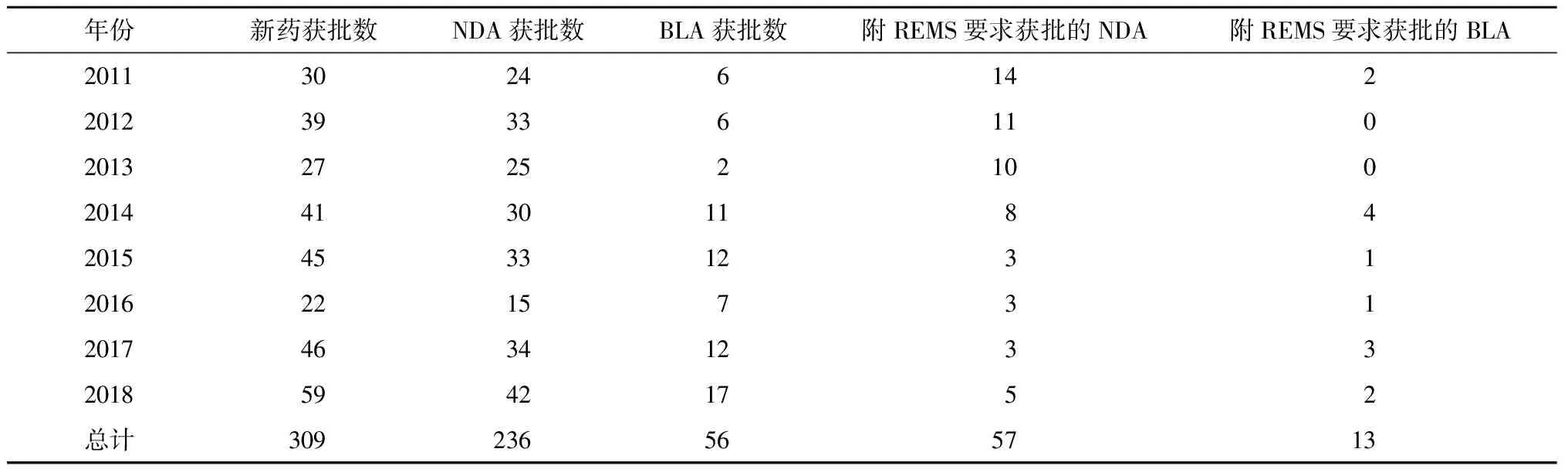
表1 2011~2018年FDA新药获批数及附REMS要求的新药获批数 个
由于REMS对美国医疗保障体系造成的额外负担,为了平衡患者对附REMS要求的药品的需求和医疗资源负担之间的平衡,FDA于2011年启动了REMS整合计划。此次计划召集多方相关者反馈有关信息,评估和改进REMS的实施现状。如图1所示,经过调整和改进,从2011年开始,附REMS要求获批的NDA占当年新药获批总数的比例逐年降低,附REMS要求获批的BLA始终保持在较低比例,整合计划的确在减轻医疗资源负担。2013年12月,美国开始鼓励线上REMS药房门户网站,培训附REMS要求的药品的各利益相关者,特别是对REMS药房的培训和持续检查,提高患者药品的可及性。2015~2018年,NDA和BLA的REMS要求维持在稳定水平,历年来的改革和建设逐渐显现成效。

图1 附REMS要求获批的新药及其占比
2.2 REMS的执行趋势
REMS的要求体现了FDA尽最大努力挽救生命的理念,但FDA无意加重医疗服务体系的负担。为此,FDA致力于准确评估药品的风险和效益,努力平衡特定药品需求和医疗服务供应之间的矛盾。2014年后,附REMS要求获批的NDA占当年新药获批总数的比例和附REMS要求获批的BLA占当年新药获批总数的比例都保持在17%之内。这是FDA建立政策工作组、REMS设计和标准化工作组以及评价工作组的努力结果,保证解决患者对特定药品的急迫需求,同时又不过分加重医疗负担。FDA还将继续进行REMS的优化工作,继续考虑将REMS纳入现有的医疗服务体系中,减轻实施负担。
3 REMS药房门户网站实践
3.1 REMS药房门户网站介绍
2013年之前,美国未推出自助药房门户网站(self-service pharmacy portal),患者使用REMS要求的药品需要通过致电客户服务代理(customer care representative, CCR)或使用互动式语音应答(interactive voice response, IVR)系统来获得确认号,取得确认号后才能进一步获取药品。这一过程往往容易降低药品的可及性,例如,致电CCR需要在工作日的固定时间内(周一至周五,8∶00~20∶00,美国东部时间)进行;虽然IVR系统的使用时间相对自由(每天24小时,一周7天),但其在使用过程中需要按照语音要求键入相关信息,大大降低了使用便利性。
2013年12月,自助药房门户网站筹备上线,为REMS计划中的相关利益者减轻负担。REMS申请人为处方者、患者和处方分发药房等REMS参与者提供REMS药房门户网站,相关人员按照固定流程进行REMS要求药品的开方、分发和使用,具体流程见图2。从FDA要求REMS申请人提交的REMS文件中可以看出,FDA对REMS参与者和申请人的要求细化到了治疗过程的每一步。例如,REMS文件中要求药房首先需要获得分发此类药品的资质,在分发药品之前、分发药品之后、患者服用药品之前、服用药品之后等多个过程都提出了相关要求。此外,REMS计划中的药房必须完成REMS的强制性教育和培训要求,才能获得认证并保持认证状态。经REMS认证的药房每年都要进行现场审核,以确保符合REMS的计划要求。
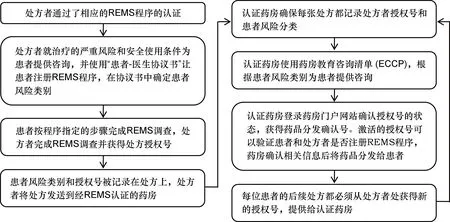
图2 使用REMS药房门户流程
3.2 赛尔基因REMS药房门户网站
赛尔基因REMS药房门户网站(Celgene REMS Pharmacy Portal)是赛尔基因公司为避免其产品来那度胺(Revlimid®)、泊马度胺(Pomalyst®)和沙利度胺(Thalomid®)的胚胎毒性,对以上3种产品强制执行REMS程序设立的网站。3个产品分别设立Revlimid REMS®程序、Pomalyst REMS®程序和Thalomid REMS®程序,患者可以根据需求点击进入相应程序界面。
以沙利度胺为例,沙利度胺的胚胎毒性曾造成了严重的药害事件,但其对多发性骨髓瘤(multiple myeloma, MM)和结节性红斑性麻风病(erythema nodosum leprosum, ENL)有显著的治疗效果。沙利度胺与地塞米松联用可治疗新诊断的MM;沙利度胺也适用于急性治疗中度至重度ENL的皮肤表征。因此,FDA对沙利度胺提出了REMS要求,处方者和药房都必须告知患者该药在使用过程中的严重风险,使患者在效益大于风险的情况下使用该药。分发药房、处方者和患者可点击进入Thalomid REMS®程序,导航目录包括:① Thalomid REMS®主页;② 关于Thalomid REMS®;③ 重要安全性信息;④ 完整的处方指南;⑤ 患者用药信息;⑥ 处方者资源;⑦ 患者资源;⑧ 药房资源。关于沙利度胺的相关信息都可在该程序中找到。此外,赛尔基因公司还开发了更便捷的REMS移动应用程序,并致力于开发更加易于管理的REMS流程。
3.3 美国风险评估与减轻策略对我国的启示
REMS作为降低和预防药物使用风险的措施在美国实行已超过10年,形成了良好的实施实践。REMS的实施始终坚持“保证药品效益大于风险”的原则,将患者使用药品的风险降至最小化,提高药品信息的透明度,减少和预防药品上市后不良事件的发生和危害,完善对药品的全生命周期监管。
2019年8月26日,我国发布新修订的《中华人民共和国药品管理法》,其中有许多创新点,如实行药品上市许可持有人制度;优化临床试验管理制度;实行优先审评审批制度;建立附条件审批制度;鼓励、引导药品零售连锁经营。在此背景下,我国将提高对药品安全性和药品可及性进行风险评价的能力,药品风险控制体系将逐渐健全。特别是药品上市许可持有人制度的真正落实,药品的风险控制计划将纳入上市许可之中,并在上市后要求MAH对其负责。美国在REMS建设时推出REMS@FDA网站,对REMS资源进行整合,为REMS的相关方带来便利。我国也可借鉴这种信息整合公开的做法,通过国家药品监管部门相关网站,建立专区进行上市药品的风险控制数据库建设,有效保证药品效益大于风险。
鼓励、引导药品零售连锁经营对我国REMS的发展是个良好契机。REMS药房需要经专业培训并定期检查,而连锁经营药房能够提供完整的专业训练、完善的管理手册。此外,连锁经营药房还有便捷的医药大数据传输和汇集系统,能够统一配送,统一商品和服务。以上特点符合REMS药房的初步要求。因此,零售药店的大力发展将进一步推动我国药品风险控制体系的完善。
总之,美国REMS对挽救患者生命起到了至关重要的作用,坚持效益大于风险的中心原则,体现了FDA对生命的尊重和努力。我国可以借鉴美国的经验,发展符合我国现实情况的药品风险控制,建立惠及更多患者的医疗保障体系。
