基于核酸序列依赖性扩增技术的玉米转基因成分Bar的鉴定
2020-06-13栾鑫超张冰琦孙笠原于丽莉侯殿雅徐亚维
栾鑫超, 张冰琦, 孙笠原, 于丽莉, 侯殿雅, 徐亚维
(吉林农业科技学院 生物与制药工程学院, 吉林 吉林 132101)
随着转基因玉米的扩大种植,对转基因玉米安全性问题的争议也越来越大,转基因作物检测的重视程度越来越高[1,2]。国际食品规定委员会制定了国际转基因食品的安全准则并且出台了相关政策,对转基因成分进行标识,因此,急需一种快速检测方法满足玉米产品在种植及贸易中的监控需要。
Bar基因是从链霉菌中提取得到的,现已被证实具有良好抗草丁膦(PPT)除草剂的性能。由于其非选择性、广谱、无残留的优点被广泛用于植物转基因的选择标记,Bar基因也常被作为检测转基因的靶标元件。现有检测方法中,核酸法因其准确快速日益受关注,如聚合酶链反应(Polymerase Chain Reaction, PCR)、实时荧光定量PCR和基因芯片等。荧光定量PCR技术是转基因成分检测的“金标准”,应用最为广泛。然而荧光定量PCR技术需高端的仪器、整体反应对污染物和抑制剂敏感、以及操作要求较高等,都难以满足非实验环境下现场检测。基因芯片技术成本高、数据分析复杂。检测外源基因的表达产物常因加工过程中产品丧失抗原性导致无法检测[3]。核酸法因其准确快速日益受关注,如聚合酶链反应(Polymerase Chain Reaction, PCR)、实时荧光定量PCR和基因芯片等;但因需要昂贵的PCR仪及专业化的操作人员未能得到普及;基因芯片技术成本高、数据分析复杂。因此,现阶段急需一种简单、快速且高效的诊断方法。核酸序列依赖性扩增(nucleic acid sequence-based amplification,NASBA)技术是一项以RNA为模板的恒温扩增技术,并且只具有一对特异性引物,可在体外恒温下连续扩增并能实时监测扩增情况。该技术可实现41 ℃、2 h反应条件下将模板扩增约1012倍,不需PCR核酸扩增仪和专业的技术人员,具有较高的灵敏度及特异性,更易于推广[4]。
本研究根据玉米转基因成分Bar的mRNA序列设计了特异引物和探针,将高效的NASBA和简便的酶联免疫检测法(ELISA)结合,从而研发出高效的NASBA检测转基因成分Bar的快速检测试剂盒,在短时间内对玉米转基因成分Bar进行高灵敏度筛查,其灵敏度达到5 fg,因其具有快速简便等优点,适合用于检验部门及现场检测,也可用于其它转Bar基因的产品检测。
1 材料试剂及仪器
1.1 材 料
非转基因玉米取样于当地田间玉米地;抗草丁膦转基因玉米由东北师范大学惠赠;转Badh抗旱基因和转Cry抗虫基因玉米由吉林农业大学惠赠。
1.2 主要试剂
T 7 RNA聚合酶、SupeScript Ⅱ反转录酶,购自Invitrogen公司;溶菌酶、Trizol,购自上海生工生物工程股份有限公司;转Bar基因玉米的引物和探针,由上海生工生物工程股份有限公司合成。
1.3 主要仪器
恒温振荡培养箱(HZQ-X 100型,哈尔滨东联电子技术开发公司);紫外可见分光光度计(BioSpec-nano,日本岛津公司);酶标仪(680型,美国Bio-Rad公司)。
2 方 法
2.1 特异性引物及探针的设计
根据转Bar基因的mRNA序列,利用软件Primer Premier 5.0设计针对检测Bar的特异引物和探针,人工合成结果如下:Bar-F:5′-GATGCAAGGTCGCATATGAG-GCCAAATGTTGAACGATCTGCAGG-3′;Bar-R:5′-AATTCTAATACGACTCACTATAGGGAGAAGG-GCACCATCGTCAACCACTACATCG-3′(下划线为T 7启动子序列)Bar-P:5′-DIG-AAGTCCAGCTGCCAGAAA-3′(检测探针,与核酸扩增子序列互补);生物素化捕获探针(biotin-ATGCAAGGTCGCATATGAGT)。
2.2 转基因玉米总RNA的制备
取0.1 g转Bar基因玉米去茎黄化苗液氮冷冻研磨,转入离心管中并加入1 mL RNA裂解液,加入600μL三氯甲烷,4 ℃,12 000 r·min-1离心10~15 min。然后取上清液向其中加入冰异丙醇(比例为1∶1),离心10~15 min,取沉淀。取一定量预冷的75%乙醇漂洗3次,风干后加50μL DEPC处理的TE溶解[5]。紫外分光光度计测定OD值和琼脂糖凝胶电泳鉴定。
2.3 NASBA反应体系及反应程序
NASBA扩增反应液的制备:加入10μL反应液、0.5μL总RNA模板及ddH2O补足14μL,65 ℃,反应2 min以破坏RNA的二级结构,41 ℃冷却2 min,再向扩增管中加入5μL酶反应液。混合均匀,41 ℃继续反应90 min,冰浴2 min终止反应,取相同体积的ddH2O做阴性对照[6]。
2.4 NASBA扩增产物ELISA检测
将0.1 mL、0.012 5 mg·mL-1的链霉亲和素酶标板包被液加至96孔酶标板中,室温过夜;再加入等体积的由0.05 mmol·L-1碳酸盐缓冲液(pH=8.6)及1% BSA Mixed混合而成的封闭液,放入37 ℃恒温培养箱持续反应2 h;用PBST Buffer冲洗4~6次,放入4 ℃冰箱中保存[7]。杂交反应:将5μL NASBA产物、43μL杂交Buffer和2μL探针Mixed加入到上述酶标板中,上下翻转混匀,41 ℃持续30 min,TBST Buffer轻柔冲洗4~6次,再加入100 mL AKP标记的带有Digoxin抗体抗性(1∶5 000稀释),室温持续30~50 min,TBST Buffer冲洗3~5次。再加入100μL pNPP,遮光(不低于10 min)下显色反应,迅速加入0.1 mL Na2CO3终止,并用酶标仪测定OD405值,当OD值≥0.27时为阳性,OD值<0.27时为阴性[8-10]。
2.5 Bar-NASBA检测试剂盒的特异性验证
对转Bar基因玉米叶片、转Badh抗旱基因玉米、转Cry抗虫基因玉米、普通玉米进行总RNA的提取,然后各取0.5μL RNA模板与10μL NASBA反应液混合后,置于65 ℃条件下反应2 min后,再将温度降至41 ℃冷却2 min;然后迅速向反应液中加入5μL E-Mix轻弹混匀,再向其中加入15μL ddH2O,保持41 ℃条件下持续反应90 min,冰浴终止,将产物进行ELISA检测[5]。
2.6 Bar-NASBA检测试剂盒的灵敏性验证
对转Bar基因玉米进行总RNA提取,将初始浓度为600 ng·μL-1的RNA浓度梯度稀释为60 ng·μL-1、6 ng·μL-1、600 pg·μL-1、60 pg·μL-1、6 pg·μL-1、600 fg·μL-1、60 fg·μL-1、6 fg·μL-1,然后取0.5μL各个浓度模板并与10μL NASBA反应液混合,在65 ℃条件下持续2 min,再将温度降至41 ℃冷却2 min;立即加入5μL E-Mix,充分混匀,ddH2O补足20μL,41 ℃持续90 min,冰浴终止反应,ELISA检测NASBA的扩增产物[6]。
2.7 Bar-NASBA检测试剂盒样本检测
分别提取非转基因和转Bar基因玉米叶片、玉米茎和玉米根总RNA,方法同2.2。并用NASBA扩增反应程序和ELISA检测方法进行检测,方法同2.3和2.4。
2.8 Bar-NASBA检测试剂盒稳定性和保存期研究
为了对Bar-NASBA试剂盒的最佳保存温度及有效期进行研究,本实验将Bar-NASBA试剂盒置于4 ℃、室温(25 ℃)和37 ℃ 3种温度条件下(重复15次试验),并对其性能进行样品特异性试验及结果分析。
3 鉴定结果与分析
3.1 Bar-NASBA检测试剂盒特异性验证分析
利用建立的NASBA方法分别对转Bar基因玉米RNA、转Badh抗旱基因玉米RNA,转Cry抗虫基因玉米RNA、非转基因玉米RNA进行扩增产物的电泳检测。结果显示,转Bar基因玉米出现目的条带,大小为519 bp,与预期结果相符,其余泳道均未出现扩增信号且与阴性对照保持一致,电泳结果表明该体系可以特异性的鉴别转Bar基因成分(图1)。
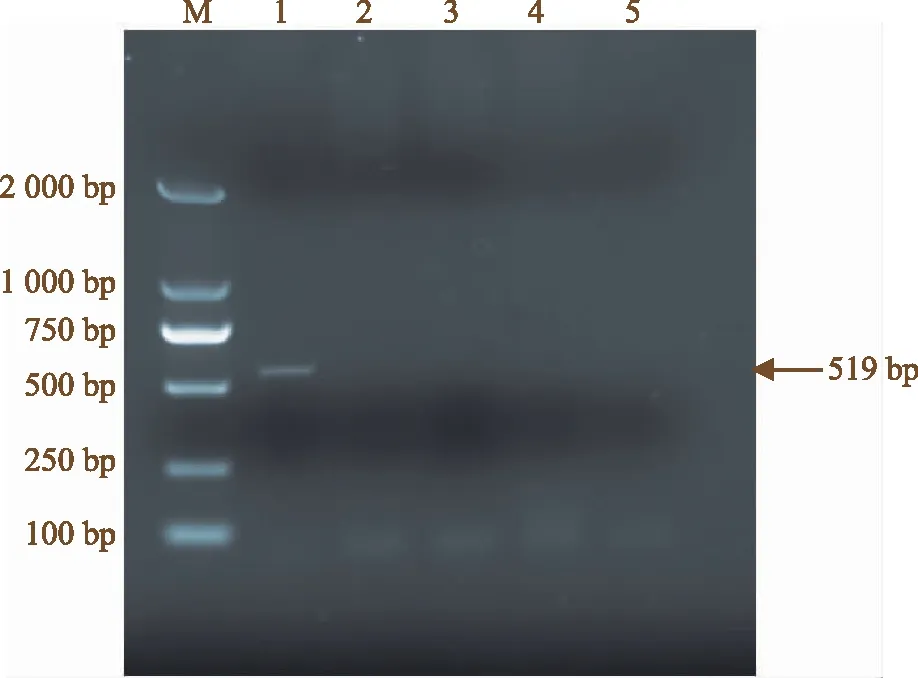
注:M为DL-2 000 Marker;1为转Bar基因玉米叶片;2为转Badh基因玉米;3为转Cry基因玉米;4为非转基因玉米;5为阴性对照。
3.2 Bar-NASBA检测试剂盒灵敏性验证分析
为探索检测体系的最低检出限,实验将原浓度为600 ng·μL-1转Bar基因的玉米的RNA做连续的梯度稀释,浓度梯度范围见表1:从1×10-1ng·μL-1至 1×10-8ng·μL-1。对稀释后的RNA样品进行NASBA反应,NASBA反应产物的电泳结果证明,模板浓度稀释至10-8ng·μL-1时仍能检出为阳性,说明NASBA在检出Bar基因的灵敏度可达1.0×10-6ng·μL-1级别,根据电泳结果中9号泳道的阴性对照无扩增条带,可以说明反应体系的灵敏度是真实值,而不是由于扩增污染造成的。
表1Bar-NASBA检测试剂盒灵敏度试验

检测浓度/(ng·μL-1)OD450值检出信号1×10-11.023+1×10-20.945+1×10-30.824+1×10-40.772+1×10-50.703+1×10-60.516+1×10-70.280+1×10-80.278+对照0.213-
注:“+”代表有检出信号,“-”代表无信号。
电泳结果也表明,检测浓度可达到1×10-8ng·μL-1,浓度为1×10-9ng·μL-1时显示为阴性(结果未给出),由此可见,该反应体系具有较高的灵敏性可达fg级别,且阴性对照无扩增信号(图2)。

注:M为DL-2 000 Marker;1为1×10-1ng·μL-1;2为1×10-2ng·μL-1;3为1×10-3ng·μL-1;4为1×10-4ng·μL-1;5为1×10-5ng·μL-1;6为1×10-6ng·μL-1;7为1×10-7ng·μL-1;8为1×10-8ng·μL-1;9为阴性对照。
3.3 Bar-NASBA检测试剂盒样本检测结果
采用Bar-NASBA试剂盒分别对普通玉米与转Bar玉米取茎叶片、玉米茎和玉米根总RNA检测,结果:转Bar基因玉米相关样品均显阳性,表明试剂盒应用于转Bar基因的玉米各组织检测具有较高灵敏度和特异性(图3)。

注:M为DL-2 000 Marker;1为转Bar玉米去茎叶片;2为转Bar基因玉米茎;3为转Bar基因玉米根;4为普通玉米叶片;5为普通玉米茎;6为普通玉米根;7为阴性对照。
3.4 Bar-NASBA检测试剂盒的稳定性和保存期结果
由表2可以看出,该试剂盒可在4 ℃下存放1年仍保持较高的敏感性和特异性,在室温(25 ℃)条件下存放半年后则失去其稳定性,而在37 ℃条件下仅可存放1个月。
4 结 论
本研究将NASBA联合ELISA方法应用于玉米中Bar基因的检测,通过优化引物和探针使其灵敏度可达到6 fg,是目前常规电泳检测法灵敏度的100倍,是RT-PCR消耗成本的1/10,且较常规PCR法操作更简单,NASBA法更适合于检测转Bar基因的转基因玉米样品。转Bar基因玉米NASBA诊断试剂盒,具有特异性高、灵敏度强且操作方法简单、快速等优势,可以被广泛的应用于检验部门,尤其适合基层部门和采样现场对Bar转基因成分的早期鉴定。将极大的减少饲料用转基因玉米的比例,切断通过养殖业将转基因成分带入人类食物链,同时减少市场上转基因玉米流通的比例[9]。
表2Bar-NASBA检测试剂盒保存在不同温度下的性能分析

保存时间/d 4℃室温(25℃)37℃ 敏感性特异性敏感性特异性 敏感性特异性015/1515/1515/1515/1515/1515/153015/1515/1515/1515/1515/1515/156015/1515/1515/1515/15—15/159015/1515/1515/1515/15——12015/1515/1515/1515/15——18015/1515/1515/1515/15——27015/1515/15————36015/1515/15————540—————
