外源NO对PEG胁迫下燕麦幼苗生长及生理特性的影响
2020-06-13任廷会陈仕勇罗兴雨周青平陈智华李世丹
任廷会, 陈仕勇, 罗兴雨, 周青平, 陈智华, 李世丹
(1.西南民族大学生命科学与技术学院, 四川 成都 610041;2.西南民族大学青藏高原研究院, 四川 成都 610041)
燕麦(AvenasativaL.)是禾本科燕麦属的一年生草本植物,是我国重要的特色杂粮资源之一,也是重要的饲用植物资源[1,2]。燕麦主要分布在北半球温带地区,具有耐贫瘠、耐旱及耐寒等特点,可在多种土壤条件下种植。在我国主要种植区为河北、内蒙、山西、青海、甘肃等地[1]。在我国青藏高原高寒牧区,燕麦是非常重要的饲草资源,在缓解牦牛等家畜冬春饲草短缺方面起到了非常重要的作用[3-5]。干旱是农业生产中的热点问题,随着全球气候变化的加剧,干旱也成为高寒地区饲草生产和生态建设的焦点问题。所以,开展高寒地区燕麦种质资源抗旱及相关研究对其高产栽培具有重要的意义。柏晓玲等研究了高寒地区6个燕麦品种在PEG胁迫下萌发期的抗旱能力,结果表明,低浓度(5%)的PEG促进了燕麦的萌发,高浓度(20%)条件下萌发受到明显的抑制,其中青引3号莜麦、林纳燕麦抗旱性较强[6]。罗兴雨等分析了高寒燕麦青燕1号苗期的抗旱性,结果表明,其对于低浓度PEG胁迫具有一定的适应性,而随着浓度升高其相对含水量、叶绿素含量等明显降低,对燕麦的损伤程度逐渐加大,其中15%PEG可以作为该种燕麦抗旱评价最适合的胁迫浓度[7]。
一氧化氮(NO)是一种重要的信号分子,不仅参与植物的生长发育过程,还调节植物对逆境胁迫的调节机制。目前已被广泛地应用于作物、牧草及药材等植物的抗旱、耐盐碱等抗逆研究中,且适宜浓度的外源NO的能够增强植物对逆境的适应[8-11]。邱宗波等研究表明,外源低浓度(0.05 mmol·L-1)的添加NO供体可以明显缓解干旱胁迫下小麦幼苗叶片膜脂过氧化,改善其抗旱能力[12]。高景慧等研究表明,低浓度(0.05 mmol·L-1)硝普钠(NO供体)可提高红三叶的抗旱性,而高浓度(0.1 mmol·L-1)硝普钠则对红三叶的干旱胁迫的缓解效果不佳[11]。目前关于外源添加NO对高寒地区皮燕麦品种的抗旱性影响及其机制中的研究还鲜有报道。本试验研究了外源NO对PEG模拟干旱胁迫条件下高寒皮燕麦品种青燕1号幼苗及生理特性的影响,以期为其抗旱性研究及高产栽培等提供参考。
1 材料与方法
1.1 供试材料
供试材料为高寒牧区优良的皮燕麦品种青燕1号(AvenasativaL. cv. Qingyan No.1),由青海大学畜牧兽医科学院牧草研究所选育登记,种子由西南民族大学牧草创新团队提供。
1.2 试验方法
挑选均匀饱满的燕麦种子,用蒸馏水冲洗3次,均匀播种在盛有等量石英砂的培育盆(21 cm×15 cm×6 cm)中,置于温度23 ℃/18 ℃(昼/夜)的光照培养箱中,用蒸馏水培养7 d待种子发芽后,更换为Hoagland完全培养液,之后每3 d更换1次培养液。待幼苗长到2叶1心期时,用15%的PEG-6000溶液的Hoagland完全培养液进行干旱胁迫[7],用Hoagland完全培养液培养作为对照。通过预实验选用0.20 mmol·L-1硝普钠(SNP)溶液作为外源NO添加量,设置对照(ck)、胁迫(D)和NO添加(D+0.2 NO)3个处理,每个处理4次重复。分别在处理后的0 d、7 d和14 d定时取样进行相关指标的测定。
1.3 测定指标和方法
1.3.1形态指标测定
根冠比(RSR)=(处理的根干重/处理的茎叶干重)×100%。
1.3.2生理生化指标测定
相对含水量(RWC)采用饱和称重法测定;叶绿素(Chl)采用丙酮-乙醇浸提法;相对电导率采用电导率法测定;生理生化指标测定具体参考邹琦[13]的方法进行,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、游离脯氨酸(Pro)、可溶性糖(SSC);丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法[14]测定。
1.4 数据分析
采用SPSS 22.0软件进行单因素方差分析,用Duncan法进行多重比较(显著水平为0.05)。
2 结果与分析
2.1 NO对干旱胁迫下燕麦幼苗形态的影响
如图1所示,随着胁迫时间延长,干旱处理(D)的根冠比明显高于对照组(p<0.05),胁迫第7天和第14天分别升高61.5%、120%;NO处理组(D+0.2 NO)较干旱组(D)有明显降低,第7天和第14天分别降低了9.9%(p<0.05)、29.7%。

注:不同字母表示不同处理之间差异显著(p<0.05)。下同。
2.2 NO对干旱胁迫下燕麦幼苗相对含水量的影响
图2表明,在正常处理情况下,燕麦幼苗相对含水量没有明显变化,均达到80%以上。随着处理时间延长,干旱处理(D)与ck相比,相对含水量明显下降(p<0.05);NO处理(D+0.2 NO)的相对含水量较干旱处理有所提高;在胁迫第7天时,D+NO较干旱处理(D)显著提高了23%(p<0.05);胁迫14 d时,D+NO较干旱处理(D)提高了10.33%。
表1 NO对干旱胁迫下燕麦幼苗抗氧化酶活性的影响

处理 SOD/(U·g-1) CAT/(U·g-1) 0d7d14d0d7d14dck37.70±0.37a34.3±13.0c30.7±1.82c80.95±9.60a83.64±8.2a88.90±12.4aD37.96±0.50a56.1±1.7a46.8±0.27b92.90±7.35a42.31±9.3b6.59±1.6bD+NO37.30±1.13a51.9±0.6b55.9±0.81a87.40±9.85a71.40±11.0ab18.58±6.5b
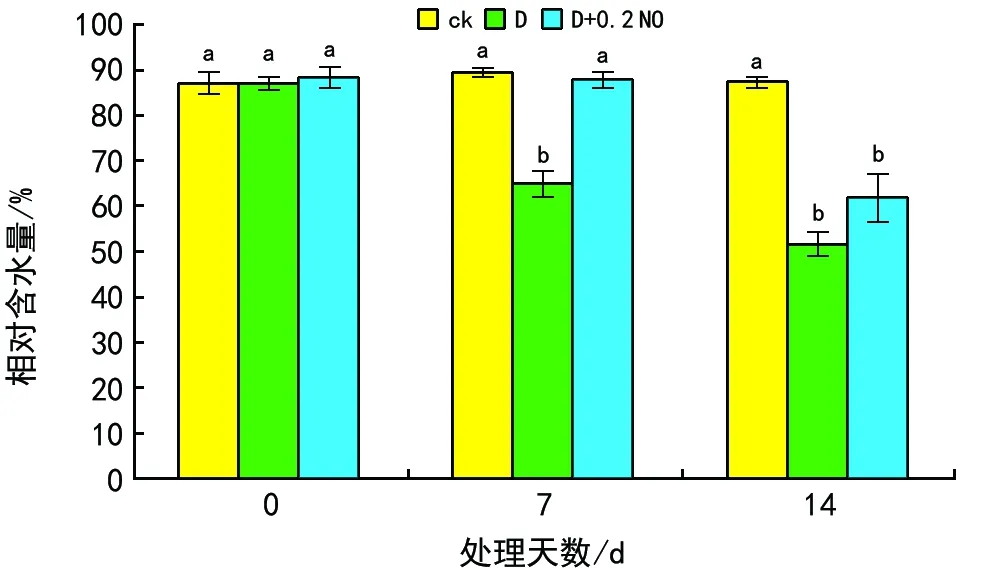
图2 不同处理下燕麦相对含水量的变化
2.3 NO对干旱胁迫下燕麦幼苗相对电导率的影响
如图3所示,随着胁迫时间的延长,干旱处理(D)的幼苗相对电导率较对照组显著升高(p<0.05),NO处理组(D+NO)比干旱胁迫(D)的电导率显著降低(p<0.05)。这表明NO处理缓解了其细胞膜受损的程度。

图3 不同处理下燕麦相对电导率的变化
2.4 NO对干旱胁迫下燕麦幼苗叶绿素含量的影响
如图4所示,随着胁迫时间的延长,干旱处理(D)对比ck组叶绿素含量下降趋势越明显,程度逐渐加剧(p<0.05)。NO处理组在胁迫7 d时,叶绿素含量较干旱胁迫(D)显著下降,但是当胁迫14 d时,NO处理组比干旱胁迫(D)叶绿素含量显著升高了21.9%(p<0.05)。

图4 不同处理下燕麦叶绿素含量的变化
2.5 NO对干旱胁迫下燕麦幼苗对活性氧产生和膜脂过氧化的影响
由图5可见,与对照相比,干旱处理(D)导致供试材料幼苗叶片超氧阴离子(O2·-)、过氧化氢(H2O2)、丙二醛(MDA)含量显著提高(p<0.05),NO处理组(D+NO)较干旱处理(D)其含量都有所下降,其胁迫得到了一定程度的缓解。胁迫第7天时,NO处理组(D+NO)较干旱组(D)O2·-、H2O2、MDA积累明显下降,分别降低了31.9%、40.4%(p<0.05)、59.3%(p<0.05);胁迫14 d后,分别降低了22.3%、10.6%、64.2%(p<0.05)。
2.6 NO对干旱胁迫下燕麦幼苗抗氧化酶活性的影响
由表1可知,干旱胁迫前(0 d)3个处理的SOD含量没有差异;随着胁迫延长,干旱处理(D)和NO处理(D+NO)的SOD活性对比ck均呈显著上升(p<0.05)。胁迫14 d时,NO处理组(D+NO)显著高于干旱处理(D)(p<0.05)。CAT的含量则随着胁迫延长,干旱处理(D)和NO处理(D+NO)的含量对比ck基本上呈显著下降(p<0.05);NO处理组(D+NO)较干旱处理组(D)其含量较高。
2.7 NO对干旱胁迫下燕麦幼苗渗透调节能力的影响
如表2所示,相比对照(ck),干旱胁迫(D)和NO处理组(D+NO)的脯氨酸和可溶性总糖含量显著升高(p<0.05)。在胁迫第7天和第14天,NO处理组(D+NO)和胁迫组(D)的可溶性总糖含量二者差异不显著,但是脯氨酸含量较干旱处理(D)显著增加(p<0.05)。
表2 NO对干旱胁迫下燕麦幼苗渗透调节能力的影响

处理 Pro/(μg·g-1) SSC/(μg·g-1) 0d7d14d0d7d14dck0.42±0.30a0.50±0.32c0.33±0.02c 36.42±1.68c40.40±1.74b36.80±1.82bD0.43±0.20a1.47±0.93b1.64±0.10b49.44±1.82a90.53±9.40a91.58±16.10aD+NO0.38±0.22a2.23±0.13a2.43±0.22a43.14±1.28b85.76±4.10a76.80±8.78a

图5 不同处理下燕麦O2·-、H2O2、MDA的变化
3 讨 论
研究表明,植物在苗期会遭到不同程度的干旱胁迫,导致植物受到伤害,对植物的生长产生不可逆的影响,直接导致产量下降[15,16]。植物受到干旱胁迫时,导致燕麦生物量和相对含水量下降,本研究通过添加外源NO提高了其根冠比及叶片相对含水量,缓解了干旱对燕麦生长的抑制。利用15%的PEG-6000模拟干旱,干旱胁迫使供试燕麦幼苗叶片的相对含水量、叶绿素含量显著下降,相对电导率等显著升高。外源NO处理下,干旱胁迫下燕麦叶片中的叶绿素含量呈升高趋势,这说明外源添加NO对干旱胁迫下叶绿体的伤害具有一定的缓解作用。外源NO处理下燕麦相对电导率显著降低,这说明在水分缺失的情况下燕麦叶片细胞质膜遭到破坏,导致细胞内电解质外渗,而NO可以缓解干旱导致的燕麦细胞质膜的破坏,这与邱宗波等[12]的研究结果一致。
植物受到外界环境的胁迫常会造成其体内活性氧含量的增加,导致脂质过氧化物等强氧化性物质的积累,其中MDA是膜脂过氧化作用的主要产物之一,其可以衡量膜脂过氧化强弱和质膜破坏程度的重要指标[9]。本研究中,燕麦受到干旱胁迫后,MDA含量显著升高,说明细胞质膜发生了过氧化作用,质膜受到了破坏。当外源NO处理燕麦后,MDA含量显著降低,说明NO对干旱胁迫后燕麦所造成的伤害具有明显的缓解作用,其中重要的作用是通过有效增强其抗氧化酶活性,以达到减轻质膜过氧化的效果。本研究中,NO处理后叶片的SOD含量显著提高,增强了清除自由基能力,缓解了氧化损伤作用,使其MDA含量下降,同时也有效地清除了干旱诱导产生的O2·-和H2O2积累,缓解了质膜氧化,这与高景慧等[11]、刘建新等[17]的研究结果一致。植物在受到逆境胁迫时,脯氨酸和可溶性糖等渗透溶质会随着胁迫的增强而积累,有利于维持和调节细胞的渗透势,维持正常的水分需求,以保证植物细胞正常的生理功能[18,19]。本试验中,NO处理的燕麦叶片可溶性糖和脯氨酸含量均高于对照和干旱处理,特别是关于脯氨酸的积累显著,表明外源NO可对脯氨酸的积累产生一定的诱导作用,提高了供试材料的渗透调节能力,缓解干旱胁迫的伤害。
4 结 论
在干旱胁迫下,添加0.20 mmol·L-1NO(硝普钠SNP)可以有效缓解燕麦幼苗受到的生长抑制,并通过提高燕麦幼苗抗氧化酶活性、增加叶绿素含量、加强清除活性氧能力,减少膜质过氧化作用,促进脯氨酸等渗透物质积累,从而缓解燕麦幼苗由于胁迫造成的氧化损伤,提高燕麦幼苗的抗旱性。
