利用分子标记辅助选择回交转育培育早粳稻空育131(fgr)导入系
2020-06-13李荣田孟德鑫王梦露刘长华
李荣田, 孟德鑫, 苏 迪, 王梦露, 刘长华,3
(1.黑龙江大学 生命科学学院 黑龙江省普通高等学校分子生物学重点实验室, 哈尔滨 150080;2.黑龙江大学 农业微生物技术教育部工程研究中心, 哈尔滨 150500;3.黑龙江大学农业资源与环境学院, 哈尔滨 150080)
中国是世界上最大的水稻(OryzasativaL.)生产国与消费国[1]。黑龙江省是中国粳稻生产第一大省,是世界水稻栽培北限。黑龙江生产的稻米大部分进入国际国内市场,寒区稻米以其绿色优质特征深受消费者青睐[2-4]。早粳稻品种空育131具有丰产性好、耐冷性强、稳产、米质较好等特征,曾经连续多年是我国北方粳稻种植面积最大的品种,目前在黑龙江省北部水稻主产区仍然是生产上使用的品种之一。以水稻空育131为“底盘”,改良其抗稻瘟病性及食味米质特征,可以延长优良“老品种”利用年限。空育131系非香味水稻,创制香米版的空育131及利用香米版的空育131有利于寒区稻米食味品质的提升[5-6]。水稻香米性状有或无的主效基因Fgr/fgr(BADH2)位于第8号连锁群的RG 28/Y 5与RG 1之间。野生型Fgr编码甜菜碱醛脱氢酶(BADH2),在非香水稻品种中,BADH 2蛋白催化4-氨基丁醛氧化成甜菜碱[7],而4-氨基丁醛是水稻香味主要成分2-乙酰基-1-吡咯啉(2-AP)的合成前体[8],当4-氨基丁醛被BADH 2氧化后2-AP合成受到抑制,水稻没有香味。如果Fgr基因发生功能性突变,导致BADH 2蛋白丧失功能,不能催化4-氨基丁醛的氧化,4-氨基丁醛积累促进了2-AP的合成,使水稻产生香味[9]。对香稻和非香稻品种进行比较测序发现,Fgr基因在不同的水稻品种中存在多种类型的突变[10]。在香稻品种中, 常见的是Fgr基因的第7外显子有1个8 bp的缺失和3个单核苷酸多态性位点[11]。利用分子标记辅助选择(MAS,marker-assisted selection)技术,通过回交育种可以快速、准确地创制水稻目标基因导入系[12-14]。Chen等[15]利用与目标基因紧密连锁的分子标记进行正向前景选择,利用多个RFLP标记进行负向背景选择,回交转育把广谱抗白叶枯病基因Xa21导入明恢63水稻恢复系,明恢63(Xa21)与明恢63比较,抗白叶枯病抗性强、其他性状没有显著差异。Khanna等[16]以水稻Basmati为受体品种,利用MAS技术回交转育成功地创制了7个主效抗稻瘟病基因的近等基因系。Yang等[17]利用MAS结合SNP芯片全基因组扫描,多次回交把抗稻瘟病基因Pi2导入光温敏核不育系Feng 39 S,改进了Feng 39不育系及其衍生杂交种的抗稻瘟病性。进行全基因组背景选择还可以改良水稻产量等数量性状。Feng等[18]和Nan等[19]替换了水稻空育131一段含有GS3和Gnla基因的染色体片段,重构了基因组的空育131产量显著增加。MAS技术结合回交转育用于水稻质量性状及主效QTL控制性状遗传改良是十分有效的。黑龙江省香稻品种主要是以稻花香2号、绥粳4号为亲本育成的品种[20]。与绥粳4号水稻的浓香比较,稻花香2号及其衍生的香稻品种的清香更受市场欢迎。为了使早粳稻空育131具有稻花香2号一样的香味性状,有必要培育具有稻花香2号香味基因的空育131。通过回交转育,利用MAS技术结合农艺性状检测鉴定,将稻花香2号香味基因导入早粳稻空育131中,选育出与空育131农艺性状相同且具有香味的空育131(fgr)导入系。
1 材料与方法
1.1 材 料
1.1.1水 稻
受体亲本:早粳稻品种空育131,具有耐冷、早熟、产量高而稳定、加工品质良好等性状,为黑龙江省主栽品种。
供体亲本:具有香味性状的稻花香2号水稻。
受体亲本与供体亲本杂交、回交及自交等世代育种材料,以及新创制的早粳稻空育131(fgr)导入系。
1.1.2前景选择候选SNP标记
香味基因fgr定位在第8号染色体上,香味基因fgr对非香味基因Fgr为隐性。通常情况下野生型Fgr基因与突变型fgr基因比较,Fgr在甜菜碱醛脱氢酶的编码区中发生了8个bp的缺失和3 bp的替换[5],根据这一特点设计了4条引物的SNP-fgr标记(见图1)[21],拟作为创制空育131(fgr)导入系的前景选择标记。SNP-fgr标记PCR引物由生工生物工程(上海)股份有限公司合成。
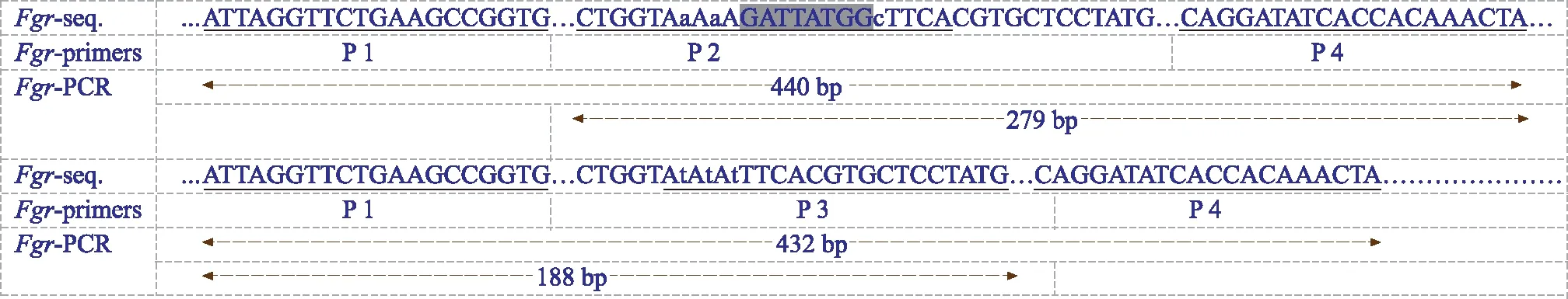
注:…表示省略的碱基;小写字母表示替换的碱基;底纹字母表示缺失的碱基;下划线字母表示PCR引物。
1.1.3背景选择候选SSR标记
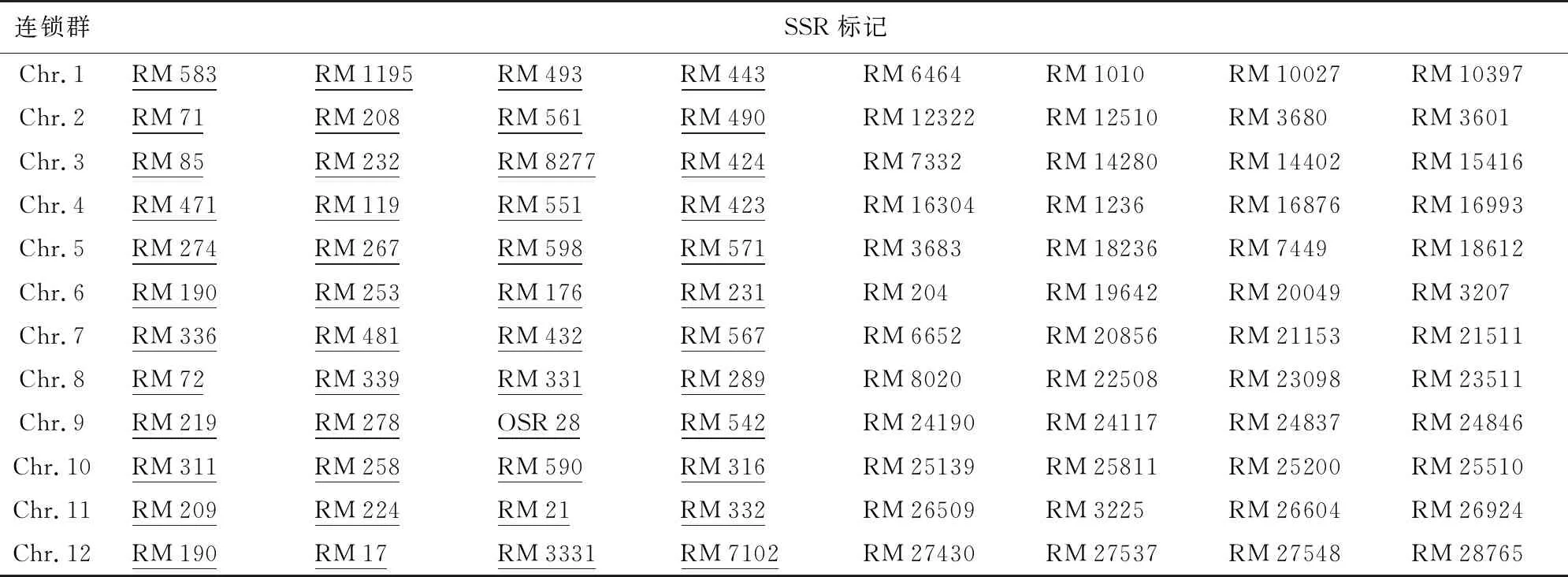
本研究从水稻12条连锁群上均匀选取48个SSR分子标记和NY/T 1433-2014《水稻品种鉴定技术规程SSR标记法》中用于水稻品种指纹图谱鉴定分析的48个SSR标记,共96个SSR作为背景选择候选标记(见表1)。表1中SSR标记引物由生工生物工程(上海)股份有限公司合成。
1.2 方 法
实验及试验中所用的分子生物学试剂及化学试剂均购于生工生物工程(上海)股份有限公司。
表1 创制早粳稻空育131(fgr)导入系背景选择候选SSR
连锁群SSR标记Chr.1RM583RM1195RM493RM443RM6464RM1010RM10027RM10397Chr.2RM71RM208RM561RM490RM12322RM12510RM3680RM3601Chr.3RM85RM232RM8277RM424RM7332RM14280RM14402RM15416Chr.4RM471RM119RM551RM423RM16304RM1236RM16876RM16993Chr.5RM274RM267RM598RM571RM3683RM18236RM7449RM18612Chr.6RM190RM253RM176RM231RM204RM19642RM20049RM3207Chr.7RM336RM481RM432RM567RM6652RM20856RM21153RM21511Chr.8RM72RM339RM331RM289RM8020RM22508RM23098RM23511Chr.9RM219RM278OSR28RM542RM24190RM24117RM24837RM24846Chr.10RM311RM258RM590RM316RM25139RM25811RM25200RM25510Chr.11RM209RM224RM21RM332RM26509RM3225RM26604RM26924Chr.12RM190RM17RM3331RM7102RM27430RM27537RM27548RM28765
注:下划线SSR表示包含于《水稻品种鉴定技术规程SSR标记法》(NY/T 1433-2014)的SSR。下同。
1.2.1水稻基因组DNA提取与PCR扩增
采用寇姝燕等[22]的方法(略作改动)提取水稻全基因组DNA,将提取后的DNA存放于-20 ℃保存备用。
SNP-fgr标记PCR体系20μL:10μmol·L-1P10.5μL,10μmol·L-1P20.5μL,10μmol·L-1P30.5μL,10μmol·L-1P40.5μL,水稻模板DNA 2μL,TaqPCR Master Mix(0.1 U·μL-1TaqDNA Polymerase,2×PCR buffer,3 mmol·L-1MgCl2,0.4 mmol·L-1dNTP)10μL,ddH2O 6μL。
SNP-fgr标记 PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,54 ℃复性30 s,72 ℃引物延伸30 s,30个循环;延伸72 ℃ 10 min;4 ℃ ∞。
SSR标记PCR体系10μL:10μmol·L-1正向引物 0.5μL,10μmol·L-1反向引物 0.5μL,水稻模板DNA 1μL,Mix(0.1 U·μL-1TaqDNA Polymerase,2×PCR buffer,3 mmol·L-1MgCl2,0.4 mmol·L-1dNTP)3μL,ddH2O 5μL。
SSR标记PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃复性30 s,72 ℃引物延伸30 s,30个循环;延伸72 ℃ 10 min;4 ℃ ∞。
利用1.0%的琼脂糖凝胶电泳对PCR扩增产物进行检测。
1.2.2水稻空育131(fgr)导入系的培育过程
创制及培育水稻香味空育131(fgr)导入系的培育过程见图2。
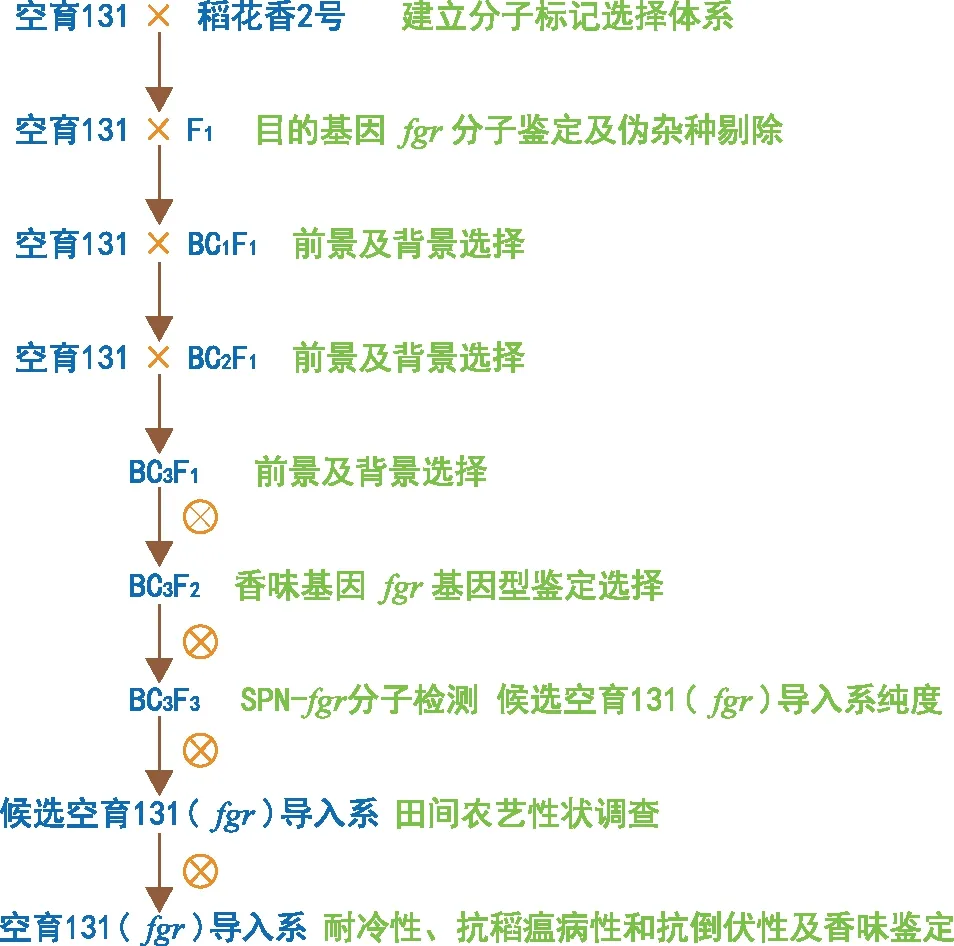
图2 创制及培育香味空育131(fgr)导入系的过程
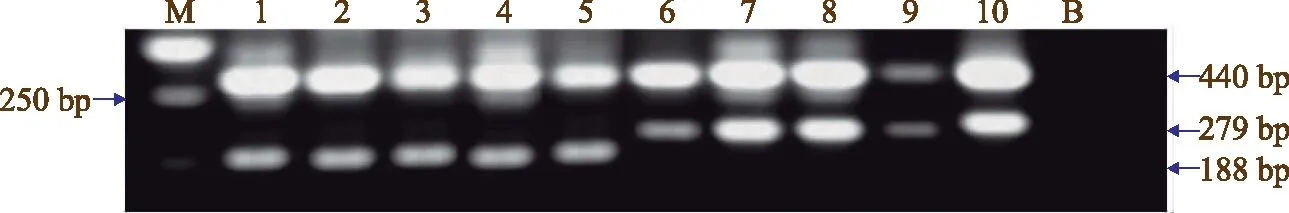
注:M表示Maker D;1~5表示稻花香2号;6~10表示空育131;B表示ddH2O。
表2 创制及培育水稻空育131(fgr)导入系背景选择SSR标记
连锁群SSR标记Chr.1RM1195RM10010Chr.2RM71RM12510RM3680Chr.3RM232RM7332RM14402Chr.4RM551RM16304RM1236RM16876RM16993Chr.5RM598RM3683Chr.6RM190RM253Chr.7RM432RM6652RM21153Chr.8RM72RM339RM8020Chr.9RM278RM24190RM24117RM24837Chr.10RM590RM25139RM25811Chr.11RM332RM26509Chr.12RM17RM27430
1.2.3候选水稻空育131(fgr)导入系田间农艺性状调查
候选空育131(fgr)导入系及空育131(ck)进行田间试验,试验设计为随机区组法,3次重复。小区4行区,行长5 m,插秧规格行距30 cm、株距12 cm,每篼插3~4棵苗,小区面积6 m2。育苗及田间管理与当地生产田相同。调查生育期、整齐度、株高、穗数、穗长、穗粒数、结实率、千粒重、穗重及产量等性状。以小区平均数为基础数据进行统计分析。
1.2.4水稻空育131(fgr)导入系耐冷性、稻瘟病抗性和抗倒伏性鉴定
耐冷性鉴定。按照李霞等[23]的方法对空育131(fgr)导入系及空育131水稻进行耐冷性鉴定。待水稻花粉母细胞减数分裂期时将一部分水稻材料放置在温室,另一部分水稻材料移至人工气候箱中进行15 ℃低温胁迫处理。低温胁迫5 d后移至温室直到水稻成熟。分别计算常温和低温胁迫下的孕穗期结实率,重复5次取其平均值。
抗稻瘟病性鉴定。根据农业行业标准《水稻品种试验稻瘟病抗性鉴定与评价技术规程》(NY/T 2646-2014)对空育131(fgr)导入系及空育131水稻进行抗稻瘟病性鉴定。水稻材料种植在稻瘟病鉴定圃,多施氮肥,周边种植感病品种蒙古稻。在水稻分蘖期和孕穗初期时接种当地混合稻瘟病菌,孢子浓度为2×105个·mL-1,15 d后调查水稻叶瘟及穗颈瘟级别。每个水稻材料取5株调查,取其平均值。
抗倒伏性鉴定。在空育131(fgr)导入系及空育131水稻抽穗20 d左右时,根据Yang等[17]的方法调查水稻材料基部第2节间的弯曲力矩、抗折力及倒伏指数。弯曲力矩=基部第2节间底部至穗顶的长度(cm)×基部第2节间底部到穗顶鲜重(g)。抗折力测定,将带有叶鞘的基部第2节间两端横亘在2个支点上,保持水稻材料水平,在待测水稻节间中点处悬挂一个盘子,并向盘子中加入重物,直到水稻茎秆折断时为止,此时盘子及重物的合计重量就是该节间茎秆的抗折力。倒伏指数=弯曲力矩/抗折力×100。每个水稻材料测量5次倒伏指数,取其平均值代表抗倒伏性。
1.2.5水稻空育131(fgr)导入系稻米香味性状检测 水稻导入系空育131(fgr)和空育131收获3个月后,按空育131(fgr)∶空育131为0∶20、4∶16、8∶12、12∶8、16∶4和20∶0的比例取20粒精米放入玻璃瓶中,再把10 mL左右的1.7%氢氧化钾溶液加入瓶中,盖上瓶盖,室温下保持10 min后,开启瓶盖,选择10位对气味敏感的人员独立嗅瓶中的气味,记作香或非香两类,每种比例的精米重复3次。
2 结果与分析
2.1 前景及背景选择分子标记体系
2.1.1前景选择标记
SNP-fgr标记对水稻空育131与稻花香2号的PCR检测结果见图3。图3显示,SNP-fgr标记在空育131和稻花香2号水稻之间有明显的多态性,说明稻花香2号香味性状基因位点与多数香米品种突变序列相同,可以用SNP-fgr标记选择稻花香2号香味基因fgr。
2.1.2背景选择标记
从96个候选的背景选择SSR标记中筛选出了在水稻空育131和稻花香2号之间具有稳定的、多态性显著的34个SSR标记,作为创制及培育空育131(fgr)导入系各回交世代及自交世代植株进行背景选择的分子标记(见表2)。

注:M表示Maker D;K表示空育131;D表示稻花香2号;1~19表示F1代植株;B表示ddH2O。

注:M表示Maker D;K表示空育131;D表示稻花香2号;1~22表示BC3F2代植株;B表示ddH2O。

注:M表示Maker D;K表示空育131;D表示稻花香2号;1~5表示空育131(fgr)-1;6~10表示空育131(fgr)-2;B表示ddH2O
表3 创制水稻空育131(fgr)导入系各回交世代鉴定选择
世代总株数/株前景选择的株数/株背景恢复率/%入选植株多态性的背景选择SSR标记BC1F1492376.47~61.18RM232 RM551 RM16876 RM190 RM339 RM25811 RM332 BC2F1241397.06~82.35RM190 BC3F1107100.00~97.06
表4 候选水稻空育131(fgr)导入系田间农艺性状
性状空育131空育131(fgr)-1空育131(fgr)-2株高/cm83.80±1.3283.45±0.9283.56±0.86穗数/穗21.70±1.2521.53±1.5521.56±1.34穗长/cm14.62±0.7015.26±1.5815.03±1.38穗重/g28.14±1.2027.63±1.8327.93±1.66穗粒数/粒79.90±1.0580.21±0.7380.14±0.96结实率/%86.57±1.6586.52±0.9585.91±1.35千粒重/g26.84±0.9227.04±0.8826.89±1.28产量/(kg·m-2)0.90±0.050.90±0.150.89±0.12生育期/d126.00±1.00127.00±0.50127.00±1.00整齐度整齐整齐不整齐
2.2 水稻空育131(fgr)导入系的创制
2.2.1F1世代植株鉴定选择
早粳稻空育131为母本、稻花香2号为父本进行杂交得到F1代。利用SNP-fgr标记对F1代植株进行鉴定(见图4),在19个F1代植株中1、2、3、4、5、6、7、8、10、11、13、14、15、17、18、19号等16株表现出杂合带型,说明含有fgr基因,是真杂种;其余植株表现出空育131带型,不含有fgr基因,是伪杂种。空育131水稻为母本,含有fgr基因的F1植株作父本进行回交,获得BC1F1世代植株。
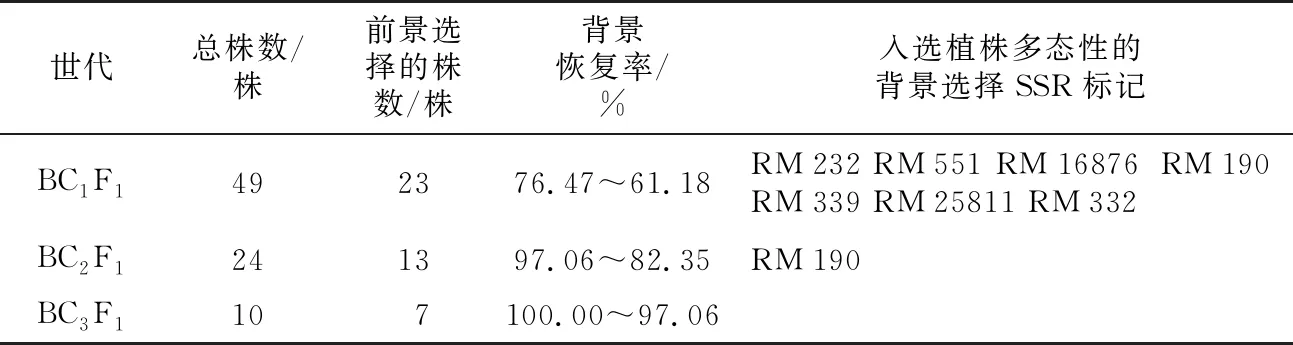
2.2.2回交世代植株鉴定选择
BC1F1世代的植株共有49株,含有fgr基因的植株为23株,其中背景恢复率最高为76.47%(见表3)。在BC1F1世代群体中选择含有fgr基因、背景恢复率最高的植株作为父本,与空育131进行第2次回交获得BC2F1群体(见表3)。在BC2F1世代进行与BC1F1世代相类似的鉴定、选择及有性杂交工作,获得了BC3F1世代(见表3)。在BC3F1世代群体中选择出了7株携带fgr基因的植株,从中选择了背景恢复率100%、外观形态性状与空育131水稻相同或相似程度高的单株自交并收获种子,即BC3F2代群体。
2.2.3自交世代植株及株系鉴定选择
利用SNP-fgr分子标记对空育131(fgr)BC3F2代植株进行前景鉴定选择(见图5)。在22个BC3F2代植株中1号和20号植株表现出稻花香2号带型,说明第1号和第20号植株是fgr基因的纯合体;2、3、4、5、6、7、8、10、11、13、14、15、17、18、19、22号植株表现为双亲带型,是Fgr/fgr基因的杂合体;其余植株表现出空育131带型,不含有fgr基因。选择fgr基因的纯合体,令其自交获得BC3F3代株系2个,即水稻空育131(fgr)-1和空育131(fgr)-2。
在水稻空育131(fgr)-1和空育131(fgr)-2株系中各随机选取5株,利用SNP-fgr标记进行鉴定(见图6)。图6显示,所有空育131(fgr)导入系植株都与稻花香2号基因型一致,说明水稻空育131(fgr)-1和空育131(fgr)-2株系为fgr基因纯系。
2.3 候选的水稻空育131(fgr)导入系农艺性状
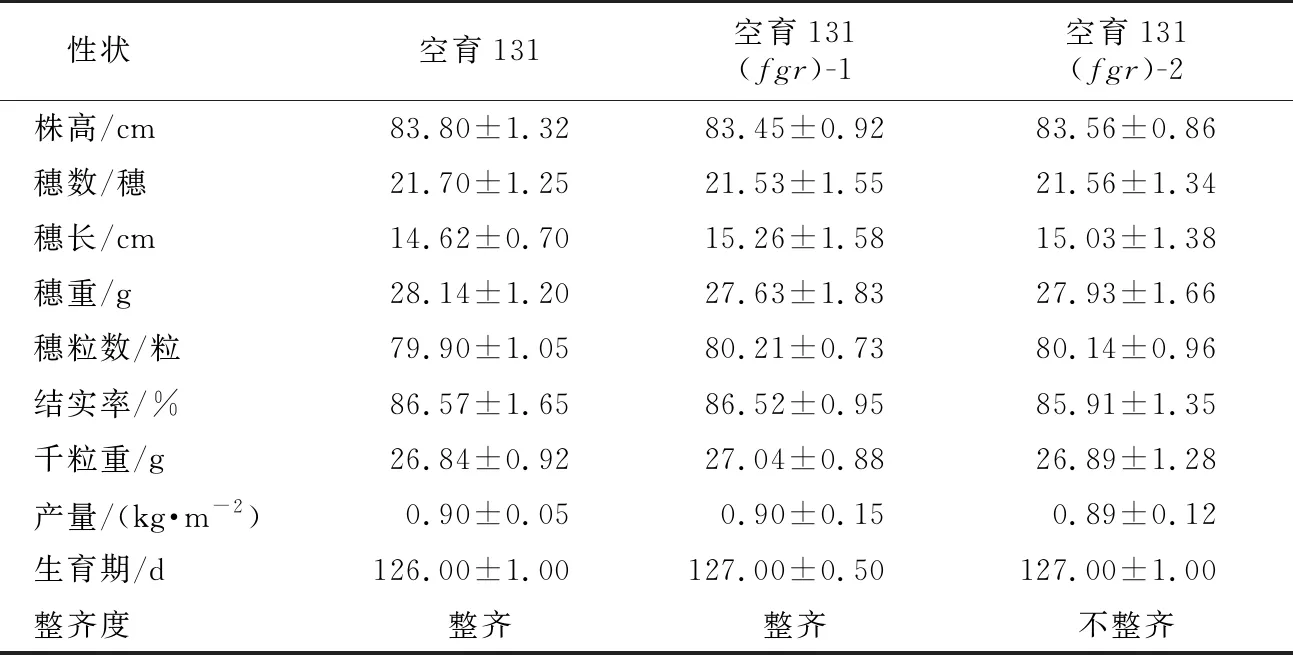
对候选的水稻空育131(fgr)导入系进行农艺性状调查并与空育131进行比较(见表4),生育期、株高、穗数、穗长、穗重、穗粒数、结实率、千粒重及产量等性状,空育131(fgr)-1、空育131(fgr)-2与对照空育131均不存在显著性的差异。但是,空育131(fgr)-2田间整齐度较差,淘汰。选择空育131(fgr)-1为空育131(fgr)导入系,进行进一步的鉴定。
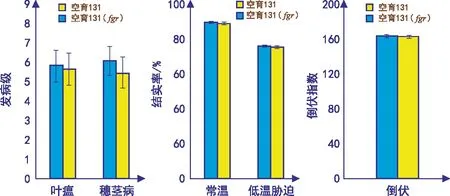
图 7 水稻空育131(fgr)导入系稻瘟病抗性、耐冷性和抗倒伏性
2.4 水稻空育131(fgr)导入系稻瘟病抗性、耐冷性和抗倒伏性
图7显示,空育131(fgr)导入系与空育131叶瘟发病级及穗颈瘟发病级不存在显著性差异;在常温状态下及低温胁迫时水稻空育131(fgr)与空育131结实率差异均不显著;水稻空育131(fgr)导入系与空育131的倒伏指数也未见显著性差异。所有这些说明,水稻空育131(fgr)导入系的稻瘟病抗性、耐冷性和抗倒伏性与空育131水稻相同。
2.5 水稻空育131(fgr)导入系稻米香味性状
10位对气味敏感的检测人员对水稻空育131(fgr)导入系和空育131不同比例的精米样品进行香味鉴定(见表5)。表5显示,10个人对空育131均不能嗅到香味,而对水稻空育131(fgr)导入系均能嗅到香味,说明这10个人具有对稻米香味的判别能力。从表5还可知,空育131(fgr)导入系稻米比例为20%时有43.3%的人可以嗅到香味,比例为40%时有76.7%的人可以嗅到香味,比例超过60%时所有人均能嗅到香味。说明空育131(fgr)导入系的稻米具有香味性状;在空育131稻米中加入空育131(fgr)导入系稻米的比例越大,香味越明显。
表5 水稻空育131(fgr)导入系稻米香味性状
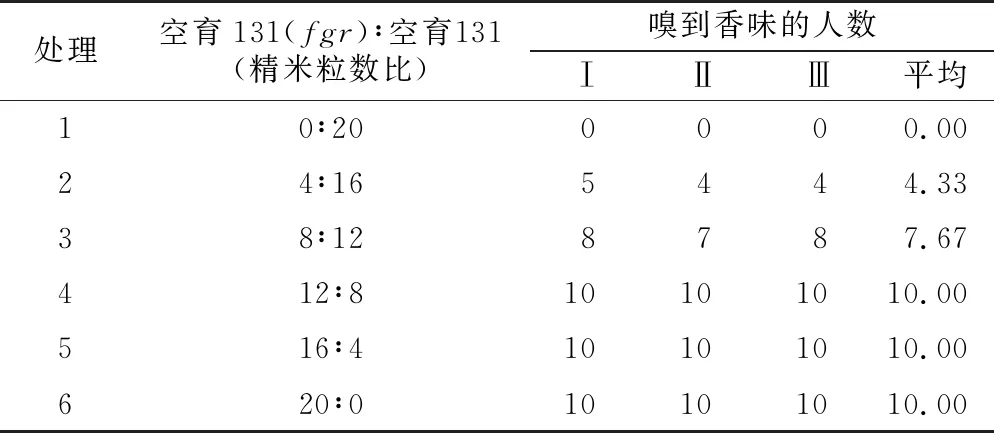
处理空育131(fgr)∶空育131(精米粒数比)嗅到香味的人数ⅠⅡⅢ平均10∶200000.0024∶165444.3338∶128787.67412∶810101010.00516∶410101010.00620∶010101010.00
3 讨论与结论
植物连续多代回交可以使非轮回亲本细胞核被轮回亲本细胞核所替换。回交结合对来自非轮回亲本基因的选择,可以创制具有非轮回亲本(供体亲本)基因、遗传背景为轮回亲本(受体亲本)的导入系。常规方法回交创制导入系存在目标基因隐性、或显性但无表达条件时的正向选择困难,来自于供体亲本的与目标基因紧密连锁不良基因的连锁累赘,以及回交世代过多等障碍。MAS技术回交转育创制植物目标基因导入系,可以不受基因显隐性及选择条件的限制,有效地打破连锁累赘,提高选择效率,缩短植物育种工作年限[24]。Zhang J等[25]、李孝琼等[26]、张安宁等[27]、田大刚等[28]、曾文秀等[29]和陈传华等[30]通过MAS技术创制或培育出了双抗病虫害、抗褐飞虱、抗稻瘟病、香型软米及高产优质抗病的水稻新种质或新品种。王伟等[31]利用MAS技术选育出一批含有3隐性基因、2隐性基因或单隐性基因的玉米近等基因系材料,为玉米品质育种和机理研究提供了材料基础。MAS技术不仅应用于大田农作物育种,在黄瓜、番茄、辣椒、荔枝、烟草等蔬菜及经济植物上也得到成功应用[32-39]。水稻是世界重要主粮作物,基因组小,是研究比较深透的模式植物。水稻全基因组序列已知,较多的基因被定位和克隆,在此背景下利用MAS技术对水稻基因进行转育就成为了水稻育种工作极为有效的手段[40]。本研究利用MAS技术回交创制了背景恢复率达100%的候选水稻空育131(fgr)导入系,田间试验选择出了具有一致性及遗传稳定性的、与空育131主要农艺性状没有差异的空育131(fgr)导入系。应用《水稻品种鉴定技术规程SSR标记法》(NY/T 1433-2014)中的所有48个SSR分子标记评估入选的空育131(fgr)导入系和空育131水稻,二者在这48个SSR分子标记上没有差异,显示二者为相同或极近似品种。同时,对入选的空育131(fgr)导入系的耐冷性、抗稻瘟病性、抗倒伏性、香味等性状进行鉴定,早粳稻空育131(fgr)导入系具有香味,其他鉴定性状与空育131相同。本研究已经成功地培育了水稻空育131(fgr)导入系。
作物品种的突破性进步往往在于关键性基因资源的发掘和利用。黑龙江省水稻品种基本为早粳稻纯系品种[41]。目前黑龙江省特别是北部水稻主产区的水稻品种均直接或间接来自于日本水稻。空育131是引自于日本北海道的水稻材料,具有耐冷性强、早熟、丰产、株型清秀等特性,曾经是黑龙江省年种植面积最大的品种,也是中国粳稻年种植面积的纪录保持品种[42-43]。近年黑龙江省新育成的品种与空育131比较,除了米质性状有所提高、抗稻瘟病性有变化外,基本特征特性并没有明显改善,甚至有的新品种还不如空育131综合性状优良。黑龙江省作物生长季节短,低温天气频繁,寒区温度低与水稻喜温性是黑龙江省水稻生产的基本矛盾。每3~4年黑龙江水稻就有一次低温冷害年[44],耐障碍性冷害强是黑龙江水稻品种必须具备的基本特性,空育131是孕穗开花期耐冷性最强的水稻材料之一。空育131水稻品种适应区域是机械化水平高的黑龙江省水稻主产区。机械收割要求水稻品种具有较强的抗倒伏性。空育131水稻在生产上大面积应用多年,其抗倒伏性满足机械收割要求。随着经济发展和人们生活水平提高,市场对稻米品质要求越来越高,稻米品质的优劣直接影响水稻品种种植推广和商品价值,香味是稻米的重要食味品质性状之一[45]。空育131是非香味水稻,这也是限制其在生产上继续大面积应用的原因之一。本研究成功赋予空育131水稻香味基因,同时保留了空育131的遗传背景,培育了空育131(fgr)导入系。水稻空育131(fgr)导入系稻米具有香味,耐冷性和抗倒伏性与受体品种空育131没有显著差异。香米空育131(fgr)导入系可以在黑龙江省水稻生产上示范试种,具有在寒区绿色优质水稻生产上推广应用的可能性。
