连续性肾脏替代治疗对脓毒症患者外周血部分T淋巴细胞、miRNA-155和miRNA-466表达的影响*
2020-06-12郑燕玲张应魏邓小彦
郑燕玲,张应魏,邓小彦
(1.海南医学院第一附属医院 重症医学科,海南 海口 570000; 2.海南省老年病医院 神经内科,海南 海口 571100)
脓毒症是因感染诱发的全身炎症反应综合征,脓毒症发生过程中机体的先天性免疫系统被激活,使患者机体发生强烈的免疫应答[1];有研究表明,在疾病持续发展过程中机体的免疫功能会发生异常,因固有免疫细胞过度活化而出现炎症反应与细胞免疫功能紊乱及损害[1-2]。微小RNA(microRNA,miRNA)作为内源性基因编码的非编码单链RNA分子,是直接由核苷酸酶DiceR剪切加工而成,其长度为21~23个核苷酸[3]。研究显示,miRNA与多种疾病发生、生理及病理过程密切相关,机体处于免疫功能异常或高炎症刺激时miRNA表达会出现异常[4]。近年的研究发现,miRNA-155、minRNA-466在脓毒症的发生发展过程中具有关键的调控作用,可在一定程度中反映机体炎症情况与免疫功能[5]。连续性肾脏替代治疗(continuous renal repalccment therapy,CRRT)经过连续清除患者血液中的毒素、中小分子物质及致病介质来保障机体内环境的平衡,对脓毒症患者的炎症反应与机体免疫应答具有调节作用,但目前CRRT对脓毒症患者外周血microRNA-155、microRNA-466表达的影响未见报道。本研究对42例脓毒症患者进行CRRT治疗,观察治疗后患者外周血miRNA-155、minRNA-466的表达变化,报告如下。
1 资料与方法
1.1 一般资料
选取2018年2月-2019年2月收治的脓毒症患者80例,采用随机数字表法分为观察组(42例)与对照组(38例)。所有入选患者符合《2001年国际脓毒症定义会议关于脓毒症诊断的新标准》[6]中脓毒症诊断标准,年龄65~74岁;排除既往进行过肾移植手术者、确诊为终末期肾脏疾病者,排除已明确或疑似肾脏性疾病及低血容量性休克患者。观察组男28例、女14例,平均(72.32±2.21)岁,急性生理与慢性健康(acute physiology and chronic healthevaluation,APACHE Ⅱ)评分(22.17±7.20)分,全身性感染相关性器官功能衰竭评分(sequential organ failure assessment,SOFA)评分(10.52±2.75)分;对照组男26例、女12例,平均年龄(72.18±2.19)岁,APACHE Ⅱ评分(22.35±8.18)分,SOFA评分(10.21±2.62)分,2组患者一般资料比较,差异无统计学意义(P>0.05);本研究所有入选患者均为自愿参与,且签署知情同意书;本研究经医院伦理委员会批准。
1.2 方法
对照组患者根据国际脓毒症和脓毒症休克指南,采用对症、抗炎、抑菌及补液等治疗,4周为1个疗程;观察组患者在对照组治疗的基础上加用CRRT治疗,以连续性静脉-静脉血液滤过模式,患者血流量保持100~160 mL/min,具体的CRRT清除率与超滤量按照个体现状来确定,治疗持续48 h,2次/周(间隔时间至少24 h),4 周为1个疗程。
1.3 观察指标
比较2组患者治疗前及治疗4周时的APACHE Ⅱ评分、SOFA评分、外周血免疫指标[CD4+、CD8+、CD14+单核细胞人类白细胞抗原DR(monocyte human leukocyte antigen,DRHLA-DR)]、炎症因子 [降钙素原(PCT)、白细胞介素-23(IL-23)、C-反应蛋白(CRP)]、miRNA-155及miRNA-466水平。(1)APACHE Ⅱ评分[7]及SOFA评分[8]:APACHE Ⅱ评分总分为71分,得分越高则提示患者不良预后越严重; SOFA评分总共评估6个系统,评分为0~4分,取得的分数越高则其器官损伤及不良预后越严重。(2)治疗前及治疗4周时抽取患者外周静脉血5 mL,采用流式细胞仪(型号FACScan,赛默飞世尔科技)检测CD4+、CD8+、DRHLA-DR,免疫发光夹心法检测PCT含量,酶联免疫吸附法检测IL-23含量,,酶速率散射比浊法检测CRP含量。(3)采用TRIzol一步法提取总RNA,操作步骤根据美国Invitrogen公司TRIzol试剂盒说明,总RNA的吸光度值采用紫外分光光度计(型号UV-5200,上海仪电分析仪器有限公司)测定,引物为上海生工生物工程股份有限公司合成,反应总体积25 μL,反应条件为95 ℃预变性 15 min,95 ℃ 15 s、70 ℃ 90 s、60 ℃ 60 s,共35个循环,miRNA-155及miRNA-466相对表达量采用2-△△Ct法计算。
1.4 统计学方法
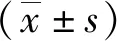
2 结果
2.1 APACHE ⅡI及SOFA评分
治疗前,2组患者APACHE Ⅱ、SOFA评分比较,差异无统计学意义(P>0.05);治疗后,2组患者APACHE Ⅱ、SOFA评分较治疗前显著降低(P<0.05),观察组患者APACHE Ⅱ、SOFA评分低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者治疗前及治疗4周时APACHE Ⅱ及SOFA评分Tab.1 Comparison of APACHE Ⅱ and SOFA scores before and after treatment in both groups
注:(1)与同组治疗前比较,P<0.05;(2)与对照组治疗4周时比较,P<0.05。
2.2 外周血免疫学指标
治疗前,2组患者CD4+T淋巴细胞、CD8+T淋巴细胞、DRHLA-DR百分比比较,差异无统计学意义(P>0.05);治疗后,2组患者CD4+T淋巴细胞、CD8+T淋巴细胞、DRHLA-DR百分比较治疗前显著升高(P<0.05),观察组患者CD4+T淋巴细胞、CD8+T淋巴细胞、DRHLA-DR百分比显著高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组患者治疗前及治疗4周时部分外周血免疫学指标/%Tab.2 Comparison of peripheral blood immune indexes before and after treatment in both groups/%
注:(1)与同组治疗前比较,P<0.05;(2)与对照组治疗4周时比较,P<0.05。
2.3 炎症因子
两组患者治疗前及治疗4周时结果比较,治疗前,2组患者血清PCT、IL-23及CRP水平比较,差异无统计学意义(P>0.05);治疗后,2组患者血清PCT、IL-23及CRP水平较治疗前显著降低(P<0.05),观察组患者血清PCT、IL-23及CRP水平显著低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者治疗前及治疗4周时部分炎症因子水平/(ng/L)Tab.3 Comparison of inflammatory factors levels before and after treatment in both groups/(ng/L)
注:(1)与同组治疗前比较,P<0.05;(2)与对照组治疗4周时比较,P<0.05。
2.4 miRNA-155及miRNA-466表达水平
治疗前,2组患者外周血miRNA-155、miRNA-466表达水平比较,差异无统计学意义(P>0.05);治疗后,2组患者外周血miRNA-155、miRNA-466表达水平较治疗前显著降低(P<0.05),观察组患者外周血miRNA-155、miRNA-466表达水平显著低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 两组患者治疗前及治疗4周时外周血miRNA-155及miRNA-466表达水平Tab.4 Comparison of miRNA-155 and miRNA-466 expression before and after treatment in both groups
注:(1)与同组治疗前比较,P<0.05;(2)与对照组治疗4周时的比较,P<0.05。
3 讨论
CRRT可清除脓毒症患者中小分子溶质、与脓毒症相关的炎症因子、调节电解质与酸碱平衡紊乱,同时可在稳定血流动力学基础中作用于免疫应答失衡,降低对脏器的损伤,保证内环境稳定性[9-10]。有研究报道,脓毒症患者无论是否发生急性肾功能损伤,皆可在集束化治疗基础中联合CRRT治疗[11]。
APACHE Ⅱ、SOFA评分作为目前国际中应用于危重学科的评分系统,其评分结果与疾病严重程度密切相关,尤其在脓毒症患者的病情分类与预后判断中广泛应用[12]。本研究结果中发现,治疗后2组APACHE Ⅱ、SOFA评分较治疗前显著下降;且观察组APACHE Ⅱ、SOFA评分下降更显著,提示治疗后患者病情得到改善。有研究报道,脓毒症患者机体常因CD8+T细胞调控细胞内病原体的“继发性”高度敏感。在外源性导致的敏感源中,CD8+T细胞经特异性识别经MHC I类分子提呈的内源性抗原肽,从而清除病原体感染细胞或肿瘤细胞,在感染与肿瘤免疫中至关重要[13]。此外,CD14+单核细胞HLA-DR的表达、CD4+T等均参与了脓毒症患者免疫功能的调控,DRHLA-DR作为单核巨噬细胞表层中分泌的抗原,是构成单核巨噬细胞提成外来抗原的首要分析,HLA-DR可把单核巨噬细胞吞噬同时将抗原传递到CD4+、CD8+T辅助细胞,从而活化T细胞、B细胞、巨噬细胞等免疫细胞,所以HLA-DR水平对免疫功能具有重要作用[14]。脓毒症患者的CD4+、CD8+T淋巴细胞、患者的机体免疫状态较差,CD4+、CD8+T淋巴细胞的变化基本可以反应脓毒症患者的细胞免疫状况,本研究中,治疗后2组患者CD4+、CD8+T淋巴细胞、DRHLA-DR百分比较治疗前升高,观察组升高更显著,提示在采用CRRT治疗后患者CD4+、CD8+T淋巴细胞有不同程度的恢复,CRRT对机体免疫机能具有调节作用,上调血清T淋巴细胞亚群水平,提高患者免疫功能。
研究发现,免疫功能失调会使机体出现炎症反应与细胞免疫功能紊乱及损害,细胞因子PCT、IL-23及CRP水平会由于机体免疫功能的下降而升高[15-18]。PCT是降钙素的前体,在机体发生感染时,PCT呈现高表达,同时在内毒素刺激3~4 h,PCT水平会在8~24 h达到高峰,是目前临床应用评估重症患者感染的标志物,可有效监测脓毒症变化。IL-23作为异源性二聚体蛋白,具有多元化的生物学作用,能够分化成熟的T淋巴细胞加快其分泌,在脓毒症患者IL-23水平显著高于健康者[19]。CRP主要来源于肝脏分泌合成,在机体受严重侵损与感染时呈现为高表达,尤其在炎症应答4~6 h内,CRP短时间中呈现为高表达且在36~50 h内水平达到临界值[20],有研究表明,脓毒症患者血清CRP水平与健康群体比较显著较高[21]。本研究结果发现,脓毒症患者治疗前PCT、IL-23及CRP水平呈现高表达,在治疗后显著降低,且采用CRRT治疗的观察组下降更显著,进一步提示CRRT治疗可显著抑制脓毒症患者炎症因子表达水平来阻止病情进一步恶化。miRNA在机体处于高炎症状态与低免疫功能时表达情况异常[22]。近年来关于脓毒症相关研究发现,miRNA-155是感染患者炎症网络效应的平衡点,全程参与病理生理阶段,可作为评估疾病发展的特异性指标[23]。mircroRNA-466同样作为参与感染患者病情发展的分子标志物,广泛分布于组织与体液中,在感染患者中miRNA-466异常表达,mircroRNA-466还可能与急性反应相关,同时参与转录因子AP-1、NF-KBI的调控,可能由于其可加快脂质介质蛋白表达,而凋亡的中性粒细胞可在脂质介质蛋白作用于被巨噬细胞摄取来达到降低炎症反应的作用[24]。此外,还有研究学说认为miRNA-466作用于PIK3、MAPK传导信号激活通路,引起细胞因子风暴进一步导致脓毒症患者发生感染性休克与多器官衰竭[25]。本研究结果显示治疗前miRNA-155、miRNA-466受高CD4+、CD8+T淋巴细胞、DRHLA-DR免疫水平与高PCT、IL-23、CRP等炎症因子水平的影响而升高,在CRRT治疗后机体免疫水平与炎症因子下调,而miRNA-155、miRNA-466表达下降,提示CRRT治疗可影响脓毒症患者外周血miRNA-155、miRNA-466的表达。
综上所述,CRRT可调控CD4+、CD14+HLA-DR、CD8+水平,减轻PCT、IL-23、CRP炎症因子与miRNA-155和miRNA-155表达。但由于本研究为小样本研究,需进一步扩大样本的多中心研究中验证,以获得更准确的结果。
