肺浸润性黏液腺癌1例报告及文献复习
2020-06-12刘伽莹
赵 敏,金 鑫,邸 鑫,田 畅,刘伽莹,丛 珊,王 珂
(1.吉林大学第二医院呼吸与危重症医学科,吉林 长春 130041;2. 吉林大学第二医院肿瘤血液科,吉林 长春 130041)
肺癌是全球范围内致死率最高的恶性肿瘤之一。非小细胞肺癌(non small cell lung cancer, NSCLC)占肺癌总发病率的80%,肺腺癌(lung adenocarcinomas,ADCs)是NSCLC常见的病理亚型,并且其患病率正逐年增加[1]。侵袭性黏液腺癌(invasive mucinous adenocarcinoma,IMAs),原被称为黏液性细支气管肺泡癌,在2015年世界卫生组织分类以及2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会肺腺癌分类系统中,被归类为变异性肺腺癌[2]。 尽管IMAs发病率相对较低(仅占所有肺腺癌的2%~5%),但研究[3-4]已证明:IMAs在临床、病理、基因组和预后方面与侵袭性非黏液腺癌有明显差异。IMAs肿瘤细胞的特征是胞质中有富含黏蛋白的杯状或柱状细胞。与侵袭性非黏液性腺癌比较,IMAs患者的KRAS突变显示出与疾病更强的相关性[4]。目前靶向治疗已逐渐成为晚期NSCLC最重要的全身治疗手段之一,表皮生长因子受体(epidermal growth factor receptor,EGFR)突变、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)重排和原癌基因1酪氨酸激酶(c-ros oncogene 1 receptor tyrosine kinase,ROS1)染色体重排等已经成为肺腺癌靶向治疗前的常规检测手段,KRAS突变的出现意味着患者对EGFR-酪氨酸激酶抑制剂(TKIs)治疗效果较差,针对特异驱动基因突变的检测及靶向治疗可使患者预后明显获益[5-6]。有关IMAs病例的诊治经验国内外相关报道[4]较少。本文作者报道1例IMAs患者的影像学表现和基因特征,为IMAs临床治疗方案的制订提供参考。
1 临床资料
1.1 一般资料患者,女性,42岁,于2019年2月9日就诊于吉林大学第二医院呼吸与危重症医学科,以肺炎收入院,自2018年12月开始,患者首发症状为寒战和发热,体温最高可达40℃,伴咳嗽和咳痰,痰为白色泡沫痰,痰量每日约500 mL,易咳出,无腹痛、腹泻,无尿频、尿急或排尿困难。曾就诊于在当地医院,行胸部CT检查提示双肺肺炎,抗感染治疗效果不满意,近2个月体质量下降约10 kg。
1.2 诊疗过程患者行纤维支气管镜检查显示:声门开闭良好,气管隆突锐利,黏膜充血,气管腔通畅,双肺各管腔可见较多分泌物,未见新生物,其余肺各叶、段和亚段均未见异常改变。右肺下叶外后基底段行经支气管镜肺活检术(transbronchial lung biopsy,TBLB),病理回报肺组织内见少量异型细胞,主要呈微乳头状生长,伴有黏液分化,不能完全除外肿瘤,病变小;免疫组织化学染色:p63(-)、TTF-1(-)、Ki67(阳性率1%)。灌洗液:送检标本内有较多中性粒细胞,少量鳞状上皮、腺上皮、巨噬细胞和淋巴细胞,未见恶性细胞。痰培养和痰脱落细胞未见异常。同时提检肿瘤标志物:肿瘤相关抗原CA199 > 1 200 U·mL-1,癌胚抗原(CEA)为22.03 μg·L-1,肿瘤相关抗原CA125为40.10 U·mL-1,肿瘤相关抗原CA50为90.33 U·mL-1。结合上述检查结果,考虑肿瘤可能性大,复查患者胸部CT(图1),患者出现右侧胸腔积液,为患者行胸腔积液引流术,并行胸水脱落细胞病理检查,结果显示:少数淋巴细胞坏死,未见癌细胞。胸腔引流液中可见条索状坏死组织流出。期间患者行抗感染治疗(头孢唑肟联合莫西沙星)11 d,效果差。于2019年2月20日行经皮肺组织穿刺,病理回报:ADCs,部分肿瘤细胞内富含黏液。基因检测结果显示:KRAS外显子存在2点突变。
1.3 治疗方法按照国际肺癌研究学会(IASLC)2017年颁布的第8版《肺癌TNM分期标准》判定患者分期为T4NxM1,Ⅳ期,已丧失手术机会。患者Zubrod体力状态(Zubrod perfor mance status,ZPS)评分2分,可以进行化疗,患者确诊后接受以紫杉醇联合卡铂的一线化疗方案,并联合应用血管靶向药物贝伐珠单抗。2个治疗周期后患者一般状态尚可,咳嗽和咳痰较前期明显减少,脱发严重,恶心呕吐等其他化疗反应减轻,患者复查胸部CT可见黏液明显减少,出现空洞样结构。 见图2。
2 讨 论
IMAs是一种少见的ADCs组织学亚型。黏液的产生是黏液腺癌的一种典型特征,起源于具有多向分化潜能的干细胞,并根据分化微环境性质而分泌黏液[7]。该患者为中年女性,无吸烟史,主要症状为发热、咳嗽咳痰、大量清水样痰且易咳出,考虑患者黏液分泌量大(每日约500 mL),导致阻塞性肺炎,造成前期发热。通常情况下,癌细胞分泌的黏液可以痰液形式排出,但如果癌细胞生长过快,则可导致黏液过度产生,从而造成气道阻塞。因此可能出现阻塞性肺炎[8]。
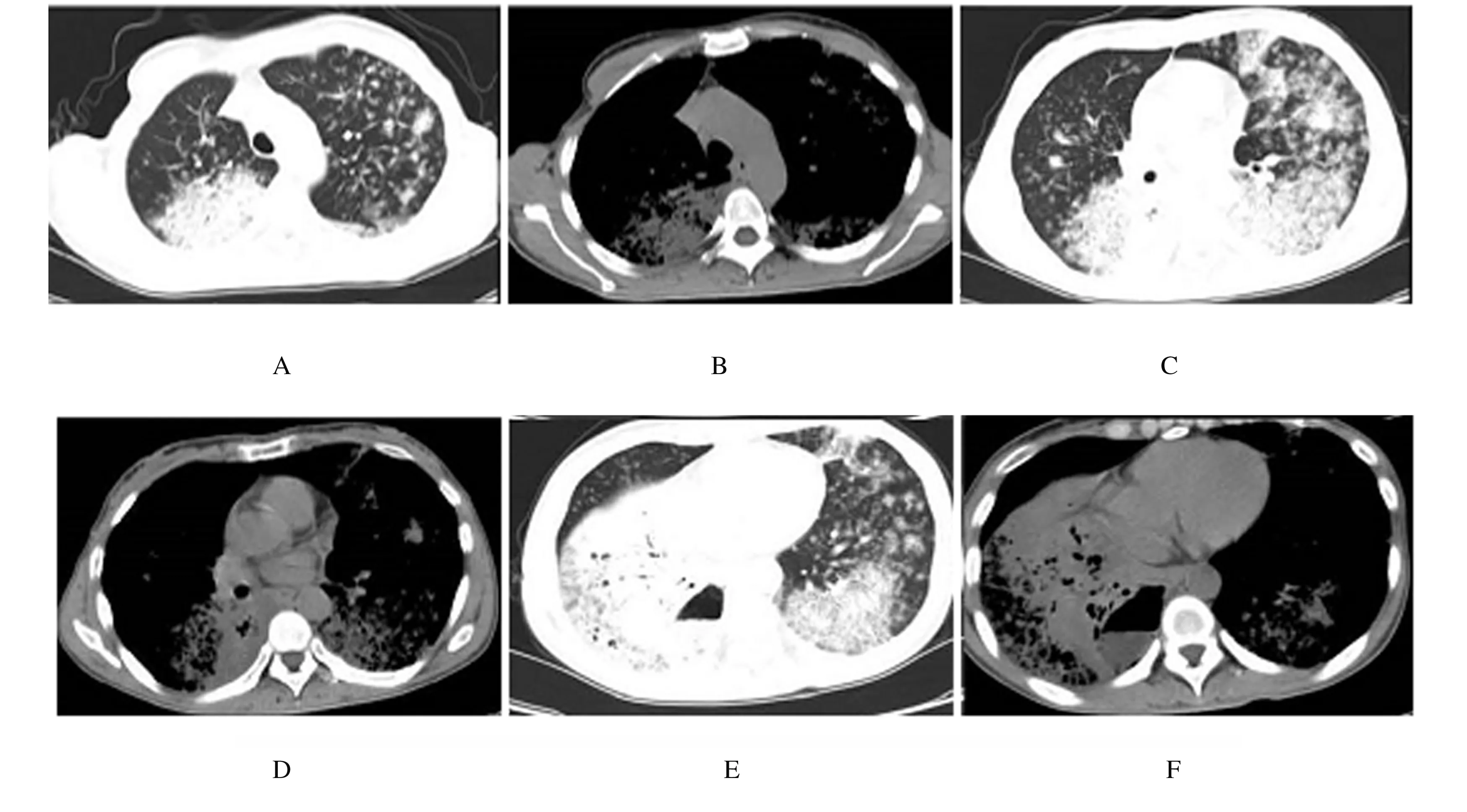
图1 治疗前IMAs患者胸部CT影像

图2 2次化疗后IMAs患者胸部CT影像
研究[4,9]证实:与其他类型ADCs比较,IMAs患者发生胸膜受累、淋巴结和血行转移的概率小,比较容易经气道播散,造成双肺弥漫的癌性病灶。目前学术界认为IMAs影像学表现上可分为2种:肺炎型IMAs与孤立性肺结节型IMAs(solitary pulmonary nodule type IMAs,SPN-type IMAs)。肺炎型IMAs因与肺炎患者的胸部CT结果相似而得名。原发性肺黏液腺癌均发生于肺段以及远支气管,主要分布于肺的外周部,各肺叶均有可能发生,提示该类型肺癌病理基础主要为肿瘤气道播散所致肺腺泡实变;该患者的影像学表现:双肺均可见斑片状影,密度、大小和分布均匀,在外周肺野表现较明显,多簇状分布以囊性成分为主,这与癌组织分泌大量的黏液相互融合后形成的黏液囊有关,若与支气管相通就可形成气-液囊肿。原发病灶周围伴有多发类圆形卫星灶,其大小基本均匀一致,并且其形态和密度等特性与原发病灶大体相同[10]。另一种为SPN-type IMAs;LEE等[11]和WATANABE等[12]通过分析大宗临床数据证明:SNP-type IMAs比肺炎型IMAs更常见。SNP-type IMAs患者CT影像学检查提供的信息量较少,几乎无法单纯以CT影像区分SNP-type IMAs和结节型非黏液性腺癌,最近CHA等[4]研究显示:PET/CT检查可以作为从孤立性肺结节型肺ADCs中排除IMAs的金标准。
目前关于晚期NSCLC患者药物治疗的方法较多患者,包括放疗、化疗、血管靶向治疗、驱动基因靶向治疗和免疫治疗等方法。对于驱动基因阴性的患者可以选择放化疗,同时联合血管靶向治疗或免疫治疗;而对于驱动基因阳性的患者,可以选择针对驱动基因的靶向治疗,如EGFR突变阳性的患者可以选择应用TKIs,如吉非替尼和厄洛替尼等。KRAS突变反映患者对TKIs治疗耐药[13]。研究[14]显示:IMAs主要以KRAS突变为主,而EGFR突变发生率很低。本研究基因检测结果显示:KRAS外显子存在2点突变,也可证实上述研究结论。迄今为止针对KRAS突变的实验性药物有很多,如KRAS信号传导的下游效应分子焦点黏附激酶(focal adhesion kinase, FAK)抑制剂地法替尼、MEK抑制剂司美替尼和mTOR抑制剂雷帕霉素等,但由于受到KRAS生物化学复杂性的挑战,目前仍无针对直接消除KRAS活性的选择性和特异性抑制剂,而上述治疗方案大多处于临床试验阶段,并未进入常规的临床治疗阶段,故在临床工作中对于单纯KRAS突变的NSCLC患者仍应遵循常规化疗方案。该患者无EGFR突变,故无法选择EGFR分子靶向治疗药物,而选用含铂两药联合的化疗药物,应用紫杉醇加卡铂,并联合应用血管靶向药物贝伐珠单抗,经历2个治疗疗程后,患者自觉咳嗽和咳痰症状明显好转,复查胸部CT可见肺泡内大量斑片状影消失,为空洞样结构,说明化疗可抑制腺泡细胞的生长,减少黏液分泌。该患者胃肠道不良反应和骨髓抑制较轻,继续对该患者进行随访。
近年来,免疫检查点抑制剂作为治疗晚期NSCLC的新方向受到广泛关注,其中以程序性死亡受体1 (programmed death receptor-1, PD-1)报道最多。临床研究[15]显示:相对于多西他赛治疗,晚期NSCLC二线治疗使用程序性死亡配体1(programmed death ligand-1,PD-L1)抑制剂和(或)纳武单抗治疗可以取得更好疗效。研究[15-17]显示:ADCs伴KRAS突变患者的PD-L1表达水平明显高于KRAS野生型患者,同时发现KRAS G12D突变激活了磷酸化细胞外信号调节激酶1/2(phosphorylated extracellular regulated kinase 1/2, p-ERK1/2)和磷酸化AKT(p-AKT), 采用ERK1/2抑制剂SCH772984抑制p-ERK可进一步导致PD-L1表达降低,表明PD-L1表达受KRAS G12D突变的调控,故KRAS突变对免疫检查点抑制剂疗效具有预测意义。
目前关于IMAs预后仍存在争议,研究[18-19]显示:IMAs患者的生存结果与侵袭性非黏液性ADCs患者相近,IMAs在所有侵袭性ADCs中被归类为中级肿瘤组。肿瘤大小是无病生存期(disease-free survival, DFS)的独立预后不良预测指标,是减少总生存期(overall survival, OS)的唯一预测因子。
综上所述,IMAs是罕见的一种ADCs,其影像学表现和突变基因类型不同于其他类型腺癌,本研究为IMAs的诊断和治疗提供了依据。
