抗菌肽LL-37对结肠癌小鼠肿瘤生长的抑制作用及其机制
2020-06-12闫圣玉谢亚锋许志杰丁雅婷刘菀莹刘丽兵
闫圣玉,谢亚锋,许志杰,刘 英,丁雅婷,张 侨,刘菀莹,刘丽兵
(1.南华大学附属第二医院肛肠科,湖南 衡阳 421001;2.南华大学附属第二医院重症医学科,湖南 衡阳 421001;3.南华大学附属南华医院肛肠科,湖南 衡阳 421002)
抗菌肽LL-37作为天然的免疫分子,具有广谱杀菌和抗肿瘤活性[1]。研究[2]显示:LL-37表达水平与肠道微生物的种类和数量有密切关联。肠道微生态失衡是影响结肠癌发生发展的重要原因[3],因此LL-37表达异常可能与结肠癌的发生发展有关联。另有研究[4-6]显示:LL-37能抑制胃癌、急性髓样细胞和淋巴细胞性白血病等恶性肿瘤的发生发展。研究[7]显示:LL-37在正常结肠黏膜组织中高表达,但在结肠癌组织中低表达,并且外源LL-37处理可诱导结肠癌细胞凋亡,因而推测LL-37在结肠癌发生发展过程中起抑癌基因的作用,但目前关于LL-37抑制结肠癌发生发展的具体机制尚未见报道。本研究通过制备结肠癌小鼠模型,观察LL-37过表达对结肠癌荷瘤小鼠肿瘤生长情况和细胞凋亡水平的影响,进一步探讨LL-37在结肠癌中的作用机制,以期为寻找人结肠癌病因和预防提供新思路,为临床上肿瘤治疗提供新的潜在靶点。
1 材料与方法
1.1 细胞、实验动物、主要试剂和仪器人结肠癌HT-29细胞株(BNCC)购自北京北纳生物公司。清洁级6~8周龄BALB/c小鼠,体质量20~22 g,购自湖南远泰生物技术有限公司,动物使用许可证号:SYXK(湘)2016-0004;分笼饲养,饲养温度为19℃~23℃,相对湿度为30%~70%,光照周期为12 h/12 h,自由饮水摄食。LL37 cDNA质粒购自美国Invitrogen公司,磷酸腺苷活化的蛋白激酶(AMPK)抑制剂Dorsomorphin(Dor,50 μmol·L-1)购自美国Sigma-Aldrich公司,逆转录试剂盒PrimeScriptTMRT Reagent Kit和荧光定量试剂盒TB Green®Premix Ex TaqTMⅡ均购自日本TaKaRa公司,GV314腺病毒载体购自上海吉凯生物公司,一抗鼠抗LL-37 购自美国Santa Cruz公司,一抗兔抗p-AMPK(1∶1 000)、兔抗p-mTOR(1∶1 000)、兔抗LC3A(1∶50 000)、兔抗LC3B(1∶1 000)、兔抗GAPDH(1∶2 500)、兔抗AMPK(1∶1 000),兔抗mTOR(1∶2 000)、兔抗Beclin1(1∶2 000)、兔抗Atg5(1∶500)和二抗IgG(1∶2 000)均购自英国Abcam公司。倒置显微镜(TE2000-U)购自日本尼康公司,SDS-PAGE蛋白电泳仪购自美国Bio-Rad公司,实时荧光定量PCR仪(7500)购自美国ABI公司。
1.2 LL-37过表达结肠癌HT-29细胞的构建和细胞中LL-37 mRNA和蛋白表达水平的检测从LL-37质粒中扩增出目的基因,扩增引物序列:Forward 5′-AGGTCGACTCTAGAGGATCCCGCCACCATGAAGACCCAAAGGGATG-3′,Reverse 5′-TCCTTGTAGTCCATACCGGACTCTGTCCTGGGTACAAG-3′。再将GV314腺病毒载体进行双酶切反应(BamHⅠ和AgeⅠ),采用T4连接酶将目的基因插入载体中,构建pGV314-LL-37重组腺病毒载体。将pGV314-LL-37腺病毒包装、扩增并进行滴度测定。按LipofectamineTM2000试剂盒说明书将重组腺病毒载体转染至HEK293细胞中,扩增后检测腺病毒滴度。当HT-29细胞达到70%融合时,按感染复数(MOI)值为75采用腺病毒感染HT-29细胞48 h后,加入嘌呤霉素(1.5 mg·L-1)筛选稳定转染细胞,并采用荧光显微镜观察感染效率,收集细胞,结肠癌HT-29细胞中LL-37 mRNA表达水平采用2-ΔΔCt法计算,LL-37蛋白表达水平=LL-37蛋白条带灰度值/GAPDH条带灰度值。
1.3 实验动物分组和结肠癌HT-29荷瘤小鼠模型的制备在适应性饲养1周后,将BALB/c小鼠随机分为5组:对照组,接种未经感染的HT-29细胞;空载组,接种感染空载质粒的HT-29细胞;LL-37过表达组,接种感染LL-37过表达载体的HT-29细胞;AMPK抑制剂组,接种感染空载体的HT-29细胞后,立刻尾静脉注射2 mg·kg-1Dox,每日1次,持续24 d[8];联合作用组,接种感染LL-37过表达载体的HT-29细胞后,立刻尾静脉注射2 mg·kg-1Dox,每日1次,持续24 d。每组6只小鼠。将HT-29细胞制备成单细胞悬液,调整细胞浓度为2×107mL-1,采用一次性无菌注射器在各组裸小鼠右侧腋下行皮下注射,每只裸小鼠注射剂量为0.1 mL。
1.4 各组小鼠肿瘤生长情况检测待完成小鼠移植瘤造模,每日观察皮下肿瘤的生长情况,每4 d采用游标卡尺测量肿瘤的长径(a)和短径(b),计算肿瘤体积(V):V(cm3)=a×b2/2,并绘制肿瘤生长曲线。24 d后采用断颈法处死小鼠,剥离移植瘤后称质量,取平均值(g),计算各组小鼠抑瘤率。抑瘤率=(对照组平均肿瘤质量-实验组平均肿瘤质量)/对照组平均肿瘤质量×100%。
1.5 TUNEL染色检测各组小鼠细胞凋亡情况根据TUNEL试剂盒操作步骤进行实验。先制作移植瘤组织石蜡切片,再将切片在60℃下烘烤15 min,二甲苯脱蜡,梯度乙醇脱水。然后用蛋白酶K在室温下处理10 min,加入制备好的TUNEL反应工作液,37℃下孵育1 h。采用3%H2O2甲醇溶液室温处理10 min。在37℃下加入过氧化物酶溶液孵育30 min。随后,采用二氨基联苯胺(DAB)对切片进行染色。苏木精复染后,切片采用梯度乙醇脱水,二甲苯透明,树脂封闭。最后在显微镜下观察TUNEL阳性细胞,即凋亡细胞,显微镜下观察显示TUNEL阳性细胞呈黄褐色。
1.6 qRT-PCR法检测各组小鼠肿瘤组织中LL-37 mRNA表达水平采用TRIzol试剂从移植瘤组织中提取分离总RNA。根据逆转录cDNA试剂盒说明书进行cDNA链合成。LL-37 mRNA引物序列:Forward 5′-CCACCATGGGCCTGGTGATGCCT-CTGGCCATC-3′,Reverse 5′-TGTACACTAGGACTCTGTCCTGGGTACAAG-3′;GAPDH为内参,Forward 5′-TCAACAGCAACTCCCACTCTTCCA-3′,Reverse 5′-ACCCTGTTGCTGTAGCCGTATTCA-3′。定量分析反应体系为25 μL:12.5 μL 2×SYBR®Premix Ex TaqTMⅡ、1 μL正向和反向引物、2 μL cDNA模板和8.5 μL ddH2O。采用2-ΔΔCt法分析各组小鼠肿瘤组织中LL-37 mRNA表达水平。
1.7 Western blotting法检测各组小鼠肿瘤组织中自噬相关蛋白Beclin1、Atg5和LC3Ⅰ及LC3Ⅱ和AMPK/mTOR通路相关蛋白AMPK、p-AMPK、mTOR和p-mTOR表达水平取各组小鼠移植瘤组织,剪成小块置于EP管中,再加入含预冷的RIPA裂解液和磷酸酶抑制剂的缓冲液进行匀浆。提取出总蛋白后,置于95℃中震荡5 min使蛋白变性,将20 μg样品在10%聚丙烯酰胺凝胶上分离,并转移到硝酸纤维素膜,采用5%脱脂奶粉封闭,然后与对应的一抗抗体LC3Ⅰ、LC3Ⅱ、Atg5、Beclin1、p-AMPK、AMPK、p-mTOR和mTOR 于4℃孵育过夜。GAPDH作为内参。随后采用1×Tris缓冲盐水和Tween-20(TBST)洗涤3次,每次10 min。加入辣根过氧化物酶标记的二抗室温孵育1 h,采用TBST清洗3次,每次10 min。加入增强化学发光剂ECL,曝光显影后室温晾干,分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
2 结 果
2.1 各组结肠癌HT-29细胞中LL-37 mRNA和蛋白表达水平荧光显微镜下观察到pGV314-LL-37感染结肠癌HT-29细胞48 h后效率超过80%。与对照组和空载组比较,LL-37过表达组HT-29细胞中LL-37 mRNA和蛋白表达水平升高(P<0.01)。见图1和图2(插页八)。
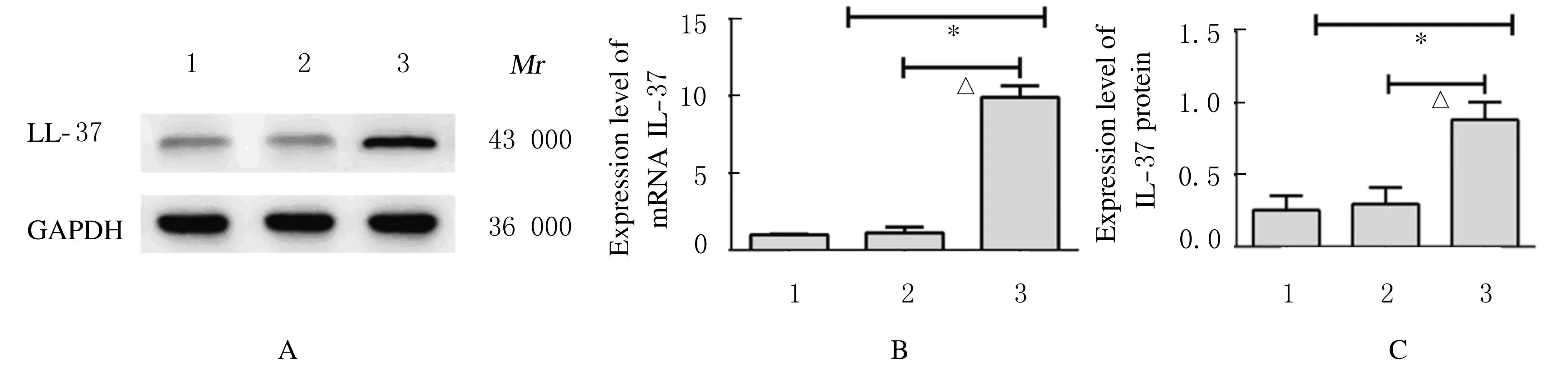
A: Electrophoregram of expressions of LL-37 protein in HT-29 cells in various groups deteceted by Western blotting method (Lane 1: Control group; Lane 2: Empty vector group; Lane 3: LL-37 over-expression group); B: Expression levels of LL-37 mRNA detected by qRT-PCR method(1:Control group;2:Empty vector group;3:LL-37 over-expression group); C:Expression levels of LL-37 protein(1:Control group;2:Empty vector group;3:LL-37 over-expression group).*P<0.01vscontrol group;△P<0.01vsempty vector group.
图1 感染48 h各组结肠癌HT-29细胞中LL-37 mRNA和蛋白表达水平
Fig.1 Expression levels of LL-37 mRNA and protein in colon cancer HT-29 cells in various groups 48 h after infection
2.2 各组小鼠肿瘤生长情况HT-29荷瘤小鼠肿瘤生长的检测指标包括感染24 d后肿瘤质量和抑瘤率。与对照组和空载组比较,LL-37过表达组小鼠肿瘤质量和体积明显降低(P<0.01),抑瘤率升高(P<0.05);AMPK抑制剂组小鼠肿瘤质量和体积明显升高(P<0.05或P<0.01),抑瘤率降低(P<0.05);与LL-37过表达组比较,联合组小鼠肿瘤质量和体积明显升高(P<0.05或P<0.01),抑瘤率降低(P<0.05)。见表1和图3。
表1 感染24 d后各组小鼠肿瘤质量、体积和抑瘤率

GroupWeight of tumor(m/g) Volume of tumor(V/cm3)Inhibitory rate of tumor(η/%)Control 2.42±0.672.57±0.22-Empty vector 2.27±0.522.31±0.346.19LL-37 over-expression 0.85±0.41**△△1.15±0.23**△△69.01△AMPK inhibitor 2.91±0.22*△3.18±0.38**△△-20.25△Combination1.54±0.55#1.77±0.20##36.36#F15.8244.79-P<0.01<0.01-
“-”:No data.*P<0.05,**P<0.01vscontrol group;△P<0.05,△△P<0.01vsempty vector group;#P<0.05,##P<0.01vsLL-37 over-expression group.

图3 感染不同时间各组小鼠肿瘤体积
Fig.3 Tumor volumes of mice in various groups at different time after infection
2.3 各组小鼠肿瘤细胞凋亡情况与对照组和空载组比较,LL-37过表达组小鼠肿瘤组织中黄褐色凋亡细胞明显增多,AMPK抑制剂组小鼠肿瘤组织中凋亡细胞数减少;与LL-37过表达比较,联合组小鼠肿瘤组织中细胞凋亡数减少。见图4(插页八)。
2.4 各组小鼠肿瘤组织中自噬相关蛋白Beclin1、Atg5、LC3Ⅰ和LC3Ⅱ表达水平及LC3Ⅱ/LC3Ⅰ比值与对照组和空载组比较,LL-37过表达组小鼠肿瘤组织中自噬相关蛋白Beclin1和Atg5表达水平及LC3Ⅱ/LC3Ⅰ比值均明显升高(P<0.01);AMPK抑制剂组小鼠肿瘤组织中自噬相关蛋白Beclin1和Atg5表达水平及LC3Ⅱ/LC3Ⅰ比值明显降低(P<0.05或P<0.01)。与LL-37过表达组比较,联合组小鼠肿瘤组织中自噬相关蛋白Beclin1和Atg5表达水平及LC3Ⅱ/LC3Ⅰ比值明显降低(P<0.05或P<0.01)。见图5。
2.5 各组小鼠肿瘤组织中AMPK/mTOR通路相关蛋白AMPK、p-AMPK、mTOR和p-mTOR表达水平及p-AMPK/AMPK、p-mTOR/mTOR比值与对照组和空载组比较,LL-37过表达组小鼠肿瘤组织中p-AMPK/AMPK比值明显升高(P<0.01),p-mTOR/mTOR比值明显降低(P<0.01);AMPK抑制剂组小鼠肿瘤组织中p-AMPK/AMPK比值明显降低(P<0.05),p-mTOR/mTOR比值明显升高(P<0.01)。与LL-37过表达组比较,联合组小鼠肿瘤组织中p-AMPK/AMPK比值明显降低(P<0.05),p-mTOR/mTOR比值明显升高(P<0.01)。见图6。

A: Electrophoregram of expressions of LC3Ⅰ, LC3Ⅱ, Atg5 and Beclin1 proteins deteceted by Western blotting method (Lane 1: Control group; Lane 2: Empty vector group; Lane 3: LL-37 over-expression group; Lane 4: AMPK inhibitor group; Lane 5: Combination group); B: Ratios of LC3Ⅱ/LC3Ⅰ(1:Control group;2:Empty vector group;3:LL-37 over-expression group;4:AMPK inhibitor group;5:Combination group); C:Expression level of Atg5 protein (1:Control group;2:Empty vector group;3:LL-37 over-expression group;4:AMPK inhibitor group;5:Combination group); D: Expression level of Beclin1 protein(1:Control group;2:Empty vector group;3:LL-37 over-expression group;4:AMPK inhibitor group;5:Combination group).*P<0.01vscontrol group;△P<0.05,△△P<0.01vsempty vector group;#P<0.05vsLL-37 over-expression group.
图5 Western blotting法检测各组小鼠肿瘤组织中自噬相关蛋白表达
Fig.5 Expressions of autophagy-related proteins in tumor tissue of mice in various groups detected by Western blotting assay
3 讨 论
抗菌肽是一类具有抗菌活性的碱性多肽物质,能通过破坏细胞膜的功能杀死细菌,并干扰细胞壁的合成[9]。组织蛋白酶是抗菌肽的一大家族,其中LL-37是现阶段发现的唯一一种人类组织蛋白酶抑制素类抗菌肽,由人类抗菌蛋白HCAP-18的C-端部分剪切形成[10]。临床研究[11-12]证明:在急性腹泻和淋病奈瑟菌感染期间,黏膜上皮表面的LL-37表达下调。丁酸盐(一种来自结肠中膳食纤维的细菌发酵产物)可以抑制志贺氏菌病家兔模型中组织蛋白酶表达的降低[13]。-4-苯基丁酸盐(PBA)可以在mRNA和蛋白水平上诱导活性LL-37表达[14]。临床研究[15]显示:健康个体口服PBA后,能在人单核细胞源巨噬细胞中诱导LL-37表达。YUK等[16]研究表明:LL-37能激活人巨噬细胞的自噬,从而降低结合分歧杆菌的细胞内存活率。有研究[17]显示:PBA诱导的自噬依赖于LL-37,并且经受体介导,上述研究结果提示LL-37参与了细胞自噬过程。

A: Electrophoregram of expressions of p-AMPK, AMPK, p-mTOR and mTOR deteceted by Western blotting method(Lane 1: Control group; Lane 2: Empty vector group; Lane 3: LL-37 over-expression group; Lane 4: AMPK inhibitor group; Lane 5: Combination group); B: Ratios of p-AMPK/AMPK(1:Control group;2:Empty vector group;3:LL-37 over-expression group;4:AMPK inhibitor group;5:Combination group); C: Ratio of p-mTOR/mTOR(1:Control group;2:Empty vector group;3:LL-37 over-expression group;4:AMPK inhibitor group;5:Combination group).*P<0.01vscontrol group;△P<0.05,△△P<0.01vsempty vector group;#P<0.05,##P<0.01vsLL-37 over-expression group.
图6 Western blotting法检测各组小鼠肿瘤组织中AMPK/mTOR信号通路蛋白表达
Fig.6 Expressions of AMPK/mTOR signaling pathway-related proteins in tumor tissue of mice in various groups detected by Western blotting method
研究[18]显示:LL-37在肠癌组织中呈异常低表达,而在正常组织中呈高表达,并且LL-37对肠癌的影响与肠道微生物菌群种类有关联。但LL-37在结肠癌中的作用机制尚未明确。本研究通过构建过表达LL-37腺病毒载体,感染人结肠癌HT-29细胞,经荧光观察、qRT-PCR和Western blotting法检测肠癌组织中LL-37表达,说明成功得到稳定过表达LL-37的人结肠癌HT-29细胞。本研究观察小鼠移植瘤生长情况(质量、体积和抑瘤率)、肿瘤细胞凋亡、自噬和AMPK/mTOR信号通路蛋白表达水平,结果显示:过表达LL-37能明显抑制人结肠癌HT-29移植瘤的生长,降低移植瘤的质量和体积,提高抑瘤率,而且还能明显促进细胞凋亡,说明LL-37对人结肠癌HT-29移植瘤具有抑制作用。其次,自噬作为细胞的核心功能之一,参与了癌细胞凋亡[19]。本研究检测自噬相关蛋白表达水平,结果表明:LL-37能明显提高人结肠癌HT-29移植瘤的自噬水平,说明LL-37参与了人结肠癌细胞自噬过程,这与之前的研究[7]结果一致。研究[19-21]表明:AMPK激活可能通过mTOR负调节导致自身吞噬,活化的AMPK通过磷酸化结节性硬化复合体2(TSC2)抑制TORC1的活性。AMPK可直接磷酸化UNC-51样激酶1(ULK1)诱导自噬[22-23]。本研究结果表明:低表达AMPK能明显促进移植瘤生长,提高肿瘤质量和体积,抑制移植瘤细胞凋亡,并且降低移植瘤自噬水平。低表达AMPK还能逆转过表达LL-37对移植瘤生长、凋亡和自噬作用,表明AMPK/mTOR信号通路参与了LL-37对人结肠癌HT-29移植瘤的抑制作用。
综上所述,LL-37通过AMPK/mTOR信号通路影响人结肠癌HT-29移植瘤的生长、细胞凋亡和自噬水平。
