IL-4协同雌二醇对小鼠乳腺癌细胞生长的促进作用及其机制
2020-06-12张韩特孟繁平
冯 磊,张韩特,李 响,孟繁平,李 妍
(1.延边大学免疫学教研室,吉林 延吉 133002;2.吉林医药学院免疫学教研室,吉林 吉林132013)
乳腺癌是女性最常见的恶性肿瘤之一,按雌二醇受体(estrogen receptor,ER)是否表达,可将乳腺癌分为激素依赖型(ER阳性)和激素非依赖型(ER阴性),70% 以上乳腺癌为ER阳性,雌二醇对ER阳性乳腺癌细胞生长有促进作用[1]。肿瘤微环境(tumor microenvironment,TME)包含血管内皮细胞、免疫细胞和成纤维细胞等细胞成分以及细胞外基质、细胞因子及激素等非细胞类成分[2]。TME中T细胞和巨噬细胞偏向Th2分化和M2极化,并分泌白细胞介素4(interleukin-4,IL-4)、白细胞介素10(interleukin-10,IL-10)和转化生长因子β(transforming growth factor β,TGF-β)等细胞因子[3]。雌二醇参与免疫细胞分化和免疫功能调节,可以促进Th2和M2细胞分化,抑制Th1细胞分化和M1细胞极化[4]。目前,雌二醇联合IL-4对乳腺癌细胞生长的作用机制研究较少,雌二醇与IL-4可能在促进乳腺癌生长和转移方面具有协同作用,本研究模拟体内激素与细胞因子共同作用的环境,旨在阐明IL-4和雌二醇对雌激素受体α(estrogen receptor α, ERα)和IL-4受体(interleukin-4 receptor,IL-4R)阳性小鼠乳腺癌4T1细胞生物学行为的影响。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠乳腺癌4T1细胞购自美国标准生物品保藏中心。胎牛血清购自黄岩四季青有限公司,RPMI 1640 培养液购自美国 Gibco 公司,IL-4重组蛋白购自北京义翘科技有限公司,雌二醇购自北京百灵威公司。抗小鼠Erk1、P70S6K、S6蛋白、ERα和信号传导及转录激活蛋白(signal transducer and activator of transcription 6, STAT6)及其磷酸化抗体购自美国SAB公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体和辣根过样化物酶(horseradish peroxidase,HRP)标记第二抗体购自美国Abcam公司,聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜、RIPA裂解液、BCA蛋白定量试剂盒、牛血清白蛋白(bovine serum albumin,BSA)、MTT和碘化丙啶(propidium iodide,PI)购自上海碧云天生物技术有限公司,蛋白电泳和免疫印迹相关缓冲液购自北京索莱宝生物科技有限公司。Epics XL型流式细胞仪购自美国贝克曼公司,2800型凝胶成像系统购自荷兰ProXima公司,DP27型显微镜数码成像系统购自日本奥林巴斯公司。
1.2 细胞培养自液氮中取出冻存的乳腺癌4T1细胞,复苏后采用含 10% 胎牛血清的RPMI 1640 培养液、5% CO2、饱和湿度和37℃消化液(含0.25%胰蛋白酶和0.2%乙二胺四乙酸)消化细胞后传代培养,取对数生长期细胞用于后续实验。
1.3 MTT法检测乳腺癌4T1细胞增殖率体外培养乳腺癌4T1细胞,加入不同浓度IL-4(0、12.5、25.0、50.0和100.0 μg·L-1)或雌二醇(0、6.25、12.50、25.00、50.00 nmol·L-1),作用72 h后MTT比色法检测不同浓度IL-4和雌二醇作用后乳腺癌4T1细胞增殖率;检测前4 h,每孔加入20 μL MTT溶液(5 g·L-1),培养4 h后弃去上清,每孔加入200 μL二甲基亚砜溶解细胞中还原产物甲臜,按不同处理因素分为对照组(不进行任何处理)、IL-4 组(加入50 μg·L-1IL-4),雌二醇组(加入12.5 nmol·L-1雌二醇)和联合组(加入50 μg·L-1IL-4+12.5 nmol·L-1雌二醇),检测波长为490 nm处各组吸光度(A)值,以A值代表乳腺癌4T1细胞增殖率。
1.4 流式细胞术检测各组不同细胞周期乳腺癌4T1细胞百分比收集不同因素处理后的细胞,PBS洗涤2次,采用80%冷甲醇固定细胞,置于-20℃冰箱中保存。检测分析前,将细胞悬液离心后弃上清,采用PBS洗涤2次,采用400 μL染色液(含PI和RNA酶)悬浮细胞,室温染色30 min,采用流式细胞术检测各组不同细胞周期乳腺癌4T1细胞百分比。各周期细胞百分比=各周期细胞数/细胞总数×100%。
1.5 Western blotting法检测各组乳腺癌4T1细胞中STAT6、p-STAT6、ERα、Erk、p-Erk、P70S6K、p-P70S6K、S6和p-S6蛋白表达水平收集细胞,以PBS洗涤2次;末次离心弃上清,加入RIPA裂解液,经过超声破碎制备细胞总蛋白。采用BCA蛋白定量试剂盒检测各组裂解液的蛋白浓度,将各组蛋白浓度调整20 g·L-1,加入上样缓冲液经水浴煮沸5 min,分装蛋白样品并冷冻保存,将蛋白样品上样于聚丙烯酰胺凝胶进行电泳分离;转膜电泳将中蛋白转印于PVDF膜。采用含5%脱脂奶粉的封闭液室温下封闭PVDF膜2 h,膜与稀释的一抗在4℃下反应过夜。次日洗涤PVDF膜3次,将PVDF膜与稀释的HRP标记二抗在室温下反应2 h。洗涤3次后与ECL发光工作液反应2 min,采用凝胶成像系统曝光照相记录结果。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值×100%。
2 结 果
2.1 各组乳腺癌4T1细胞增殖率不同浓度IL-4作用后,与0 μg·L-1IL-4组比较,25.0、50.0和100.0 μg·L-1IL-4组乳腺癌4T1细胞增殖率升高(P<0.05)。不同浓度雌二醇作用后,与0 nmol·L-1雌二醇组比较,12.50、25.00、50.00 nmol·L-1雌二醇组乳腺癌4T1细胞增殖率升高(P<0.05)。见图1。
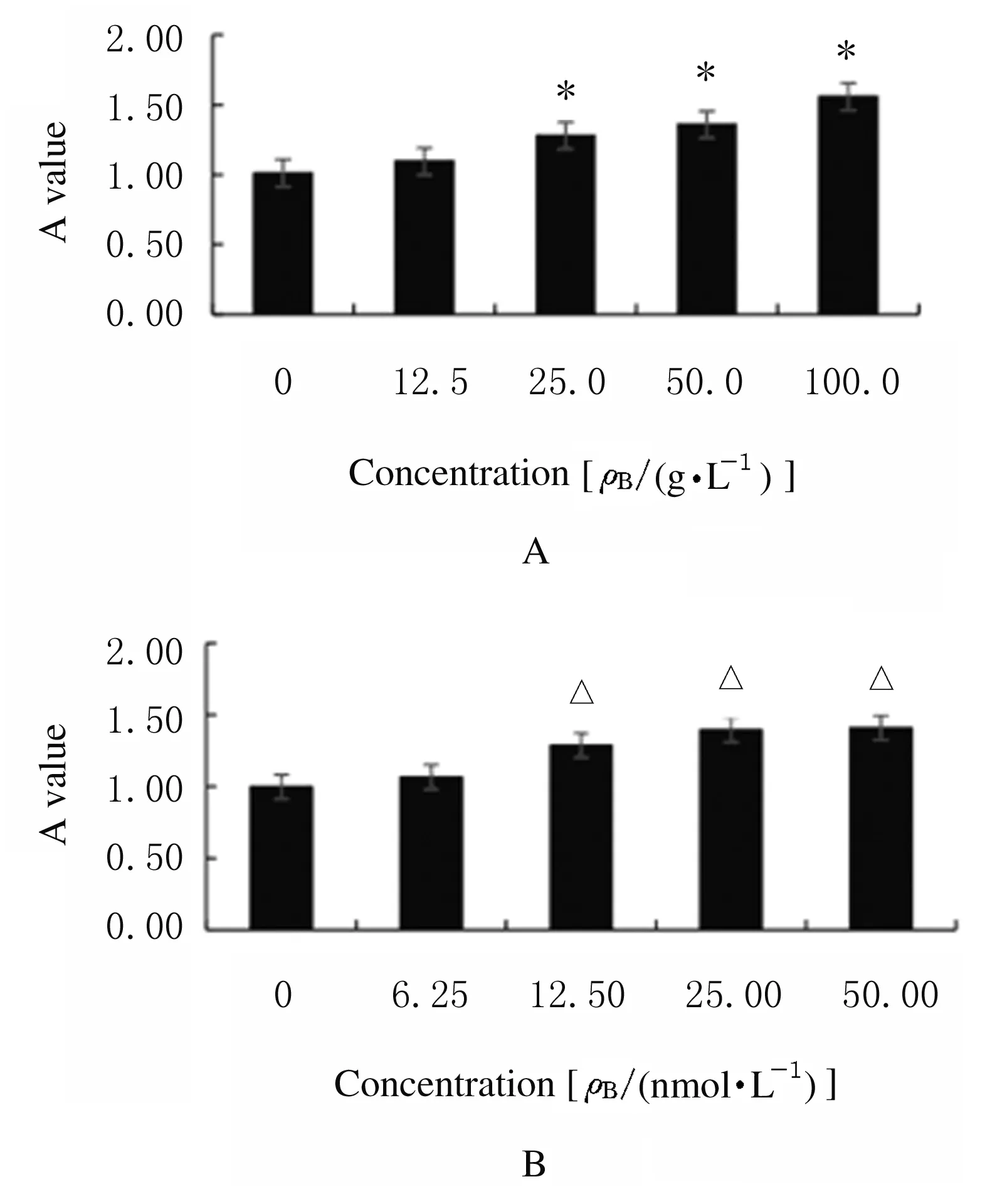
*P<0.05 compared with 0 μg·L-1IL-4 group;△P<0.05 compared with 0 nmol·L-1estradiol group.
图1 IL-4(A)和雌二醇(B)作用后各组乳腺癌4T1细胞增殖率
Fig.1 Proliferation rates of breast cancer 4T1 cells after treated with IL-4(A) and estradiol(B) in various groups
与对照组比较,IL-4 组乳腺癌4T1 细胞增殖率升高(P<0.05);与对照组比较,雌二醇组乳腺癌4T1 细胞增殖率升高(P<0.05);与 IL-4组或雌二醇组比较,联合组乳腺癌4T1细胞增殖率升高(P<0.05)。见图2。

*P<0.05 compared with control group;△P<0.05 compared with IL-4 group;#P<0.05 compared with estradiol group.
图2 各组乳腺癌4T1细胞增殖率
Fig.2 Proliferation rates of breast cancer 4T1 cells in various groups
2.2 各组不同细胞周期乳腺癌4T1细胞百分比与对照组比较,IL-4组S期乳腺癌4T1细胞和G2/M期4T1细胞百分比升高(P<0.05);雌二醇组S期4T1细胞百分比明显升高(P<0.05);与对照组比较,IL-4组和雌二醇组G0及G1期细胞百分比均明显降低(P<0.05)。与 IL-4组或雌二醇组比较,联合组S期和G2/M期4T1细胞百分比升高(P<0.05),而G0及G1期4T1细胞百分比降低(P<0.05)。见图3和表1。
2.3 各组乳腺癌4T1细胞中STAT6、p-STAT6和ERα蛋白表达水平与对照组比较,IL-4组乳腺癌4T1细胞中ERα蛋白表达水平升高, 雌二醇组乳腺癌4T1细胞中 p-STAT6 和ERα蛋白表达水平升高(P<0.05);联合组乳腺癌4T1细胞中STAT6、p-STAT6和ERα蛋白表达水平升高(P<0.05)。见表2和图4。

A:Control group;B:IL-4 group; C: Estrogen group;D:Combination group.

表1 各组乳腺癌4T1细胞的细胞周期百分比
*P<0.05 compared with control group;△P<0.05 compared with IL-4 group;#P<0.05 compared with estradiol group.

表2 各组乳腺癌4T1细胞中STAT6、p-STAT6和ERα蛋白表达水平
*P<0.05 compared with control group.

Lane 1: Control group; Lane 2:IL-4 group; Lane 3:Estradiol group; Lane 4:Combination group.
图4 各组乳腺癌4T1细胞中STAT6、p-STAT6和ERα蛋白表达电泳图
Fig.4 Electrophoregram of expressions of STAT6,p-STAT6, and ERα proteins in breast cancer 4T1 cells in various groups
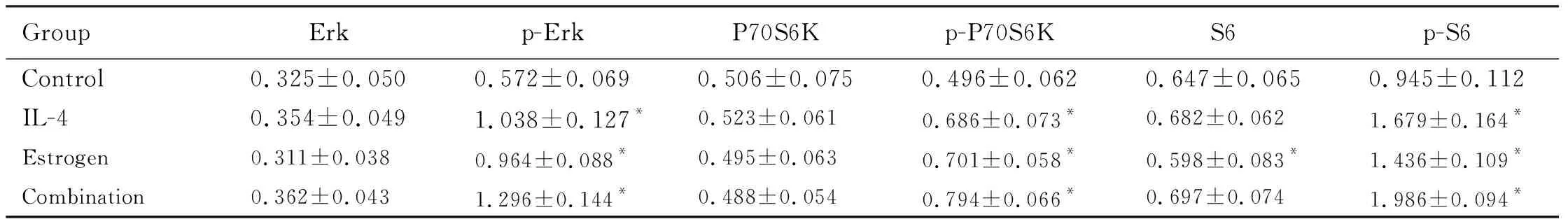
2.4 各组乳腺癌4T1细胞中Erk、p-Erk、P70S6K、p-P70S6K、S6和p-S6蛋白表达水平与对照组比较,IL-4组乳腺癌4T1细胞中p-Erk、p-P70S6K和p-S6蛋白表达水平升高(P<0.05),雌二醇组乳腺癌4T1细胞中p-Erk、p-P70S6K、S6和p-S6蛋白表达水平升高(P<0.05),联合组乳腺癌4T1细胞中p-Erk、p-P70S6K和p-S6蛋白表达水平升高(P<0.05)。见表3和图5。
3 讨 论
癌细胞在TME中生长,不仅包含细胞成分还包含非细胞成分,癌细胞可通过释放信号因子,使相关免疫细胞的抑制作用受到限制,从而使癌细胞获得免疫逃逸,促进其生长和增殖[5]。T细胞、巨噬细胞和NK细胞在TME中已发生极化或转化,释放的细胞因子(IL-4、IL-10和TGF-β1等)参与和维持TME中免疫细胞的诱导分化,释放的趋化因子可以增强血管新生、促进肿瘤细胞增殖[6]。本文作者模拟体内TME,研究免疫细胞、细胞因子与肿瘤的相互作用,更好地理解肿瘤发生、侵袭和转移的机制。
表3 各组乳腺癌4T1细胞中Erk、p-Erk、P70S6K、p-P70S6K、S6和p-S6蛋白表达水平
Tab.3 Expression levels of Erk,p-Erk,P70S6K,p-P70S6K,S6,p-S6, and GAPDH in breast cancer 4T1 cells in various groups
GroupErkp-ErkP70S6Kp-P70S6KS6 p-S6Control0.325±0.0500.572±0.0690.506±0.0750.496±0.0620.647±0.0650.945±0.112IL-40.354±0.0491.038±0.127*0.523±0.0610.686±0.073*0.682±0.0621.679±0.164*Estrogen0.311±0.0380.964±0.088*0.495±0.0630.701±0.058*0.598±0.083*1.436±0.109*Combination0.362±0.0431.296±0.144*0.488±0.0540.794±0.066*0.697±0.0741.986±0.094*
*P<0.05 compared with control group.

Lane 1: Control group; Lane 2:IL-4 group; Lane 3:Estradiol group; Lane 4:Combination group.
图5 各组乳腺癌4T1细胞中Erk、p-Erk、P70S6K、p-P70S6K、S6和p-S6蛋白表达电泳图
Fig.5 Electrophoregram of expressions of Erk,p-Erk,P70S6K,p-P70S6K,S6, and p-S6 proteins in breast cancer 4T1 cells in various groups
IL-4主要由Th2细胞分泌,生理条件下参与 B细胞分化、抗体分泌的调节,除超敏反应和寄生虫感染等情况下IL-4水平升高,多种肿瘤细胞可分泌IL-4,并表达 IL-4R[7]。体内生长的肿瘤不仅受细胞因子的影响,乳腺癌、卵巢癌和前列腺癌等肿瘤生长增殖还受雌二醇、孕激素和雄激素等激素的影响[8]。在肿瘤发生发展过程中,Th2细胞及其所分泌的IL-4/IL-4R可以诱导巨噬细胞的M2型极化,抗凋亡蛋白表达上调,促进癌细胞生长[9]。本研究结果表明:IL-4对 IL-4R阳性的小鼠乳腺癌4T1细胞增殖有影响,与对照组比较,IL-4以浓度依赖方式促进 4T1细胞增殖,50 μg·L-1IL-4促进作用已较为明显。小鼠4T1乳腺癌细胞表面IL-4R表达水平较高,IL-4可以结合癌细胞表面受体,激活JAK1/STATA6信号通路,影响肿瘤周围炎性细胞的分化和功能,导致肿瘤发生免疫逃逸,引起肿瘤细胞的增殖和转移[10];IL-4通过JAK/STAT6信号通路促进巨噬细胞向M2型极化,TEM中巨噬细胞即肿瘤相关的巨噬细胞(tumor associated macrophages,TAMs)为M2极化型[11]。TAM也分泌IL-4和TGF-β等细胞因子,不仅失去杀伤癌细胞的能力,而且是肿瘤组织中细胞发挥旁分泌效应促进肿瘤生长、促进淋巴管和血管生成的重要力量[12]。
IL-4/IL-4R可引起AKT、Erk1/2和mTOR激活,mTOR/p70S6K1信号通路主要参与蛋白质合成、葡萄糖代谢、细胞周期进展和细胞凋亡[13]。mTOR上游通过PI3K/AKT通路或PI3K/AKT/TSC2通路被激活,激活后的mTOR可调节P70S6K1活化[14]。本研究结果显示:IL-4可促进乳腺癌细胞的增殖和转移,当IL-4浓度为25~50 μg·L-1时,IL-4以浓度依赖方式促进4T1细胞生长。IL-4和IL-13(Th2细胞等分泌)等细胞因子可促进巨噬细胞M2极化,M2极化高表达CD206和精氨酸酶 1 (arginase 1, Arg1),分泌TGF-β、IL-4、IL-10、表皮生长因子(epidermal growth factor,EGF)和血管内皮生长因子(vascular endothelial growth factor, VEGF)等,促进细胞生长和组织修复,促进Th2细胞介导的细胞免疫[15]。肿瘤局部Th2细胞通过释放细胞因子促进癌细胞生长,而M2极化TAMs不仅增加Th2细胞因子来源,并可通过MMP-9和VEGF等促进血管和淋巴管重塑;乳腺癌等肿瘤可释放IL-10和TGF-β,参与TME中Th2细胞偏移和TAMs向M2极化[16]。除免疫细胞外,上皮细胞或乳腺癌等上皮源性肿瘤细胞也表达IL-4、IL-10和TGF-β等细胞因子受体,Th2和M2极化细胞的旁分泌效应可促进癌细胞生长[17]。
ER的信号转导途径主要包括2类,膜受体主要启动ERKs、PI3K/AKT和cAMP /PKA等非基因组模式信号;核受体主要转导类固醇的基因组作用信号[18]。按照乳腺癌的分子分型,约70%以上乳腺癌为ER阳性,表达ERα等受体[19]。高表达ERα的乳腺癌可通过阻碍雌二醇的产生或者阻止雌二醇和受体结合而抑制癌细胞增殖;拮抗雌二醇信号也可抑制PI3K、AKT和Erk等激酶介导的促进细胞增殖以及抵抗细胞凋亡的效应[20-21]。本研究结果显示:当雌二醇浓度为12.5~25.0 nmol·L-1时,雌二醇以浓度依赖方式促进4T1细胞生长。IL-4和雌二醇协同作用诱导4T1细胞后,S期和G2/M期细胞百分比升高,而G0/G1期细胞减少,细胞增殖率高于对照组。IL-4和IL-4R也可促进PI3K、AKT和Erk激酶信号的转导。PI3K和AKT参与p70S6K1磷酸化激活; S6蛋白在p70S6K1等激酶的激活下促进细胞中蛋白翻译合成的起始环节。癌细胞分裂增殖和肿瘤转移侵袭均伴随p70S6K1激酶活化和蛋白翻译过程增强。本研究结果显示:IL-4和雌二醇可协同作用促进ER阳性小鼠4T1乳腺癌细胞增殖,两者联合作用可使Erk1、p70S6K1和S6蛋白活化相关位点磷酸化水平升高。本研究结果显示:IL-4对ERα表达有促进作用,而联合组乳腺癌4T1细胞中ERα表达水平高于IL-4组或雌二醇组。IL-4和雌二醇不仅协调促进细胞内激酶Erk和P70S6K的磷酸化,也在ER水平具有协调作用。
综上所述,IL-4和雌二醇协同促进细胞增殖,协同效应涉及多种机制。深入研究IL-4和雌二醇协同作用的分子机制对克服肿瘤耐药、减少癌细胞侵袭和转移具有重要意义。
