DNCB对BALB/c小鼠特应性皮炎的诱导作用及其机制
2020-06-12王欣欣李思佳关洪全侯殿东
王欣欣,李思佳,关洪全,侯殿东
(1. 辽宁中医药大学研究生学院,辽宁 沈阳 110000;2. 辽宁中医药大学中西医结合学院免疫与病原生物学教研室,辽宁 沈阳 110000)
特应性皮炎(atopic dermatitis, AD)是一种常见的慢性炎症性皮肤病,好发于儿童,病程迁延,易复发。AD患者临床症状主要表现为病变处皮肤干燥、瘙痒、湿疹和脱屑[1]。随着工业化进程的加快和伴随而来的环境污染,AD在全球范围内的患病率呈现逐年升高的趋势,儿童AD发病率高达10%~20%,成人AD发病率为1%~3%[2]。AD病因复杂,发病机制至今尚未明确[3],而且缺乏有效的治疗方法[4],严重影响了患者的健康和生存质量[5-6]。为了阐明AD的病因和相关发病机制,进而提高该病防治水平,对AD进行更加深入的研究十分重要,有关AD的研究已成为当前皮肤科学及相关学科的研究热点[7-8]。建立理想的动物模型是对疾病进行科学研究的基础,小鼠基因图谱与人类相近,遗传背景明确,生长周期短,实验可操控性强,常被作为模型动物复制人类疾病[9]。Nc/Nga小鼠是较为理想的AD模型小鼠品系,但是该种小鼠较为稀有,难于获得。近交系BALB/c小鼠易于获得,喂养条件要求低,亦为免疫性疾病常用的模型动物。近年来,国外有文献[10-11]报道:以2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)作为半抗原外用致敏并激发BALB/c小鼠成功建立了AD小鼠模型。国内学者莫俊銮等[12]对DNCB诱导AD小鼠模型的建立方法进行了探讨。本研究参考相关文献,调整了DNCB激发浓度并缩短致敏和激发时间,对DNCB诱导的AD小鼠造模方法进行改良,旨在为AD小鼠模型的研究提供科学依据和新思路。
1 材料与方法
1.1 实验动物、主要试剂和仪器6~8周龄SPF级健康雌性BALB/c小鼠12只,体质量(20±2)g,购自辽宁长生生物技术股份有限公司,动物使用许可证号:SCXK(辽)2015-0001,动物合格证号:211002300028549。DNCB购自美国Sigma公司;ELISA试剂盒购自武汉华美生物工程有限公司;抗白细胞介素4(interleukin-4,IL-4)抗体(anti-IL-4)购自北京博奥森生物公司;基质溶液为丙酮和橄榄油按照4∶1的比例配制而成,用基质溶液为溶剂分别配制浓度为1.0%和0.5%DNCB溶液。全自助组织脱水机ASP6025和轮转式切片机RM2235购自德国Leica公司,低温高速离心机构自美国柯俊公司,酶标仪购自美国Thermo公司。
1.2 动物分组和给药于SPF级实验动物室分笼饲养,采用随机数字表法分为2笼(对照组和AD模型组),每笼6只。动物室内温度为(24±2)℃,湿度为(50±10)%,保持12 h光照与12 h黑暗交替,小鼠食用标准饲料,随意饮水进食。实验室常规饲养1周后,对所有小鼠背部皮肤组织进行除毛处理。于实验第1、4、7天,采用1.0%DNCB(200 μL)溶液涂抹AD模型组小鼠背部皮肤组织进行致敏,每天1次,共涂抹3次,于实验第14、17、19、22、24、27和29天分别采用0.5%DNCB(20 μL)溶液反复涂抹于小鼠左耳背部皮肤组织进行激发,每天1次,共涂抹7次。对照组小鼠于相同时间点涂抹等体积基质溶液。实验第30天,采用1.2%三溴乙醇麻醉,眼眶取血后颈椎脱臼法处死小鼠,取左侧耳部皮肤组织。
1.3 2组小鼠皮肤组织炎症评分采用盲法对2组小鼠耳部皮损处炎症严重程度进行评分。根据4种症状进行判定:干燥/脱屑,出血/红疹,溃烂/表皮脱落,水肿。每种症状按照0(无)、1(轻度)、2(中度)和3(重度)进行评分,最终评分为4个症状相加之和,皮肤组织炎症评分值为0~12分。
1.4 2组小鼠皮损处皮肤组织病理形态表现取所有小鼠的左耳皮肤组织均分为2份,加入10%中性甲醛固定,石蜡包埋(切面朝下),制作5 μm厚切片,分别进行HE染色和甲苯胺蓝染色。显微镜下观察小鼠皮损处皮肤组织病理组织结构特点并检测耳部皮肤组织上皮层厚度,每只小鼠取3张切片,放大200倍分别计数3个视野肥大细胞数,细胞数为3个视野细胞数的平均值。
1.5 免疫组织化学染色检测2组小鼠皮损处皮肤组织中IL-4表达水平石蜡切片经梯度脱蜡复水处理后,0.01 mol·L-1枸橼酸缓冲液微波抗原修复15 min,PBS冲洗3次,3%H2O2室温10 min,PBS冲洗3次, 5%BSA室温15 min封闭内源性过氧化物酶,滴加一抗,4℃过夜,PBS冲洗3次,滴加二抗,37℃、2 h,PBS冲洗3次,DAB显色,苏木素复染2 min,冲洗后树胶封片。采用Image J软件分析染色结果,以吸光度(A)值代表IL-4表达水平。
1.6 ELISA法检测2组小鼠血清IgE水平2组小鼠眼眶取血放入含EDTA的抗凝管中,1 000 g离心10 min,取血清,参照ELISA试剂盒操作步骤检测2组小鼠血清IgE水平。
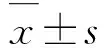
2 结 果
2.1 2组小鼠皮肤组织炎症评分AD模型组小鼠左耳部皮肤组织于第7天开始出现红肿、变硬,第14天开始伴随表皮干燥和脱屑,随着实验时间延长,激发次数增多,皮肤组织炎症症状逐渐加重;对照组小鼠未见明显皮肤组织炎症改变。实验第7、14、21和28天,与对照组比较,AD模型组小鼠左耳部皮肤组织炎症评分明显升高(P<0.01)。见图1(插页一)和表1。
表1 2组小鼠皮肤组织炎症评分
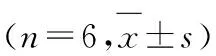

GroupInflammation score(t/d) 7142128Control 0.167±0.4080.167±0.4080.333±0.5160.333±0.516AD model 2.500±1.048*5.000±1.414*6.667±1.862*8.833±1.722*
*P<0.01vscontrol group.
2.2 2组小鼠耳部皮肤组织上皮层厚度和浸润肥大细胞数AD模型组小鼠左耳部皮损处皮肤表皮角化过度伴有角化不全,棘细胞层明显增厚,轻度海绵形成,上皮层增粗下延,真皮浅层水肿,胶原纤维增生,大量淋巴细胞和嗜酸性粒细胞浸润,血管扩张充血,毛囊增生。对照组小鼠耳部皮损处皮肤组织结构正常,层次清晰,未见血管扩张和炎细胞浸润等典型炎症反应。AD模型组小鼠耳部皮肤组织上皮层厚度[(46.67±4.46)μm]大于对照组[(10.00±2.61)μm](P<0.01),2组小鼠耳部皮肤组织病理形态表现见图2(插页一)。 AD模型组小鼠肥大细胞计数[(64.17±11.09)个/HP]明显高于对照组[(15.50±4.64)个/HP],(P<0.01),2组小鼠耳部皮肤组织肥大细胞浸润表现见图3(插页一)。
2.3 2组小鼠皮损处皮肤组织中IL-4表达水平IL-4阳性染色定位于上皮细胞的胞浆中。与对照组(0.125±0.025)比较,AD模型组小鼠皮损处皮肤组织中IL-4表达水平(0.303±0.022)明显升高(P<0.01)。见图4(插页一)。
2.4 2组小鼠血清IgE水平AD模型组小鼠血清IgE水平为(1 610.0±115.4)ng·L-1,对照组小鼠血清IgE水平为(364.2±41.7)ng·L-1,2组间比较差异有统计学意义(P<0.05)。
3 讨 论
目前,用于复制人类AD的动物模型主要包括鼠模型系统和狗模型系统[13],前者易于获得,饲养简单,操作方便,价格相对较低,因此在实验中应用较多。成模方式有转基因、变应原或化学物诱发等[14]。常用于AD模型的鼠品系主要有NC或Nga鼠、NOA鼠、BALB/c鼠和DS-Nh鼠等。国内外学者尝试了多种AD鼠模型的建立方法,研究最多的是NC或Nga鼠,该鼠对X线及卵白蛋白高度敏感,在传统饲养条件下可形成AD样皮损,在皮肤科学界被认为是研究AD的理想模型动物,但该鼠品系特殊,在国内难于获得。另有一些造模方法需要复杂的操作程序,也很难实现。因此探索通过简单有效的方法建立合理的AD模型具有重要意义。
可用于诱导AD模型的抗原物质包括大分子卵清蛋白(ovalbumin,OVA)、粉尘螨和半抗原等[15-16]。化学制剂DNCB具有半抗原属性,初次进入动物体内的DNCB可与上皮蛋白的可溶性部分共价结合,进而形成完全抗原,刺激机体淋巴细胞致敏。当致敏的淋巴细胞接触到再次进入体内的DNCB时,便会引起过敏反应,因此可用于检测细胞免疫功能。近年来,有学者采用DNCB成功制备AD小鼠模型,引起典型皮炎症状,伴随血清IgE水平升高,表皮增厚,炎症细胞浸润增多,皮损处IL-4表达增多[17]。但不同研究选用动物的品系、性别、造模方案和DNCB的浓度选择均存在差异。有研究[18-19]显示:女性人群AD总体患病率高于男性。本研究不同于莫俊銮等[12]的造模方法,选取雌性BALB/c小鼠作为模型动物,采用浓度为1.0%作为DNCB致敏浓度,0.5%作为DNCB激发浓度,缩短模型诱导时间,探讨DNCB诱导建立AD小鼠模型的改良方法。
本研究结果显示:实验第7天,AD模型组小鼠开始出现轻微皮炎症状。自第14天激发开始,AD模型组小鼠皮炎症状逐渐加重,皮损处皮肤出现明显增厚、红肿、硬结,伴随干燥和脱屑,小鼠皮炎症状随着激发次数增多而逐渐加重。病理组织学观察显示:AD模型组小鼠皮损处上皮层明显增厚,真皮层嗜酸性粒细胞、淋巴细胞和肥大细胞数增多,与对照组比较差异有统计学意义。上述结果从形态学角度证实了本研究造模方法的可行性。AD以Th2亚群功能亢进为特征,IL-4是Th2型细胞产生的关键细胞因子,在启动AD发病和病程中均有重要作用,如刺激B细胞增殖并且合成IgE,刺激肥大细胞增殖并释放组胺,促进T细胞增殖并且分化为Th2细胞等[20]。本研究结果显示:AD模型组小鼠皮损处皮肤组织中IL-4表达水平明显高于对照组。研究[21]证实:80%以上AD患者血清IgE水平高于健康人群,IgE水平升高程度与AD皮损严重程度和广度基本平行。因此,血清IgE水平常被作为AD动物模型评价的重要指标之一。本研究采用ELISA法检测了小鼠血清IgE水平结果显示:AD模型组小鼠血清IgE水平明显高于对照组。
综上所述,本研究通过多种实验方法证实了外用1.0%DNCB致敏BALB/c小鼠3次,后续外用0.5%DNCB多次激发,可成功模拟人类AD的疾病特点,建立AD小鼠模型;该模型动物品系易于获得,操作过程简单,复制性强,可作为深入研究AD病因、发病机制和防治手段的动物模型。
