右美托咪定对急性主动脉夹层患者镇痛和镇静的影响:前瞻性随机对照研究*
2020-06-12郭文静陈兴澎
郭文静 胡 杰 陈兴澎
(洛阳市中心医院心脏中心,洛阳 471000)
主动脉夹层(aortic dissection, AD)是一种极其危险的心血管疾病,如不能及时、正确诊断和治疗,36%~72%患者于发病后48 h内死亡,62%~91%患者发病后1周内死亡[1,2]。收治入院的AD患者需要快速有效地控制血压,降低心率,减少对主动脉破口的冲击;同时需要充分的镇痛、镇静,减少患者的恐惧,避免情绪波动导致夹层破裂。临床常规应用吗啡、硝普钠联合美托洛尔控制,但大多数患者肥胖,长期大量使用吗啡容易导致呼吸抑制、缺氧等。右美托咪啶(dexmedetomidine, Dex)通过激动脑干蓝斑区(负责调控睡眠和觉醒),引发和维持非动眼睡眠状态,产生剂量依赖性镇静与催眠作用,对呼吸功能几乎无抑制,镇静安全性很高[3];减少疼痛信号向大脑的传导,抑制P物质及其他伤害性肽类的释放,从而产生镇痛作用[4]。本研究旨在观察右美托咪定对急性AD患者镇痛和镇静的有效性及安全性。
1 临床资料与方法
1.1 一般资料
本研究为前瞻性随机对照研究,经我院伦理委员会批准(批文号:20181010),并征得患者及家属知情同意,签署知情同意书。急性AD诊断标准[5,6]:根据起源分型将AD分为两型,无论夹层起源于何部位,只要累及升主动脉为A型;夹层破口位于主动脉弓以远、 胸降主动脉且未累及升主动脉为B型。病例选择标准:心脏超声和主动脉CTA均诊断为急性AD(Stanford A、B型)。排除标准:入院6 h死亡或急诊手术者;有精神分裂症、重度痴呆或语言障碍等无法进行交流者;左心室射血分数<30%,合并病窦综合征、重度窦性心动过缓(<50次/min)、二度及以上房室传导阻滞、缺氧,已有血流动力学障碍、严重肝肾功能障碍等。选取2018年10月~2019年10入住我院ICU急性AD 50例,包括Stanford B型44例和误诊为急性心肌梗死给予阿司匹林、氯吡格雷双抗治疗的Stanford A型6例。年龄52~69岁,(59.9±4.7)岁。男27例,女23例。以疼痛就诊,其中胸痛28例,肩背痛17例,腹痛5例,无昏迷或缺血意识障碍者。收缩压(systolic blood pressure,SBP)(186.5±7.7) mm Hg;心率(heart rate,HR)(84.4±6.8)次/min;呼吸(18.0±0.5)次/min。超声和CTA诊断Stanford A型6例,B型44例。血D-二聚体(8.7±3.4)μg/ml(我院正常值0~0.55 μg/ml);肝肾功能无异常。按治疗先后顺序编号,采用随机数字表随机分为对照组和右美托咪定组,每组25例。2组一般资料差异无显著性(P>0.05),有可比性,见表1。
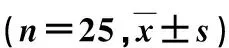
表1 2组患者一般资料比较
1.2 方法
所有患者入住ICU经心脏超声和主动脉CTA诊断为急性AD后,开放动静脉,监测SBP、HR、动脉血氧分压(arterial oxygen pressure,PaO2),进一步检查明确冠状动脉、肾脏、四肢等重要器官灌注情况,为下一步外科治疗做准备。
对照组:①血压、疼痛控制:入监护室后皮下注射吗啡(东北制药集团沈阳第一制药有限公司,批文号:国药准字H21022436)10 mg。采用视觉模拟评分(Visual Analogue Score,VAS)评估疼痛,当VAS评分>3分或躁动时追加吗啡。开放静脉通道,SBP>110 mm Hg时静脉输注硝普钠2.5~10μg·kg-1·min-1,持续输注,维持SBP 100~120 mm Hg。②心率控制:静脉注射艾司洛尔0.2~0.5 mg/kg,控制HR<80次/min后,口服美托洛尔0.3~1.0 mg/kg,每8 h一次,最大剂量400 mg/24 h。
右美托咪定组:入监护室后皮下注射吗啡10 mg,同时开放静脉通道后泵入右美托咪定(江苏恒瑞医药股份有限公司,批文号:国药准字H20090248)1.0 μg·kg-110 min后,持续静脉泵入右美托咪定0.5 μg·kg-1·h-1维持,口服美托洛尔0.3~1.0 mg/kg,每8 h一次,最大剂量400 mg/24 h。当VAS评分>3分,追加吗啡;HR>80次/min,追加艾司洛尔。
1.3 观察指标
在T0(入监护室即刻),T1(治疗30 min),T2(治疗2 h),T3(治疗6 h),T4(治疗24 h)评估患者疼痛VAS和镇静评分(Ramsay评分)[7],记录血压、HR、氧饱和度以及吗啡、艾司洛尔的用量。Ramsay评分(1分,患者烦躁、不安静;2分,患者清醒,安静合作;3分,嗜睡,但能听从指令;4分,浅睡眠,但可迅速唤醒;5分,睡眠状态,呼叫反应迟钝;6分,深睡眠状态,呼叫无反应)1分为镇静无效,2~4分为镇静效果满意,5~6分为镇静过度。VAS评分:0分,无痛;3分以下,有轻微的疼痛,能忍受;4~6分,患者疼痛并影响睡眠,尚能忍受;7~10分,患者有渐强烈的疼痛,疼痛难忍,影响食欲,影响睡眠。
1.4 统计学处理
2 结果
2.1 2组患者HR、SBP、PaO2、VAS和Ramsay评分比较
2组患者HR、SBP、PaO2和VAS评分组间、组间与时间交互、时间存在显著性差异(P<0.05);Ramsay评分组间差异无显著性(P>0.05),时间、组间与时间交互差异有显著性(P<0.05),见表2。
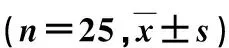
表2 2组患者HR、SBP、PaO2、VAS和Ramsay评分比较
组内不同时间比较:SBP除T3与T4比较P=1.000外,其余各时间点两两比较P均=0.000;PaO2除T2与T3比较P=0.020,其余各时间点两两比较P均>0.05;HR除T1与T2、T2与T4、T3与T4比较P>0.05外,其余各时间点两两比较P均<0.05;VAS评分各时间点两两比较P均<0.05;Ramsay评分除T3与T4比较P=1.000外,其余各时间点两两比较P均=0.000
2.2 2组患者用药量比较
右美托咪定组患者吗啡、艾司洛尔及硝普钠用量明显低于对照组(P<0.05), 见表3。2组患者均未出现心动过缓(HR≤50次/min)
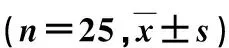
表3 2组患者用药量比较 mg
3 讨论
A型AD病程凶险,进展迅速,病死率高。术前准备中需要在保障患者脏器有效灌注的情况下,快速有效地降低患者血压和HR,减少血液对主动脉壁的冲击[8],减少主动脉壁破裂,为手术赢得时间。在临床常规治疗中,一般应用吗啡镇痛,硝普钠联合美托洛尔等控制HR和血压。间断皮下注射吗啡,血药浓度不稳定,间隔时间长,疼痛容易反复,间隔时间短,容易蓄积,造成呼吸抑制。Dex可以降低血浆儿茶酚胺浓度,减轻心脏前后负荷,降低心率和心输出量,减少心肌氧耗,对缺氧-复氧诱导的左心室功能障碍起保护作用[9,10];Dex能降低心脏手术后心肌梗死的发生率[11],具有免疫调节作用,可降低炎性反应,激活抗凋亡信号通路,产生细胞保护效应,对心、脑、肺、肾等多种器官具有保护作用[12,13]。Dex还具有缓解氧化应激反应、炎症反应的作用,是减轻围手术期脏器功能损伤的理想药物[14]。
与对照组比较,右美托咪定组HR和SBP下降快,更早到达理想指标,且维持平稳(P<0.05),同时VAS评分明显低于对照组(F=258.739,P=0.000),可能是因为对照组患者血压高,HR,撕裂的主动脉壁被血液冲击,患者胸痛剧烈,反复皮下注射吗啡可能导致蓄积,产生的强镇静作用导致在T2点Ramsay评分右美托咪定组低于对照组,其他时间点T1、T3、T4右美托咪定组高于对照组。右美托咪定组加用Dex后能够通过减少疼痛信号向大脑的传导,抑制P物质及其他伤害性肽类的释放,从而产生镇痛作用,协同吗啡产生镇痛效应,使VAS评分快速达到患者的理想状态;同时,减少儿茶酚胺释放,通过抑制交感神经,协同硝普钠等降压药物快速降压,到达理想目标值。右美托咪定组VAS评分在T1后基本维持在3~4分,处于浅睡眠状态,提示Dex可能通过激动脑干蓝斑区,引发和维持非动眼睡眠状态,产生剂量依赖性镇静与催眠作用。Ramsay评分组间差异无显著性(P>0.05),但在3~4分,利于减轻患者焦虑和恐惧心理,与我们课题组前期研究[15]及徐红党等[16]的研究基本一致。
但右美托咪定组患者PaO2无下降,T1后各时间点明显高于对照组,说明右美托咪定组虽然产生浅睡眠,但无呼吸抑制作用,可能Dex通过以抑制高迁移率族蛋白1(high-mobility group box 1,HMGB1)从核内向胞浆的转运及细胞外的分泌,剂量依赖性抑制炎性蛋白的核转位,降低白介素及HMGB1水平,抑制肺部炎症信号通路的激活,从而减轻肺部炎性反应,提高血氧含量[17,18]。右美托咪定组吗啡、艾司洛尔、硝普钠用量明显低于对照组(P均=0.000),说明Dex有协同镇痛镇静作用后,极大减轻患者焦虑和恐惧心理,虽然Dex有低血压和心动过缓的副作用,但右美托咪定组未出现HR低于50 次/min的恶性心动过缓,反而能够快速降低患者HR,减少艾司洛尔用量,从而减少对心脏的抑制作用。
综上所述,Dex能够在AD患者治疗中,产生协同镇痛镇静作用,减少吗啡用量,并能快速降低患者血压和HR,减少硝普钠和艾司洛尔用量,无呼吸抑制作用,对患者安全有效。由于本研究样本量较小,同时患者术前无缺氧等状态,今后的研究不仅需要扩大样本量,还需要增加术前缺氧组研究来完善临床数据,为后继研究提供支持。
