年龄与三阴性乳腺癌患者预后的关系
2020-06-12曹希徐雅莉孙强
曹希,徐雅莉,孙强
(中国医学科学院北京协和医院 乳腺外科,北京 100730)
乳腺癌是世界范围内最常见的恶性肿瘤之一,也是导致妇女死亡的主要原因。流行病学显示,2018年全球新诊断乳腺癌约209万例,死亡约626 679例[1]。我国正处于癌症谱由发展中国家向发达国家转变的转型期,乳腺癌的发病率和病死率均呈上升趋势[2],西化的生活方式和生育模式的改变可能是导致我国乳腺癌发病率逐年增加的原因[3-4],而缺乏早期诊断则可能是导致较高病死率的原因。尽管不同分子分型的乳腺癌具有共同的组织起源,但是它们在临床表现、预后等方面显示出相当的异质性。
三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌的一个特殊亚型,表现为乳腺癌肿瘤细胞免疫组化染色雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)均<1%且缺乏人表皮生长因子受体2(HER-2)的过度表达和/或基因扩增。它们约占所有乳腺癌的12%~17%[5]。TNBC本身具有复杂基因组、高度遗传不稳定以及高度瘤间、瘤内异质性。TNBC在临床上被视为一种侵袭性较强的乳腺癌亚型,相较于非TNBC,具有发病年龄小、有乳腺癌家族史、易较早发生局部复发和远处转移等特点[6],多需要辅助治疗以提高生存率。在辅助治疗方面,TNBC的全身治疗手段主要是细胞毒性的化疗,且尚缺乏有效的靶向治疗体系,即使是发生了远处转移,仍以化疗解救治疗为主。尽管近年来,新兴的PD-1抗体、抗PD-L1抗体等相关药物的临床试验证实其对TNBC有效,但其疗效是极为有限的,且主要应用于复发转移患者的解救治疗。
流行病学显示,约有6.5%的女性诊断乳腺癌时≤40岁,被定义为年轻乳腺癌患者。相较于年长乳腺癌患者,年轻患者往往是以乳房无痛性肿块就诊,携带乳腺癌易感基因的比例更高,患者可能更易经历诊断延误和面临更晚的肿瘤分期,其肿瘤可能组织学分化差且更具生物学侵袭性[7-10]。因此,适用于各年龄层面的诊疗指南可能并不适用于这一特殊群体。进一步探索这一群体的临床病理特征,或可帮助指导特殊群体的精准治疗。基于TNBC和年轻乳腺癌这一双重特性,本研究旨在比较不同年龄(≤40岁和>40岁)TNBC患者的临床病理学特征以及其预后的差异,以探讨年龄是否为TNBC的独立危险预后因素。
1 资料与方法
1.1 一般资料
回顾性分析北京协和医院乳腺外科2011年1月—2014年12月手术且经病理学证实为I~III期的原发TNBC患者的临床资料。入组标准:⑴ 18~ 80岁的女性;⑵ 均经病理证实为I~III期原发TNBC;⑶ 接受根治性手术,且在术后依据当时的NCCN乳腺癌相关指南完成标准辅助治疗,包括化疗、放疗等。排除标准:⑴ 首诊IV期;⑵ 术前接受化疗、放疗等新辅助治疗者;⑶ 病理资料、临床资料、随访情况不完整者;⑷ 有严重心、肺、肝、肾等重要脏器原发病者。本研究为回顾性研究,经北京协和医院医学伦理委员会批准。
1.2 临床病理学参数
所有患者诊断乳腺癌年龄即视为入组年龄。术后病理分期依据第7版《AJCC肿瘤分期手册》[11]进行确定。激素受体阴性定义为ER和PR均阴性,HER-2免疫组化结果为阴性或(+)时视为HER-2阴性,当结果为(+++)时视为HER-2阳性,当结果为(++)时需要进一步行荧光原位杂交以明确HER-2是否扩增。TNBC需同时满足激素受体阴性且HER-2阴性。
1.3 观察终点定义
局部-区域性复发(local-regional recurrence,LRR)定义为(局部)同侧乳腺或胸壁复发,(区域)同侧腋窝、内乳腺或锁骨上淋巴结复发。远处转移(distance metastasis,DM)被记录为单个远处转移(内脏、淋巴结、大脑和骨骼)或多个部位远处转移。在最后1次随访时记录患者的相应状态,包括无疾病状态、带病生存状态、死于乳腺癌、死于其他原因等。当同一天发生了两种及以上复发的情况,按最严重的进行记录。本研究的观察终点包括无局部-区域性复发生存(local-regional recurrence-free survival,LRRFS)、无远处转移生存(distance metastasisfree survival,DMFS)、无疾病生存(disease-free survival,DFS)和总生存(overall survival,OS)。
1.4 随访
随访时间从手术结束至2019年3月或患者死亡。术后2年内每6个月复查1次,术后3年及以上每12个月复查1次。复查内容包括肿瘤指标、乳腺及腋窝淋巴结超声、颈部及锁骨上窝淋巴结超声、肝胆胰脾超声、妇科超声、胸部X线或胸部CT、骨扫描等,其中骨扫描为每12个月1次。LRR主要根据病灶切除或穿刺病理检查证实,DM主要依据影像学检查如B超、CT、MRI、骨扫描或PET-CT结果等进行判断。
1.5 统计学处理
采用SPSS 19.0对数据进行统计分析。计量资料采用均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料采用率(%)表示,组间比较采用χ2检验或Fisher精确检验。采用Kaplan-Meier法绘制患者的LRRFS、DMFS、DFS和OS曲线,采用Log-rank检验进行比较。采用Cox回归模型进行影响乳腺癌DFS和OS的单因素及多因素分析,所有统计均采用双边概率检验,P<0.05为差异有统计学意义。
2 结 果
2.1 基线特征
入组患者均为首诊非IV期、未接受新辅助治疗、病理诊断为TNBC的女性,年龄25~79岁,平均(48.8±11.5)岁,随访时间10~97个月,平均(62.2±20.7)个月,在此期间累积LRR 21例(21/317,6.62%),累积DM 70例(79/317,22.08%),累积复发转移88例(88/317,27.76%),累积死亡58例(58/317,18.30%)。其中有乳腺癌家族史16例(16/317,5.05%),乳房手术处理为保乳者42例(42/317,13.25%)、全切者275例(275/317,86.75%),腋窝处理为前哨淋巴结活检者17例(17/317,5.36%)、腋窝淋巴结清扫者300例(300/317,94.64%)。术后病理方面,浸润性导管癌 310例(310/317,97.80%)、浸润性小叶癌 3例(3/317,0.95%),有脉管癌栓28例(28/317,8.83%),有淋巴结转移128例(128/317,40.38%),其中淋巴结转移≥4枚者63例,病理分期I期112例(35.33%),II期141例(44.48%),III期64例(20.19%)。术后辅助治疗严格按照诊断时的NCCN指南规范化进行,化疗方案主要以蒽环和/或紫杉为基础,其中接受化疗者285例(285/317,89.90%),接受放疗94例(94/317,29.65%)。
317例患者中,≤40岁组有89例(89/317,28.08%),平均年龄(35.1±4.0)岁;>40岁组 有228例(228/317,71.92%),平均年龄(54.1±8.7)岁。两组的平均随访时间(P=0.009)、组织学分级(P=0.049)、脉管癌栓(P=0.024)、T分期(P=0.004)、N分期(P=0.019)、病理分期(P=0.019)、乳房手术方式(P<0.001)、是否化疗(P=0.013)和是否放疗(P<0.001)均有明显差异,但乳腺癌家族史(P=0.252)、Ki-67指数(P=0.544)、病理类型(P=0.544)、腋窝手术方式(P=0.880)均无明显差异(表1)。
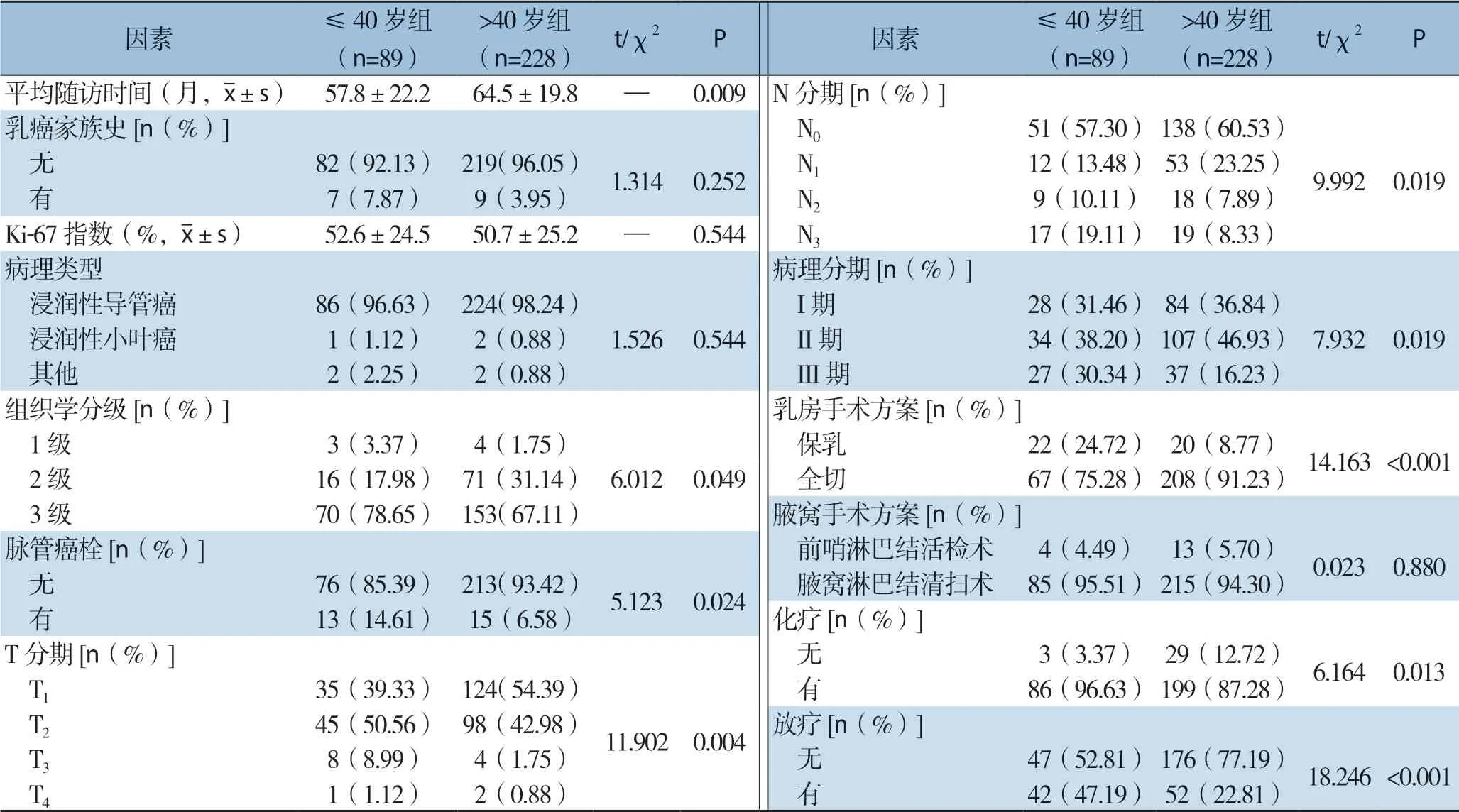
表1 两组临床病理特征比较Table1 Comparison of the clinicopathologic features between the two groups
2.2 生存分析
将入组的317例患者根据年龄分为≤40岁组和>40岁组,进行Kaplan-Meier生存分析。平均随访时间为(62.2±20.7)个月,中位随访时间为65(10~97)个月。≤40岁组和>40岁组的5年LRRFS分别为87.5%和94.9%,Log-rank检验显示两组之间无明显差异(χ2=3.044,P=0.081);但是≤40岁组的5年DMFS、DFS和OS均明显低于>40岁组,分别是64.3%和83.2%、55.7%和79.2%、71.8%和86.2%,两组间均有统计学意义(χ2=12.387,P<0.001;χ2=16.581,P<0.001;χ2=6.741,P=0.009)(表2)(图1)。
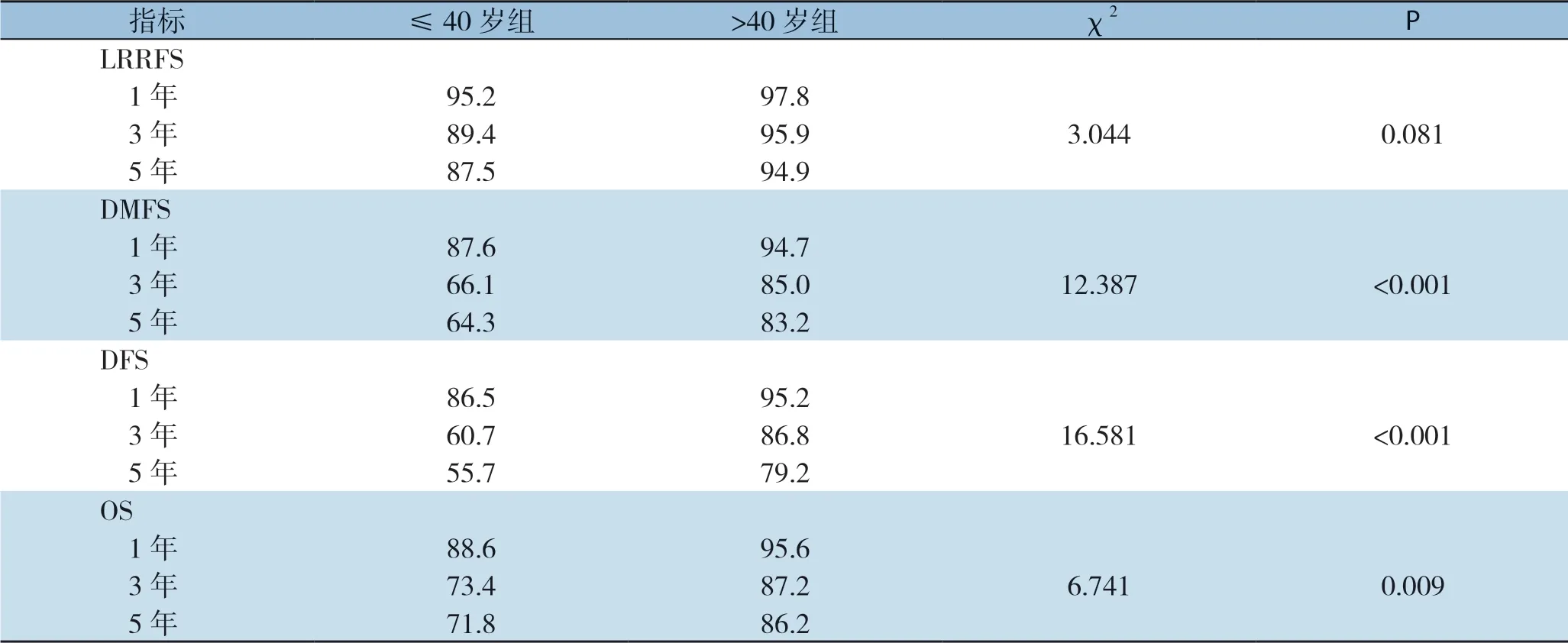
表2 两组的LRRFS、DMFS、DFS和OS比较(%)Table2 Comparison of LRRFS,DMFS,DFS) and OS between the two groups of patients (%)
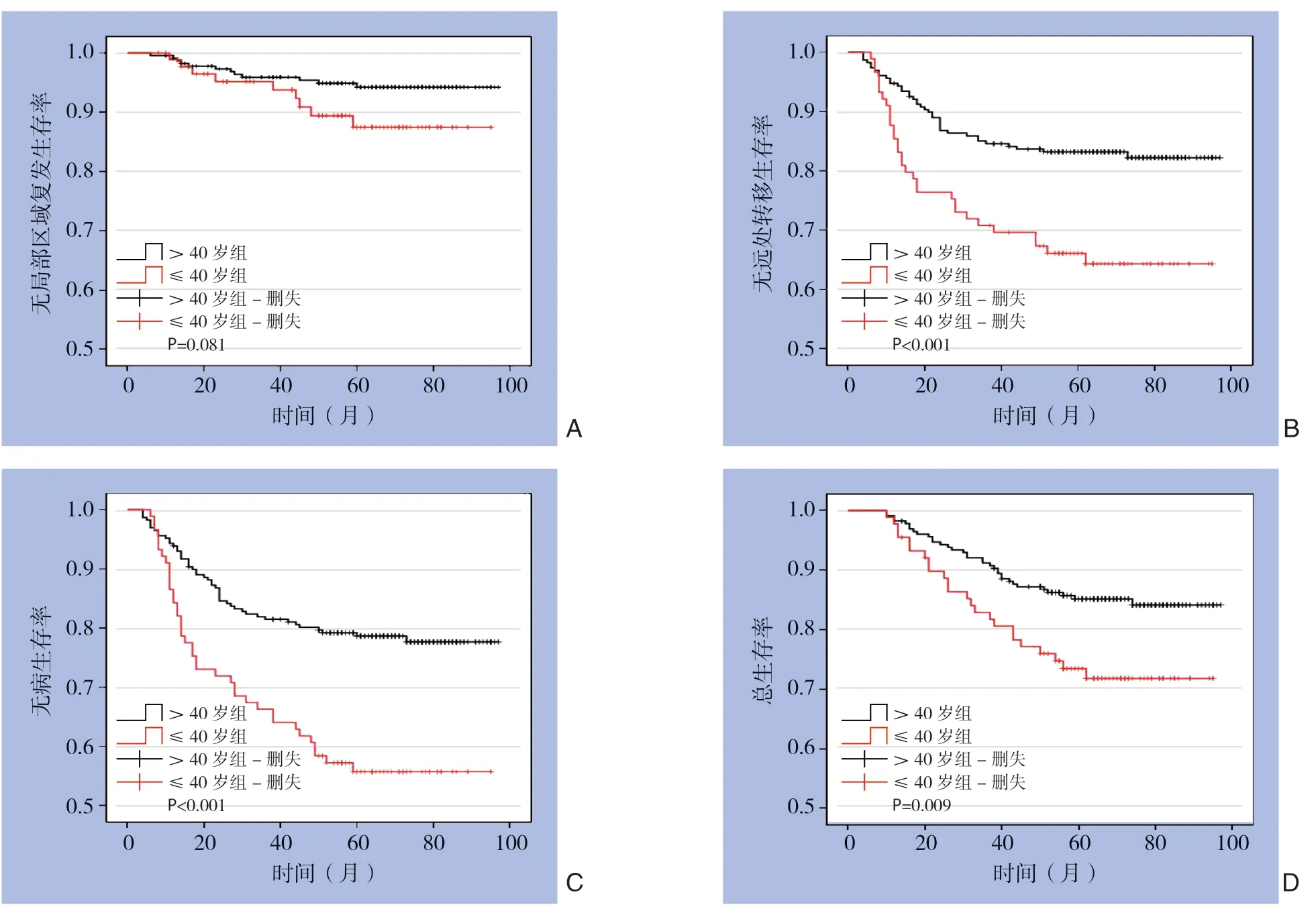
图1 两组患者Kaplan-Meier生存曲线 Figure1 Kaplan-Meier survival curves of the two groups of patients
2.3 预后因素分析
对于DFS,单因素Cox回归分析显示,≤40岁(HR=2.331,95% CI=1.530~3.552,P<0.001)、有脉管癌栓(HR=2.874,95% CI=1.647~5.017,P<0.001)、肿瘤直径>2 cm(HR=1.704,95% CI=1.112~2.612,P=0.014)、淋巴结转移 ≥4枚(HR=3.436,95% CI=2.233~5.288,P<0.001)、接受化疗(HR=3.635,95% CI=1.149~11.498,P=0.028)和接受放疗(HR=2.825,95% CI=1.858~ 4.296,P<0.001)均与更差的DFS有关。进一步行多因素Cox回归分析显示,≤40岁(HR=1.983,95% CI=1.280~3.071,P=0.002)和淋巴结转移≥4枚(HR=2.064,95% CI=1.091~3.904,P=0.026)是DFS的独立危险因素(表3)。
对于OS,单因素Cox回归分析显示,≤40岁(HR=1.970,95% CI=1.168~3.323,P=0.011)、有脉管癌栓(HR=3.235,95% CI= 1.674~6.250,P<0.001)、淋巴结转移≥4枚(HR=4.514,95% CI=2.690~7.575,P<0.001)和接受放疗(HR=2.800,95% CI=1.672~4.688,P<0.001)均与更差的OS有关。进一步行多因素Cox回归分析显示,≤40岁(HR=1.799,95% CI= 1.052~3.076,P=0.032)和淋巴结转移≥4枚(HR=4.062,95% CI=1.841~8.963,P=0.001)是OS的独立危险因素(表4)。
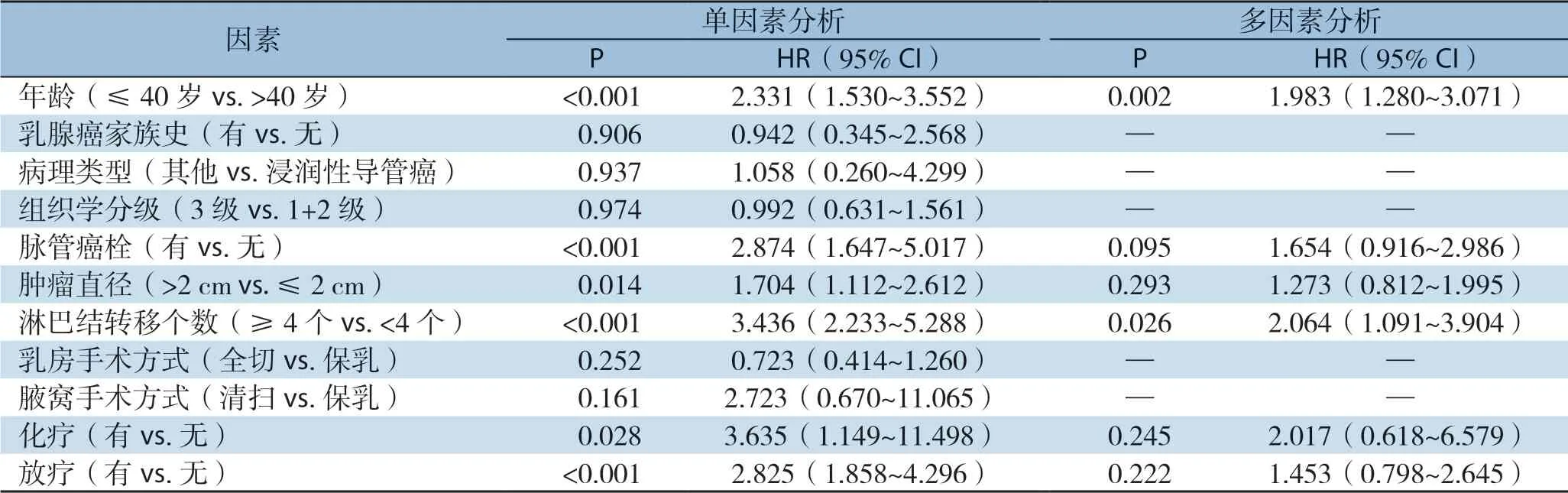
表3 影响TNBC患者DFS的单因素及多因素分析Table3 Univariate and multivariate analysis of factors for DFS in TNBC patients
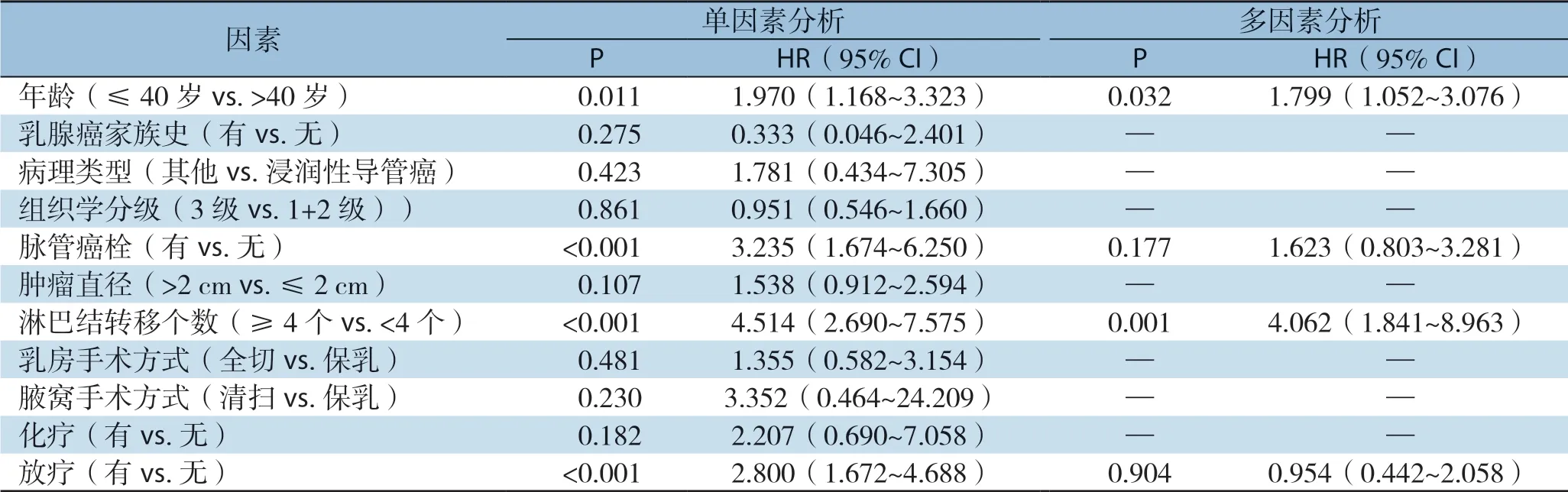
表4 影响TNBC患者OS的单因素及多因素分析Table4 Univariate and multivariate analysis of factors for OS in TNBC patients
2.4 年龄与其他因素对DM发生时间的影响
70例患者(22.08%)出现DM,其中51例患者死亡(72.86%)。依据自诊断原发性TNBC至发生远处转移的时间,分为早期DM组(≤2年,51例)和晚期DM组(>2年,19例)。自诊断DM至死亡时间,早期DM组和晚期DM组之间明显差异(13.2个月vs.12.5月,P=0.141)。早期DM组和晚期DM组在大部分临床病理特征方面无明显差异,如有无乳腺癌家族史、Ki-67水平、病理类型、有无脉管癌栓、T分期、N分期、病理分期、手术方式、是否接受化疗及放疗等。不同年龄分组的早期和晚期远处转移亦没有统计学差异(均P>0.05)。组织学分级3级的患者发生早期远处转移者明显多于晚期远处转移者(74.51% vs.42.11%,P=0.013)。在进一步针对转移位置的分析中发现,早期远处转移患者中,肺是最常见的转移部位(31.37%),而在晚期远处转移患者中,肺(21.05%)和骨(21.05%)均为最常见转移部位(表5)。
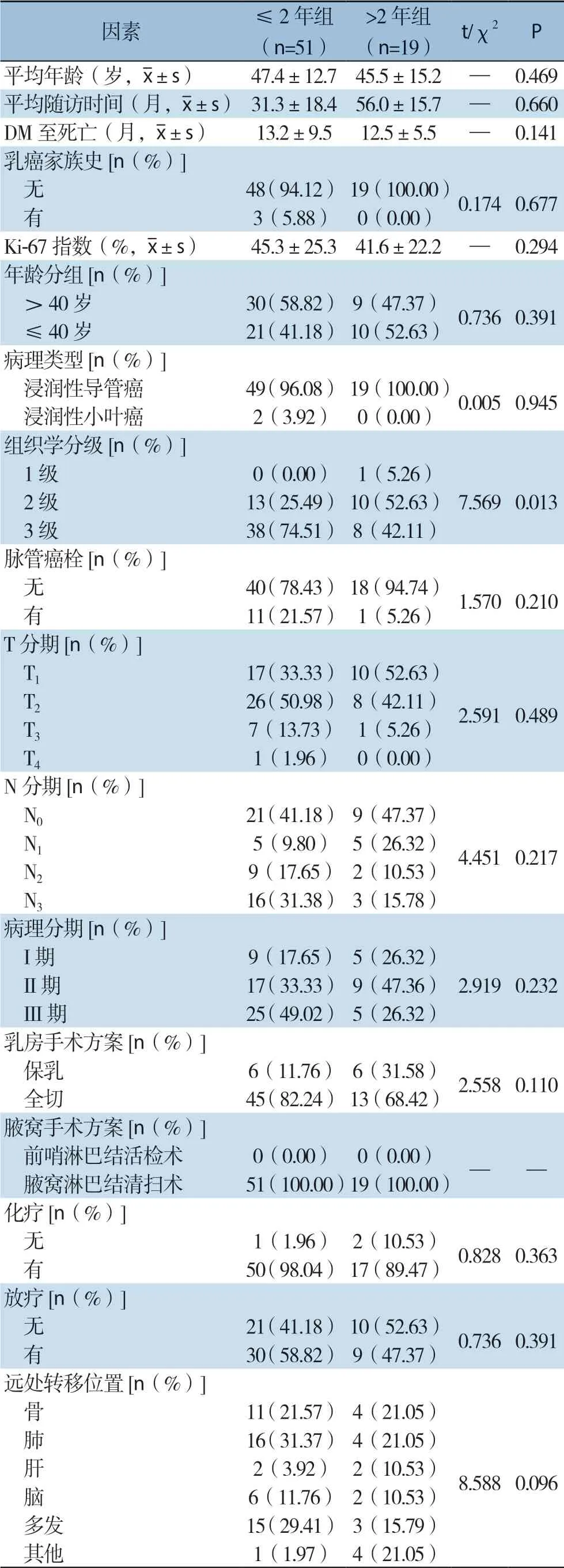
表5 早期与晚期发生DM患者的临床病理特征比较Table5 Comparison of the clinicopathologic features between patients with early and late DM
3 讨 论
TNBC是最具侵袭性的乳腺癌亚型之一,表现为激素受体阴性且缺乏HER-2的过度表达和(或)基因扩增,常伴有更大的肿瘤体积、更差的组织学分级、更多的淋巴结受累,更易发生远处转移,且缺乏FDA批准的靶向药物[12]。既往研究显示,多达50%的早期TNBC患者出现疾病复发,37%的患者在术后5年内死亡,其乳腺癌相关病死率较激素受体阳性或HER2阳性乳腺癌明显增高[13-15]。而诊断乳腺癌时仍年轻同样被认为是一个不良预后因素[16]。在亚洲,首诊乳腺癌的年龄往往较为年轻[17-19]。基于TNBC和年龄双重影响因素,本研究回顾性分析了317例首诊非IV期、未接受过新辅助治疗、病理确诊为TNBC、且术后经过规范化辅助治疗并定期随诊的病例信息,并以40岁为界将入组人群分为≤40岁和>40岁两组,着重分析两组间的临床病理学特征及预后的差异,探索年龄对TNBC的预后影响。
在本研究中,不同年龄分组的TNBC在临床病理学方面具有较大差异。≤40岁组相较>40岁组具有更高的组织学分级(P=0.049)、更多的脉管癌栓(P=0.024)、更晚的T分期(P=0.004)、N分期(P=0.019)及病理分期(P=0.019)。Liedtke等[20]回顾性分析了1 732例原发性TNBC,结果显示,年轻乳腺癌患者(31~40岁)相较于老年乳腺癌患者(>60岁),肿瘤组织学 3级比例更高(P<0.0001)。Kim等[21]回顾性分析了6 405例I~III期乳腺癌患者,其中TNBC为 1 039例(16.2%),可见相较于≥40岁各组,<40岁组的II、III期患者更多(P=0.006)且TNBC亚型更多(P<0.001)。Martinez等[22]回顾性分析了258例极年轻乳腺癌(≤35岁)及与配对的 101例年长乳腺癌(45~95岁),可见极为年轻组具有更多的大肿瘤(P=0.003)、更多的淋巴结转移(P=0.099)。因此,年轻乳腺癌相较于年长乳腺癌往往更具侵袭性,且在TNBC中这一差异同样存在。
在本研究中,不同年龄分组TNBC的治疗方案存在差异,在乳房手术方面,尽管前文已提及本研究中≤40岁组的大肿瘤更多,但仍可见其相较于>40岁组保乳率更高(P<0.001),这或与年轻女性更在意乳房外形等社会心理学因素有关,腋窝手术方式则无显著性差异;≤40岁组相较于>40岁组接受化疗(P=0.013)及接受放疗(P<0.001)比例更高;由于本研究纳入的均为接受规范化治疗者,因此治疗方案方面的差异多非个体选择所致,更多仍与前文所述年轻组肿瘤分期晚者多、N分期晚者多、保乳率高等因素有关。Liedtke等[20]研究同样显示年轻乳腺癌患者 (<40岁)相较于老年乳腺癌患者(>60岁),接受新辅助化疗(P=0.0012)和辅助化疗(P<0.0001)的比例更高。张毅等[23]回顾性分析了218例TNBC女性,并根据年龄分为青年组 (≤35岁)、中年组(36~60岁)和老年组(>60岁),辅助化疗(P=0.038)、放疗(P=0.039)比例方面青、中年组均明显高于老年组。因此,基于年轻TNBC具有更多的淋巴结转移、更晚的肿瘤分期等特征,在接受规范化治疗基础上,其相较于年长TNBC的化疗率、放疗率可能更高,但在乳房及腋窝手术方式方面两组之间的差异并无明确趋势。
本研究生存分析显示,≤40岁组相较于 >40岁组,具有更低的5年DMFS(P<0.001)、5年DFS(P<0.001)和5年OS(P=0.009),但5年LRRFS(P=0.081)无显著性差异。Kwon等[24]回顾性分析了233例I~III期TNBC,根据年龄分为≤35岁组和>35岁组,年轻组的5年DFS、5年LRRFS、5年DMFS均显著差于年长组(P=0.002、P=0006、P=0.003),但5年OS无显著性差异(P=0.253)。张毅等[23]研究则显示青中年两组相较于老年组,具有更差的DFS(P=0.048)。Radosa等[25]回顾性分析了1 930例TNBC患者,其中289例<40岁,1 641例≥40岁,在74个月的中位随访中,年轻组的远处转移率显著高于年长组(P<0.01)。结合本研究和既往研究可以看出,年轻TNBC相较于年长TNBC,往往更易发生远处转移,因而具有更差的生存状况。这意味着,当年轻遇见TNBC,往往加剧了肿瘤侵袭性、肿瘤异质性、治疗反应不佳、治疗手段有限等特质,表现为更差的远期预后。
本研究单、多因素分析显示,≤40岁和淋巴结转移≥4枚是影响DFS和OS的独立危险因素。虽然在单因素分析中,脉管癌栓、放疗等对DFS和OS的影响均出现统计学意义,但在随后的多因素分析中,两者均失去统计学差异,原因可能如下:年轻和局部晚期(淋巴结转移≥4枚)往往具有更强的肿瘤侵袭性,因此或多与脉管癌栓同时出现,当单因素分析时,此3个因素均出现统计学差异,而在多因素分析中,脉管癌栓的影响作用可能被更独立、更强的影响因素如年龄等平衡而表现为统计学差异消失。因此,借助多因素分析筛选出了对预后有独立强影响的相关因素——年龄。在既往的研究中,Dai等[26]通过对SEER数据库的检索统计发现,对于TNBC,年轻是OS的独立危险因素(≥40岁vs.<40岁,P<0.05)。沈松杰等[27]回顾性分析305例TNBC女性,Cox比例风险模型显示,>50岁组和36~50岁相较于≤35岁OS的风险比分别为0.267和0.259,有统计学差异(P=0.003),即年轻是OS的危险预后因素。
在本研究中,早期和晚期DM的临床病理特征无明显差异,在早转移组中肺是最常见的转移部位(31.37%),晚转移组中肺和骨均为最常见转移部位(21.05%,21.05%)。Kelsey等[28]回顾分析322例诊断时年龄≤40岁乳腺癌患者,其中早转移组脑转移(33%)最多见,晚转移组中骨转移(37%)最多见。Tjokrowidjaja等[29]在回顾性分析中纳入395例首诊年龄<40岁乳腺癌患者,研究显示<40岁的内脏转移率远高于≥40岁组(54% vs.43%,P=0.03)。目前为止,针对TNBC的早期或晚期转移的相关研究非常有限,因此尚无法得到早、晚期DM的明显差异所在。
目前为止,年龄与TNBC预后的关系仍存争议。本研究认为,首诊年龄≤40岁相较于>40岁,或为TNBC的独立危险预后因素。
本研究仍存相当局限性。首先,此为单一医疗中心的回顾性研究,入组量较小且随访时间不足够长,具有统计学意义的局限性;其次,本研究未纳入接受新辅助治疗的TNBC人群,仅分析了首诊I~III期且未接受新辅助治疗的TNBC患者,具有治疗方法的局限性。因此,期待随后可以开展大范围、多中心、覆盖多种治疗方案的回顾性或前瞻性的相关研究。
