不同细菌注浆方法对MICP一相注工艺的影响
2020-06-12张继生管大为周应征郑金海
张继生,刘 伟,管大为,周应征,成 亮,郑金海
(1.河海大学海岸灾害及防护教育部重点实验室,江苏 南京 210098;2.河海大学港口海岸与近海工程学院,江苏 南京 210098; 3. 江苏大学环境与安全工程学院,江苏 镇江 212013)
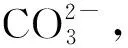
如何保证固化土体强度的均匀性是MICP技术目前所面临的一大难题。在早期,Stocks-Fischer等[11]采用一相注方法,直接向土体内注入细菌和胶结液的混合液,但由于细菌絮凝以及CaCO3迅速沉积的原因,注浆口极易堵塞,最终导致注浆失败。随后,Whiffin等[10]提出一种两相注的方法,即先注入细菌,静置一段时间后再注入胶结液,该方法能够一定程度上避免注浆口堵塞的问题,获得较为完好的固化砂体。在此基础上,Harkes等[12]提出一种改进的两相注浆方法,该方法先向土体中注入细菌,随后注入低浓度的Ca2+作为固定液,最后再注入胶结液。此方法通过Ca2+的絮凝作用,较大程度上将细菌固定在砂颗粒孔隙中,以减少细菌被胶结液的冲出量,最终得到的试样CaCO3分布更加均匀。但是,在两相注工艺中,由于胶结液在细菌注射后注入,细菌会不可避免地被胶结液带出,导致无法准确控制固化区域内的细菌量。此外,胶结液对注入细菌的冲挤作用易使细菌在土体内部分布不均,从而影响CaCO3的均匀沉积。针对以上问题,Cheng等[13]提出了一种低pH一相注方法。在注浆之前,通过降低一相浆液(细菌、胶结液的混合液)的pH,抑制前期细菌的絮凝以及CaCO3的生成,进而将一相浆液顺利注入土体内。此方法不但能够避免注浆口堵塞,还能使注浆液在土颗粒孔隙间均匀扩散,形成强度均匀的固化土体。
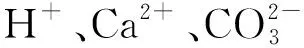
以上研究表明:增大细菌浓度一定程度上能够诱导生成更多的CaCO3,进而提高土体的力学性能。但上述试验中,细菌浓度增大本质上增加了细菌总量。在以往的文献中,细菌总量一定时,低浓度细菌和高浓度细菌对MICP诱导CaCO3沉积的效率以及对固化土体力学特性的影响还未见报道。
针对以上问题,本文研究了细菌总量一定的情况下,分次注入低浓度细菌和一次性注入高浓度细菌这2种注浆方法对一相注工艺的影响。主要开展了水溶液试验及砂柱固化试验,对比并分析了一相注工艺中不同细菌注浆方法生成的CaCO3总量、细菌脲酶活性变化及砂柱最终的固化效果。为精确控制注浆过程中细菌的用量,笔者采用Cheng等[13]的低pH一相注工艺,并在注浆之前进行砂层过滤试验,确定注浆窗口期,以保证注浆试验的顺利进行。
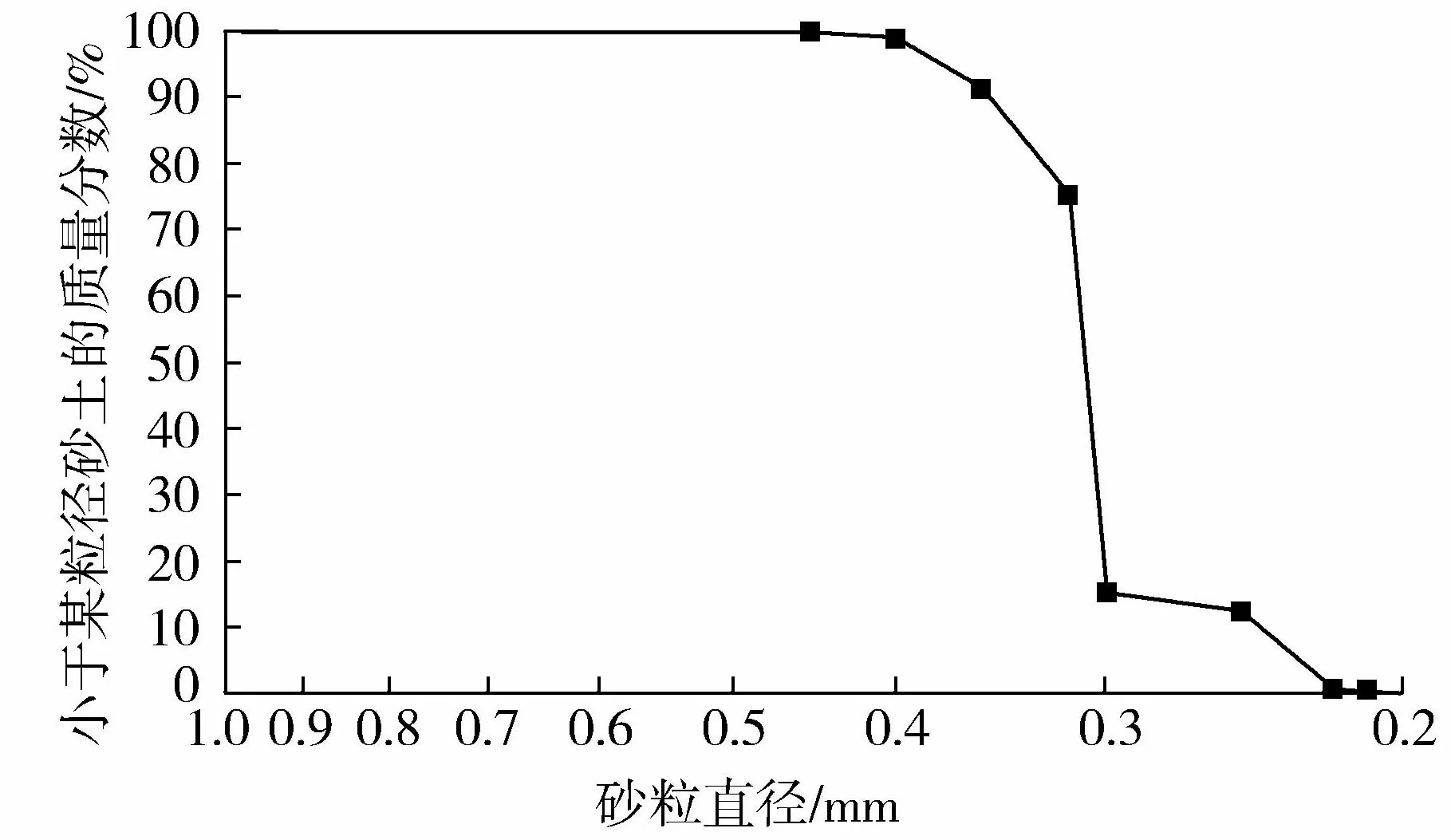
图1 颗粒级配曲线Fig.1 Distribution curve of sand particle size
1 试 验 材 料
1.1 砂
试验采用普通石英砂(SiO2质量分数为99.7%),其土粒相对密度Gs=2.65。利用去离子水将其洗净,并在80 ℃的恒温鼓风箱中完全烘干,之后进行颗粒筛分试验,得到如图1所示的颗粒级配曲线。该砂中值粒径D50=0.31 mm,D90=0.35 mm,不均匀系数Cu=1.35,属于级配不良的均匀砂。
1.2 菌液及胶结液
本试验采用的细菌为巴氏芽孢杆菌(SporsacinapasteuriiDSM 33),微生物培养在无菌好氧性培养基中(将200 mL培养基置于1 L烧瓶中,以170 r/min的速度在28 ℃的条件下进行恒温振荡),其中包括20 g/L的酵母粉、15 g/L的NH4Cl以及0.1 mol/mL NiCl2,并采用10 mol/L的NaOH调节pH为9.25。

本研究中,培养好的细菌浓度OD为3.6±0.2,活性为(24±2)U/mL(1 U/mL指的是每毫升细菌中所含的脲酶每分钟能水解1 μmol的尿素)。将细菌采用去离子水稀释,得到4组不同浓度的菌液,浓度OD由高到低分别为3.6、1.8、0.9、0.45,对应的细菌活性分别为24 U/mL、12 U/mL、6 U/mL、3 U/mL。为方便对比分析,本文中浓度OD为3.6的细菌定义为高浓度细菌,而浓度OD为0.45的细菌定义为低浓度细菌。
采用的胶结液(cementation solution, CS)为等浓度的氯化钙(CaCl2)/尿素(urea)混合液。试验过程中控制注浆液中胶结液的浓度为1 mol/L。
1.3 低pH一相浆液
低pH一相浆液(以下简称一相浆液)的配制方法与Cheng等[13]的方法相同,具体配制过程如下:(a)用2 mol/L的盐酸将菌液pH调至5.0左右;(b)向该pH为5.0的菌液中加入等体积的CS(2 mol/L);(c)用2 mol/L的盐酸将混合液的pH进一步降低至4.0左右。配制4种不同细菌浓度的一系列一相浆液,最终的pH约为4,CS浓度为1 mol/L,细菌浓度OD分别为0.225、0.45、0.9、1.8,相应的活性分别为 1.5 U/mL、3 U/mL、 6 U/mL、12 U/mL。值得注意的是,此处的细菌浓度(活性)特指细菌和CS混合后一相浆液中的细菌浓度(活性),由于细菌和CS等体积混合,故一相浆液中细菌浓度(活性)为混合前细菌本身浓度(活性)的一半。除非特殊指出,本文中所提及的细菌浓度(活性)均指的是未和CS混合前细菌本身的浓度(活性)。
1.4 砂柱试样制备
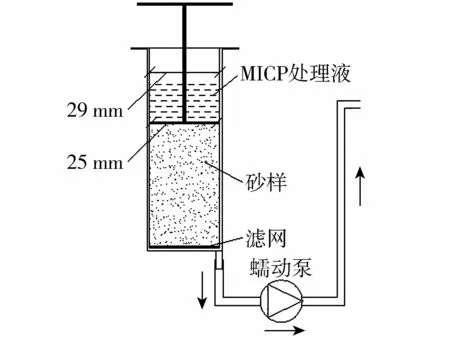
图2 注浆装置示意图Fig.2 Grouting device in experiment
制备2种砂样,分别用于微生物过滤试验和砂柱固化试验,模具采用内径为29 mm的50 mL聚丙烯针管,并采用饱和夯砂法[23]将砂进行分层夯实,控制干密度为1.60 g/cm3。在针管底部放置一层滤网,垫一层厚度为5 mm的粗砂(D50=0.8 mm)作为反滤层。对于每一层待夯砂样,先加入1.1倍孔隙体积的去离子水,再加入相应质量的细砂(通过干密度1.60 g/cm3计算),轻轻振荡夯实,直到夯实到计算高度,此时水面高度略高于砂面高度,说明砂样内部孔隙趋于完全饱和。
用于微生物过滤试验的砂样分2层夯实,总高度为30 mm;固化试验的砂样分5层夯实,总高度为80 mm(包含底层5 mm的粗砂)。砂样顶部采用针管推压器压实并固定,针管的底部注射口通过橡胶管与蠕动泵相连。注浆装置见图2。
2 试 验 方 法
2.1 水溶液试验

2.2 一相浆液微生物过滤试验
采用一相注方法进行MICP处理时,细菌能否顺利通过砂体内部的孔隙通道,很大程度上决定着固化土体强度的均匀性。因此,在注浆之前对含有不同浓度细菌的一相浆液进行了微生物过滤试验,以确定注浆窗口期。将已配制好的4组不同细菌浓度(特指一相浆液中的细菌浓度,其OD在0.225~1.8之间,定义为M1~M4组)的一相浆液(1.5倍砂层孔隙体积)分别静置0 min、2 min、4 min、6 min、8 min后,采用蠕动泵以20 mL/min的速率将其从上往下注入30 mm厚的砂层中。收集流出液,立即测量其OD值,以此表征含有不同细菌浓度的一相浆液静置不同时间后微生物通过砂层的能力。
2.3 低pH一相注固化砂柱试验
为研究细菌注浆方法在一相注工艺中对微生物加固砂柱效果的影响,试验基于低pH一相注工艺,在细菌总量一定的情况下,采用2种不同的细菌注入方式对砂样进行了MICP加固处理。如表1所示(砂柱孔隙体积为22 mL),2种不同注菌方式分别指分批次注入低浓度细菌和CS(A组)和首次注入高浓度细菌和CS,随后只注入CS(B~D组)。本试验设置一组平行样以减少偶然误差,砂样处理次数最高为8次,8次处理后,消耗的细菌和CS量保持一致。
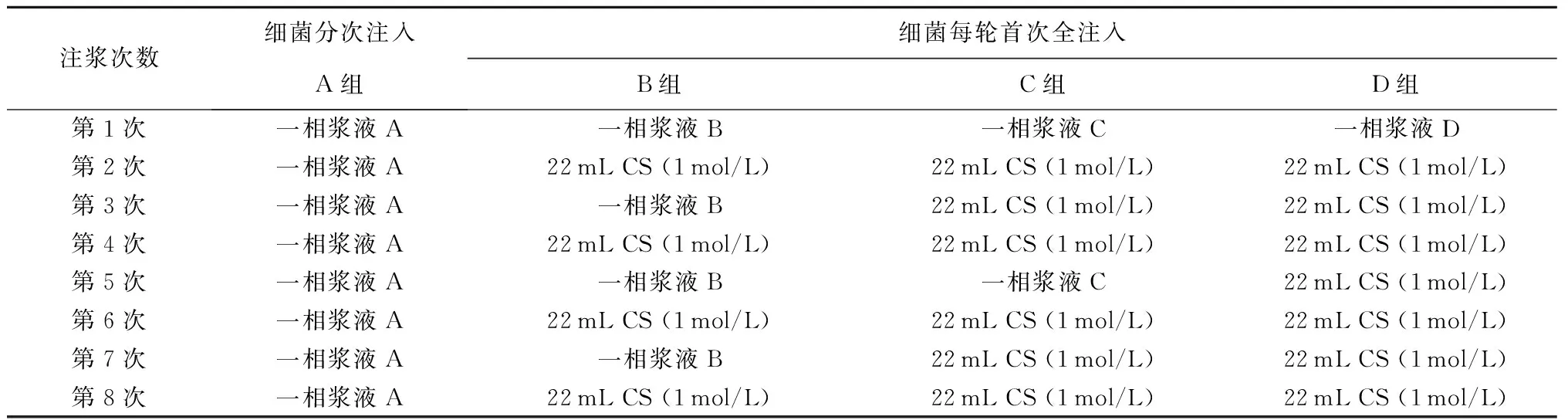
表1 注浆方案Table 1 Grouting methods
注: 一相浆液A:22 mL细菌和CS混合液,其中细菌浓度OD为0.225, CS浓度为1 mol/L;一相浆液B:22 mL细菌和CS混合液,其中细菌浓度OD为0.45, CS浓度为1 mol/L;一相浆液C:22 mL细菌和CS混合液,其中细菌浓度OD为0.9, CS浓度为1 mol/L;一相浆液D:22 mL细菌和CS混合液,其中细菌浓度OD为1.8, CS浓度为1 mol/L。以上细菌浓度特指一相浆液中的细菌浓度。
试验过程中,采用蠕动泵将MICP处理液(一相浆液或1 mol/L的CS)从上而下注入砂样中,并控制注浆速率为20 mL/min。注浆完成24 h后开始下一轮的注浆,待到最后一次注浆结束,等待24 h并拆模。以上整个过程控制室温为(25±1)℃。
3 试 验 测 试
3.1 无侧限抗压强度
将拆模得到的固化砂柱采用去离子水冲洗10 min,并静置20 min,随后放入60 ℃的恒温鼓风烘箱内烘干至质量不变为止。对砂柱上下两端进行磨平,制成长径比为2∶1的样品。依据GB/T 50123—1999《土工试验方法标准》对砂样进行无侧限抗压强度(unconfined compression strength, UCS)测试,控制加载速率为1 mm/min,并取峰值应力为该试样的无侧限抗压强度值。
3.2 CaCO3含量
CaCO3含量的测试采用酸洗法,将压碎后的试块分为上、中、下3个部分,分别测量其CaCO3含量,并由此计算整体的CaCO3含量。用4 mol/L的盐酸溶解样品,至无气泡产生为止。酸洗前后砂样质量差即为经微生物诱导生成的CaCO3质量,试样CaCO3含量为CaCO3质量与酸洗前试样质量的比值,即
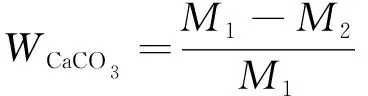
(1)
式中:WCaCO3——CaCO3含量;M1——试样酸洗前的质量;M2——试样酸洗后的质量。
4 结果与讨论
4.1 水溶液试验
一般而言,CS转化效率越高,意味着土体内部孔隙被CaCO3填充得更充分,土体最终表现出的力学性能(强度、抗渗性等)也将更优越[24]。图3统计了不同浓度的细菌在失活前转化CS的效率。对于S1组,低浓度细菌(OD为0.45,活性为3 U/mL)能消耗2.23批次1 mol/L的CS(1 mol/L是指MICP处理液中CS的浓度)。当细菌浓度增大至其2倍、4倍和8倍时,分别能消耗4.17、6.07和6.2批次1 mol/L的CS,这说明细菌浓度的提高能够诱导生成更多的CaCO3,这与赵茜[17]和Okwadha等[18]的结论相吻合。试验中还发现S1组第二次加入细菌后,能消耗2.32批次CS,与首批次细菌消耗的CS总量基本相同,这意味着溶液中前一批次细菌产生的CaCO3对后一批次细菌的成矿能力影响不大。当细菌总量相同时,不同细菌注入方法产生的CaCO3总量S1组>S2组>S3组>S4组(图4),其中S1组CaCO3生成量约为S4组的2.9倍。这说明相比于高浓度细菌(OD为3.6,活性为24 U/mL)一次注入的方法,低浓度细菌(OD为0.45,活性为3 U/mL)分次注入时,单个细菌体的成矿能力更强,能诱导生成生成更多的CaCO3。
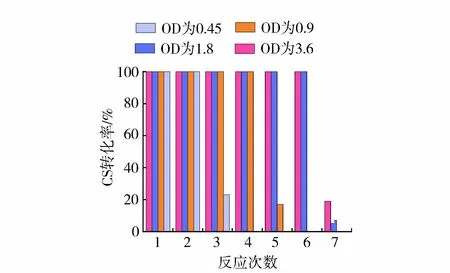
图3 不同浓度细菌转化CS的能力Fig.3 Conversion efficiency of CS by different concentration of bacterial
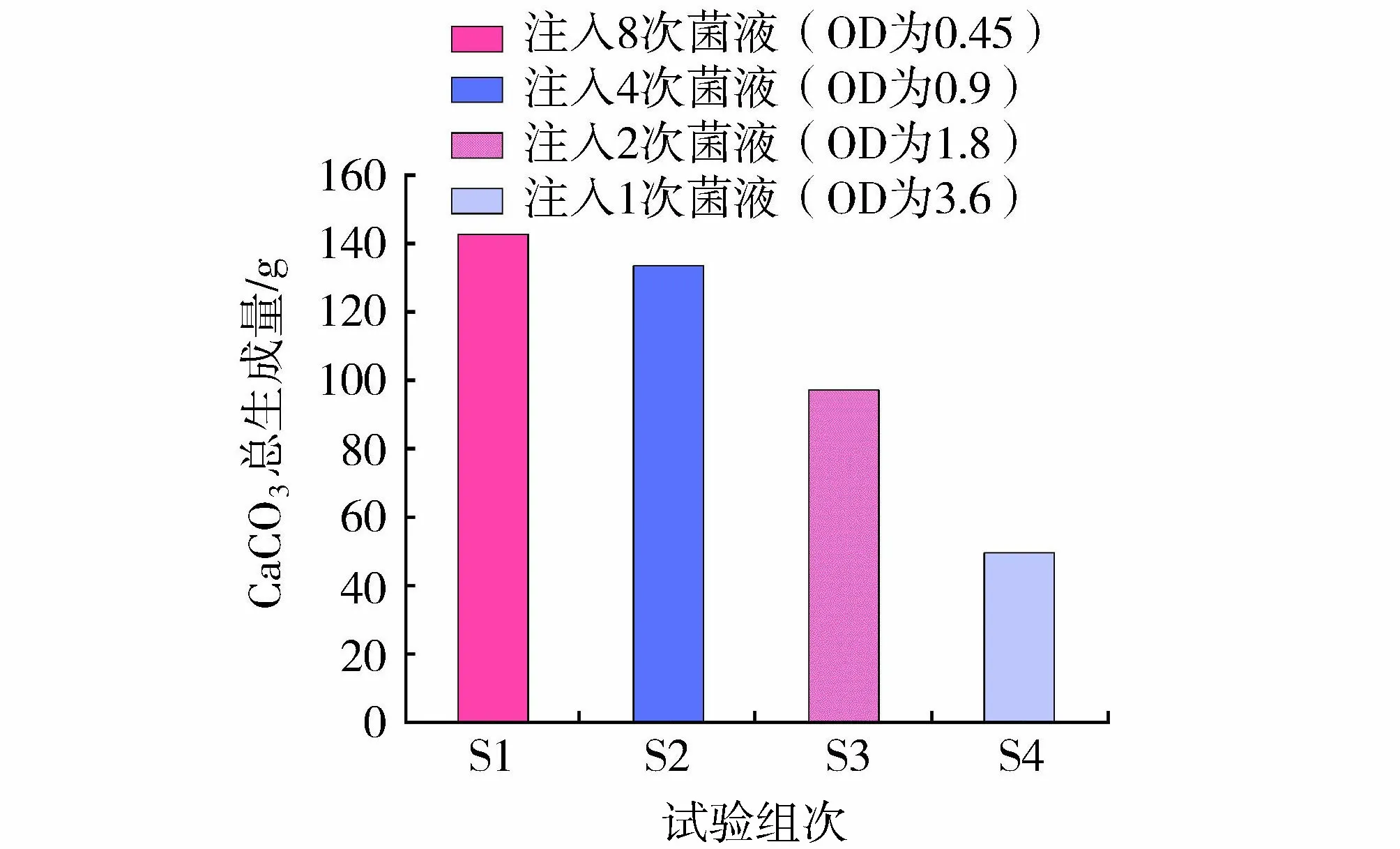
图4 不同细菌注浆方法CaCO3总生成量Fig.4 Total CaCO3 productions by different bacterial grouting methods
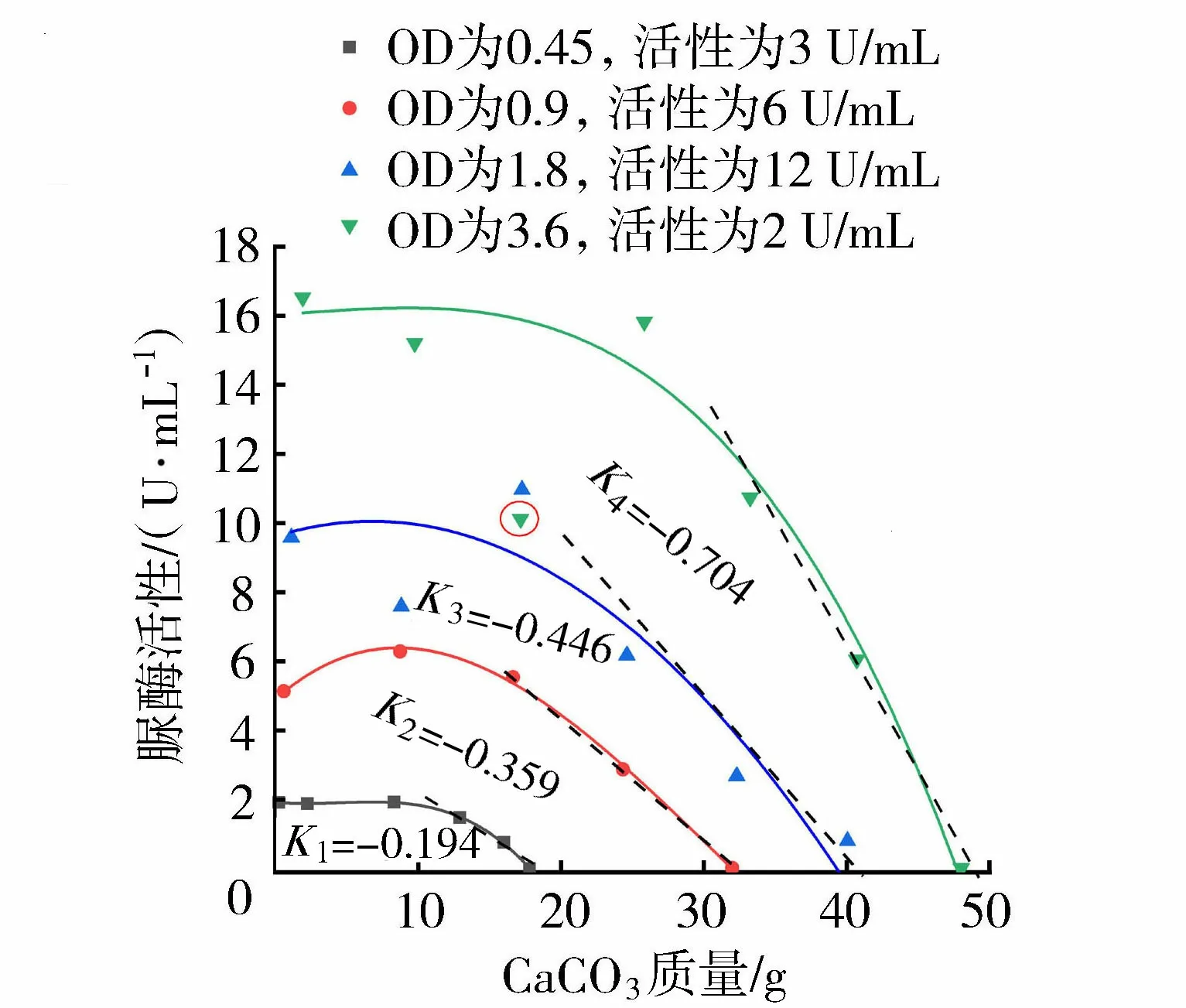
图5 不同浓度细菌脲酶活性变化曲线Fig.5 Curves of urease activity at different concentrations
图5给出了不同浓度细菌反应过程中脲酶活性与CaCO3沉积量的关系。从图5可以看出,在矿化反应初期,水溶液中细菌的脲酶活性与细菌浓度呈正相关。由于脲酶活性反映着溶液中的尿素的水解速率,故细菌浓度越高,溶液中MICP反应速率越快,这与Okwadha等[18]得到的结论一致。试验结果进一步显示:反应初期的CaCO3沉积对细菌活性影响不大,但是在反应中后期,当沉积的CaCO3达到某一定量时,随着CaCO3的生成,反应速率呈线性下降的趋势。值得关注的是,溶液中细菌浓度越高,该阶段反应速率下降得越快,这意味着细菌脲酶活性损失得更多,其成矿能力在迅速减弱。这也是图4中采用高浓度细菌注入1次时CaCO3总生成量较低浓度细菌分次注入时少的原因。
对于研究中产脲酶菌所表现的活性变化规律,其主要原因是:在矿化反应初期,生成的CaCO3附着在细菌表面,但细菌未被完全包裹,营养物质的输送基本不受影响,故脲酶活性变化不大。后期随着CaCO3沉积量的增加,细菌因被CaCO3完全包裹而死亡,最终失去活性[25]。有研究表明,相比于低浓度细菌,高浓度的细菌易集聚或絮凝形成更大尺寸的CaCO3晶体簇[26]。当团簇的细菌被CaCO3完全包裹失活时,其损失的细菌量更大,这将导致反应体系内脲酶活性下降得更快。因此,在相同细菌量的条件下,相比于分次注入低浓度细菌,一次性注入高浓度细菌会导致生成的CaCO3总量减小。值得注意的是,试验中高浓度细菌(OD为3.6,活性为24 U/mL)在前期反应速率出现了一个骤减(图5中圈出点)再回升的过程,这可能是由于微生物浓度过高,在反应过程中细菌短暂集聚(此时被包裹的细菌不提供活性)后又分散引起的,这需要后期更为微观的检测才能确定。
4.2 一相浆液微生物过滤试验
图6为含不同浓度细菌的一相浆液静置不同时间后通过砂层的情况。从图6可知,对于低浓度细菌的一相浆液(M1组,细菌OD为0.225,活性为1.5 U/mL),静置0~8 min后注入砂层,其流出液中细菌剩余量变化不大,约占细菌总量的40%~80%。当细菌浓度增至其2倍(OD为0.45)和4倍(OD为0.9)时,同样表现出此规律。这说明一相浆液中细菌浓度OD未超过0.9时,pH降至4至少能够提供8 min的注浆窗口期,在此期间细菌絮凝现象并不明显,且MICP反应比较缓慢,细菌能够顺利通过砂体内部的孔隙通道。当一相浆液(M4组,细菌OD为1.8,活性为12 U/mL)细菌浓度增至M1组的8倍时,流出液中细菌剩余量呈现“基本不变-急剧减小-稳定在极小值-激增”的规律,急剧减少的原因是由于高浓度细菌前期大量絮凝,无法通过砂体孔隙通道,但是一段时间后,MICP反应开始变得剧烈,流出液中含大量CaCO3微晶,导致流出液OD值激增,此时的OD值已无法表征细菌浓度。图7是含低浓度细菌(OD为0.225,活性为1.5 U/mL)和高浓度细菌(OD为1.8,活性为12 U/mL)的一相浆液静置8 min后流出液的对比图,可看出前者流出液依然澄清,而后者由于含CaCO3微晶的缘故,已十分浑浊。这说明对于8倍浓度的细菌,其窗口期只能够达到2 min。

图6 流出液中细菌剩余量随静置时间的变化Fig.6 Residual bacteria in effluent with different waiting time

图7 M1组和M4组静置8 min后流出液浊度对比Fig.7 Comparison of turbidity of effluent from group M1 and group M4 after 8-minute waiting
本研究的砂柱固化试验,在一相浆液配制完成后(0 min)立即开始进行注浆,故对于含各浓度细菌的一相浆液,不会发生因细菌絮凝而使微生物无法通过砂体孔隙通道的现象。值得注意的是:本节中细菌浓度(活性)特指一相浆液中的细菌浓度(活性)。
4.3 低pH一相注固化砂柱试验
4.3.1 CaCO3含量分布
在MICP实际工程应用中,CaCO3在土体内分布是否均匀是评估注浆可行性及固化效果好坏的重要指标,图8给出了采用不同细菌注浆方法固化形成的砂柱(处理次数为4、6、8)其CaCO3的分布情况。可以看出,在细菌总量一定的情况下,相比于D组(即细菌OD为3.6,活性为24 U/mL,一次注入细菌),A组(即细菌OD为0.45,活性为3 U/mL,分次注入细菌)砂柱其CaCO3分布更为均匀,砂柱沿高度方向CaCO3含量的差异基本不超过1%。Qabany等[27]采用浓度为0.1~1 mol/L的CS对砂柱进行胶结时,发现高浓度CS(1 mol/L)处理后的砂柱同样会表现出CaCO3分布不均的现象。这是由于反应前期,在高浓度细菌或CS环境下,过快的尿素水解速率会导致CaCO3晶体大量沉积,使得砂体内部孔隙通道发生局部堵塞,影响注浆液的正常渗流,进而使得后续反应生成的CaCO3无法均匀沉积。因此,采用高浓度菌液或CS溶液处理土体时,易导致土体内CaCO3分布不均,对MICP固化效果产生不利的影响。
4.3.2 无侧限抗压强度
将各组固化程度CaCO3含量相近(13%±1%)的砂柱进行无侧限抗压强度对比(图9)。由图9可知,在CaCO3含量基本相同的情况下,各组砂柱无侧限抗压强度值从大到小为:A组、B组、C组、D组。这说明当细菌注入的总量一定时,低浓度细菌分次注入固化形成的砂柱其土力学抗压性能要优于其他组,且首次注入的细菌浓度越大,砂柱的无侧限抗压强度越低。例如:A组(即细菌OD为0.45,活性为3 U/mL,分次注入细菌)砂柱无侧限抗压强度达到D组(即细菌OD为3.6,活性为24 U/mL,一次注入细菌)的2.5倍。
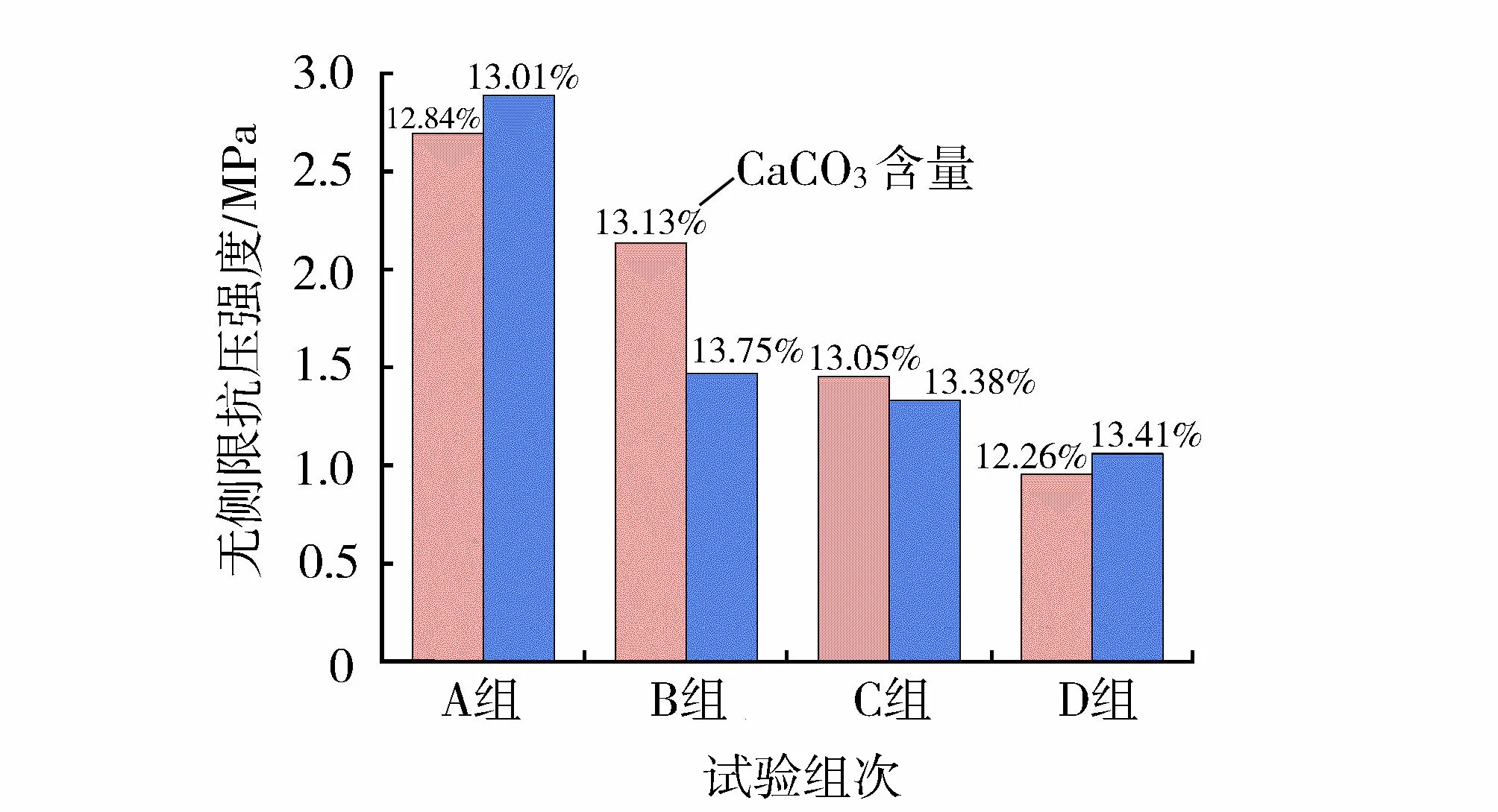
图9 不同注浆方法下砂柱无侧限抗压强度对比Fig.9 Comparison of UCS of sand columns with different grouting methods
Cheng等[28]通过SEM观测结果指出:在CaCO3晶体形成的过程中,低浓度的细菌由于成核位点少,在CaCO3晶体成核-生长的竞争当中,晶体生长占主要优势,因此易生成颗粒较大的CaCO3晶体,并填充在砂颗粒孔隙当中;而高浓度的细菌由于细菌量大,成核位点多,CaCO3晶体成核占主要优势,反应易生成大量微小的CaCO3晶体颗粒,并附着在砂颗粒表面,形成薄薄的CaCO3晶体层,且难以填充砂颗粒间的孔隙。因此,低浓度细菌诱导生成的CaCO3晶体颗粒在砂颗粒间能够起到更有效的连接作用,进而使砂体表现出更优的力学性能。试验结果表明:在工程实践中,采用低浓度细菌(OD为0.45,活性为3 U/mL)分次注入的方法能够更加高效地提高土体的无侧限抗压强度。这能一定程度上减少注浆液的用量,节约经济成本。值得注意的是,用于处理土体的细菌其浓度不能过低,这会使得CS无法完全转化为CaCO3,造成反应物(尿素和氯化钙)的浪费。
5 结论与展望
a. 在细菌总量一定的条件下,探究了分次注入低浓度细菌和一次性注入高浓度细菌对MICP一相注工艺的影响。主要从CaCO3生成量、脲酶活性变化、注浆窗口期及砂柱固化特性几个方面综合评价了2种注浆方法的可行性及加固效果。试验结果表明:相比于高浓度细菌(OD为3.6,活性为24 U/mL)一次注入的方法,将低浓度细菌(OD为0.45,活性为3 U/mL)分次注入效果更好,其优势主要体现在以下几点:(a)低浓度细菌(OD为0.45,活性为3 U/mL)在反应过程中活性下降更慢,当细菌总量相同时,低浓度细菌分次注入能够产生更多的CaCO3;(b)低浓度细菌(OD为0.45,活性为3 U/mL)不易发生絮凝,能够提供更长的注浆窗口期;(c)在CaCO3含量接近的情况下,相对于高浓度细菌(OD为3.6,活性为24 U/mL),低浓度细菌(OD为0.45,活性为3 U/mL)在反应过程中能够形成颗粒更大的CaCO3晶体,且更为有效地填充在砂颗粒孔隙中。因此分批次注入低浓度细菌(OD为0.45,活性为3 U/mL)能够显著提高固化砂柱的无侧限抗压强度。
b. 在保证固化效果的情况下,能够有效减少细菌和胶结液的用量,降低经济成本,这为今后MICP技术在地基加固领域中的实际应用提供了一定的参考价值。但是细菌浓度过低可能会出现胶结液残留和反应速率过慢等现象,因此,在以后的研究和实际工程当中,需要确定最低细菌浓度,从而在满足工程应用的同时获得较好的固化效果和经济效益。
