miR-10b通过抑制KLF4表达诱导胃癌细胞对顺铂耐药
2020-06-12
易弼顺,马柏强,李冰震,田锋,丽水市人民医院创伤/急腹症、疝外科 浙江省丽水市 323000
0 引言
胃癌(gastric cancer,GC)是常见的消化系统肿瘤.早期GC症状与一些胃病(如:胃炎和胃溃疡等)类似,容易被忽视,多数患者确诊时已是中晚期GC[1].对GC化疗主要是以铂类为主的联合化疗方案,但是药物化疗常出现耐药,导致治疗效果不佳[2].
miRNAs可参与调控胚胎发育、肿瘤发生、转移、化疗耐药和代谢等众多生理和病理过程[3-5].而,大多数miRNAs的生物学功能尚未完全阐明,且多数miRNAs在调节化疗耐药性中的作用以及其中涉及的分子机制未被报道.顺铂(cisplatin,DDP)是一种临床上常用的化疗药物,可对多种肿瘤(如:肺癌和食管癌等)发挥治疗效应[6,7].尽管DDP通常在初始的治疗中表现出明显的疗效,但是由于耐药性的产生,则不可避免地导致后续化疗效果不理想.因此克服DDP的化疗抗性仍然是当前面临的重大挑战.已有研究[8,9]报道,miR-10b能促进食管癌和鼻咽癌细胞DDP耐药.另外,多篇文献[9-11]显示,miR-10b能通过下调Krueppel样因子4(Krueppel-like factor 4,KLF4)表达来促进多种肿瘤细胞上皮间质转化、迁移与侵袭.据报道[12,13],miR-10b在GC组织中高表达,且其与肿瘤分期和预后不良呈正相关;而在GC中其与DDP化疗敏感性的关系并不清楚.因此本研究通过检测细胞活力、细胞凋亡以及细胞内分子水平的改变,推断出GC可能的DDP耐药产生机制;并试图探究miR-10b与KLF4的相互作用在GC细胞对DDP耐药性的影响,为临床治疗提供新思路.
1 材料和方法
1.1 材料 GC细胞SGC-7901和MGC-803(上海雅吉生物科技有限公司).DDP和MTT试剂盒(Sigma,美国);青霉素-链霉素混合溶液、RPMI-1640培养基(Thermo Fisher Scientific,美国);ECL试剂(Millipore,美国);BCA蛋白测定试剂盒和Annexin V-FITC/PI双染细胞凋亡检测试剂盒(上海碧云天生物科技有限公司,中国)KLF4抗体和II 抗(Abcam,美国);MiRNeasy mini试剂盒、miScript II RT试剂盒和miScript SYBR Green PCR试剂盒(Qiagen,德国).酶标仪(Bio-Rad,美国);流式细胞仪(Bio-Rad,美国);ABI StepOne TM实时PCR系统(Applied Biosystems,美国).
1.2 方法
1.2.1 GC的DDP耐药细胞系构建:以SGC-7901和MGC-803为亲本细胞,诱导DDP耐药细胞.首先用MTT法测定DDP对GC亲本细胞的半数抑制浓度为7.5 μmol/L和8.4 μmol/L.首次加药浓度为2 μmol/L,每48 h换液一次,并反复加入同种浓度DDP,待细胞在含DDP浓度的培养基中稳定生长时,再按照2、3、5、8、12和16 μmol/L DDP浓度递增方法,直到细胞可在16 μmol/L的DDP浓度中稳定生长,至此建立SGC-7901/DDP和MGC-803/DDP细胞.在后续实验前,SGC-7901/DDP和MGC-803/DDP细胞在无DDP条件下培养2 wk.
1.2.2 细胞培养:SGC-7901、MGC-803、SGC-7901/DDP和MGC-803/DDP细胞培养于RPMI-1640培养基,置于37 ℃、饱和湿度、5% CO2的恒温箱中培养,培养基中添加10% FBS及青霉素-链霉素混合溶液(含青霉素、链霉素各100 U/mL).培养基每周更换2-3次,用0.25%的胰蛋白酶消化传代,传代比1:4.
1.2.3 慢病毒感染:miR-10b过表达的慢病毒载体(lentivirus-miR-10b,miR-10b)、阴性对照lentivirus-miRNC(NC)、lentivirus-KLF4(KLF4)以及慢病毒空载体lentivirus-Vector(Vector)由广州锐博生物科技公司合成,其中NC为乱码序列,与人已知的miRNAs序列无同源性,作为miR-10b的阴性对照;Vector作为KLF4的阴性对照.
分别将SGC-7901和MGC-803细胞以2×104细胞/孔接种在24孔板上,然后10 MOI miR-10b或NC感染SGC-7901和MGC-803细胞48 h,构建miR-10b组和NC组.
取miR-10b组或NC组的细胞,再分别感染10 MOI Vector或KLF4 48 h,构建NC+Vector组、miR-10b+Vector组和miR-10b+KLF4组.
1.2.4 MTT法检测细胞活力:分别将SGC-7901、MGC-803、SGC-7901/DDP和MGC-803/DDP细胞和已经病毒感染的细胞以1×104个细胞/孔接种在96孔板上,然后采用不同浓度(0、10、20、30、40 μmol/L)DDP处理24 h.吸除培养基后,然后在37 ℃下与100 μL 5 mg/mL MTT一起孵育3 h,弃孔内上清液.随后,在室温下加入400 μL DMSO并摇动15 min.通过酶标仪读取590 nm处各孔吸光度.
1.2.5 细胞凋亡分析:分别取已感染的细胞,以2×104个细胞/孔接种在24孔板上,然后采用20 μmol/L DDP处理24 h.然后收集细胞,按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书步骤,用碘化丙锭(propidium iodide,PI)和膜联蛋白V(annexin V)-FITC对细胞共染色.通过流式细胞仪分选计数凋亡细胞.
1.2.6 RT-qPCR分析:对于miR-10b分析采用使用MiRNeasy mini试剂盒按照说明书进行分析.对于KLF4 mRNA检测,采用TRIzol试剂盒提取总RNA,测定RNA浓度后,将(1 μg)的总RNA转化为cDNA.将稀释的cDNA与含有通用引物和SYBR Green染料的miScript SYBR Green PCR Kit混合,并加入含有冻干引物于PCR板的孔中.
miR-10b的正向引物为5’-ACATCATACCCTGTAGAACCGAA-3’,反向引物为5’-GATTGGATGT T C T C C A C A G T C T C-3’;K L F4的正向引物为5’-CGAACCCACACAGGTGAGAA-3’,反向引物为5’-TACGGTAGTGCCTGGTCAGTTC-3’;U6的正向引物为5’-GCTTCGGCACATATACTAAAAT-3’,反向引物为5’-CGCTTCACGAATTTGCGTGTCAT-3’;GAPDH的正向引物为5’-CGACCACTTTGTCAAGCTCA-3’,反向引物为5’-AGGGGTCTACATGGCAACTG-3’.用ABI StepOne TM实时PCR系统进行RT-qPCR检测,并测定的Ct值,miR-10b以U6为内参,KLF4以GAPDH为内参,采用2-△△Ct法分析基因的相对表达量.
1.2.7 蛋白质免疫印迹:细胞以4×105个/孔的密度接种在6孔培养皿中,培养24 h后,用1 mL PBS/孔洗涤细胞,并通过胰蛋白酶消化收集细胞.在冰上,将细胞在RIPA裂解缓冲液中孵育30 min,然后在4 ℃下1.2×105g离心30 min收集总蛋白.使用BCA试剂盒测定蛋白质浓度.随后,取50 μg总蛋白使用8%-15%十二烷基SDS-PAGE凝胶电泳,并转移到PVDF膜上.将膜用含5%脱脂奶粉的TBST中封闭2 h,并孵育Ⅰ抗(KLF4抗体,1:2000稀释)4 ℃过夜.洗涤膜3次,并与Ⅱ抗一起温育,洗涤膜3次后用ECL试剂显影.用凝胶成像设备对膜进行成像,并用Image J软件进行半定量分析.
1.2.8 异种移植肿瘤模型:6周龄SPF级雄性裸鼠(18-21 g)购自温州医科大学实验动物中心[SCXK(浙)2015-0001],饲养于温州医科大学实验动物中心S P F级动物房[SYXK(浙)2018-0017].12只小鼠随机分成两组,每组6只,分别为阴性对照(NC)组和miR-10b过表达组.将NC组或miR-10b组的SGC-7901细胞(3×106个细胞)重悬于100 μL培养基中,并以体积比1:1的比例与基质胶混合,然后皮下注射到每只小鼠的右腹皮下.在第2周末,观察小鼠成瘤情况,其中miR-10b组有一只小鼠未成瘤,剔除本研究.第3周起,每日腹腔注射5 mg/kg(体重)DDP 1次,持续4 wk.在第6周末,用断颈法处死小鼠,解剖并取出肿瘤测量称重.
统计学处理数据表示为mean±SD.使用Graphpad Prism 7.0软件对数据进行分析.两组数据的比较行双尾t检验,多组数据的两两比较行单因素方差分析后Bonfferoni检验.P<0.05认为差异有统计学意义.
2 结果
2.1 GC的DDP耐药细胞鉴定 MTT结果显示(图1),不同浓度DDP处理后,与SGC-7901或MGC-803细胞比较,SGC-7901/DDP和MGC-803/DDP细胞的细胞活力降低较慢(P<0.01).以上结果表明构建的SGC-7901/DDP和MGC-803/DDP细胞株具有DDP耐药性.
2.2 GC的DDP耐药细胞中miR-10b表达增加 图2结果显示,与SGC-7901或MGC-803细胞比较,SGC-7901/DDP和MGC-803/DDP细胞中miR-10b的表达显著增加(P<0.01).提示,miR-10b可能是GC细胞产生耐药性的重要分子.
2.3 过表达miR-10b导致GC细胞对DDP耐药 对GC细胞进行慢病毒感染miR-10b或miR-NC,结果如图3所示,与NC组相比,miR-10b组的SGC-7901细胞(图3A)和MGC-803(图3B)中miR-10b表达显著增加(P<0.01),结果表明,过表达miR-10b的细胞构建成功.对已过表达miR-10b的GC细胞进行不同浓度的DDP处理,再进行细胞活力检测,结果发现,与NC组比较,miR-10b组的SGC-7901细胞(图3C)和MGC-803(图3D)细胞活力显著增加(P<0.01).随后,本研究检测过表达miR-10b对20 μmol/L DDP诱导的凋亡的影响,结果发现,与NC+20 μmol/L DDP组比较,miR-10b+20 μmol/L DDP组的SGC-7901细胞(图3E、F)和MGC-803(图3E、G)细胞凋亡比例显著降低(P<0.01).
2.4 过表达miR-10b抑制体内DDP化疗效果 用NC组或miR-10b组的SGC-7901细胞构建异位GC移植瘤模型,并使用DDP进行化疗.结果显示,与NC+DDP组相比,miR-10b+DDP组SGC-7901细胞形成的肿瘤明显变大(图4A),肿瘤质量显著增加(图4B)(P<0.01).表明miR-10b高表达促进SGC-7901细胞产生DDP耐药性.
2.5 上调KLF4的表达可以抑制miR-10b介导的DDP耐药 首先分析KLF4在GC的DDP耐药细胞中表达,结果(图5A-F)显示,与SGC-7901或MGC-803细胞比较,SGC-7901/DDP和MGC-803/DDP细胞中KLF4的mRNA和蛋白表达均显著降低(P<0.01).进一步对GC细胞过表达miR-10b,检测KLF4的表达,结果显示,与NC组比较,在miR-10b组的SGC-7901细胞中KLF4的mRNA(图5G)和蛋白(图5H、I)表达均显著降低(P<0.01);在MGC-803细胞中也见类似的结果(图5J-L).
构建miR-10b和KLF4共过表达的GC细胞,Western blot结果(图6A-D)显示,与miR-10b+Vector组比较,miR-10b+KLF4组的SGC-7901和MGC-803细胞中KLF4蛋白表达均显著增加(P<0.01).用不同浓度的DDP处理细胞,MTT结果显示,与miR-10b+Vector组比较,miR-10b+KLF4组SGC-7901细胞(图6E)和MGC-803细胞的细胞活力显著增加(P<0.05).提示,miR-10b可能通过抑制KLF4的表达导致GC细胞对DDP耐药.
3 讨论
GC常以铂类药物为基础的联合化疗方式进行化疗,但化疗能产生耐药性[2].而探索GC化疗耐药产生的机制,有助于提高今后对GC的化疗效果.
miRNA是一类内源性非编码的RNA小分子,可通过碱基互补结合多个靶mRNA的3′UTR区调控靶基因mRNA表达,从而在转录后调控生物学功能[5].miR-10b作为miRNA家族中的成员之一,定位于2号染色体短臂3区l带l亚带的HOXD4与HOXD8基因之间[14].除了作用于翻译抑制外,研究[15]发现miR-10结合含有末端寡嘧啶基序的一组转录物并诱导它们的翻译,从而为miRNA家族添加新功能.miR-10b在乳腺癌中表达下调[16],其下调能促进乳腺癌进展;而在GC[12,13]、食管癌[8]和黑色素瘤[17]等恶性肿瘤中表达上调,且其上调增强上述肿瘤细胞的增殖、迁移与侵袭[9-11].这体现了miR-10b在不同肿瘤中表达和功能的多样性.另外,miR-10b能促进食管癌和鼻咽癌细胞DDP耐药[8,9],而其在GC中与DDP化疗敏感性的关系并不清楚.本研究发现miR-10b过表达可导致体外GC细胞DDP耐药性的产生,且体内SGC-7901细胞移植瘤实验进一步确认了这一现象.KLF4在机体广泛表达,主要表达于消化道、口腔、食管上皮、皮肤表皮、血管内皮和胸腺上皮细胞中[18].据报道[19],敲除KLF4可促进GC细胞增殖和转移,而过表达KLF4则可抑制转移和浸润,促进细胞凋亡.在线靶基因预测数据库显示miR-10b在KLF4的mRNA在295-301位点存在结合区域.且已有文献[10,20]指出KLF4是miR-10b的靶基因之一.在多种肿瘤细胞中,敲除KLF4能促进肿瘤细胞的多种化疗药物耐药,而过表达KLF4能增强化疗药物敏感性[21,22].本研究发现,DDP耐药的GC细胞(miR-10b过表达的GC细胞)中KLF4也处于低表达状态,通过慢病毒过表达KLF4,发现过表达KLF4能部分逆转miR-10b诱导的DDP耐药.
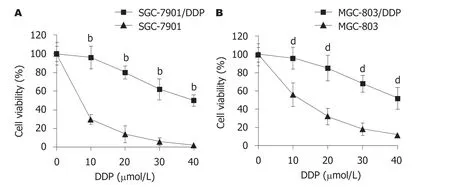
图1 SGC-7901/DDP和MGC-803/DDP细胞的顺铂耐药性鉴定.A、B:分别用0、10、20、30和40 μmol/L DDP处理细胞24 h后,MTT法检测SGC-7901/DDP(A)和MGC-803/DDP(B)细胞的细胞活力.n=4,bP<0.01 vs SGC-7901细胞;dP<0.01 vs MGC-803细胞.DDP:顺铂.
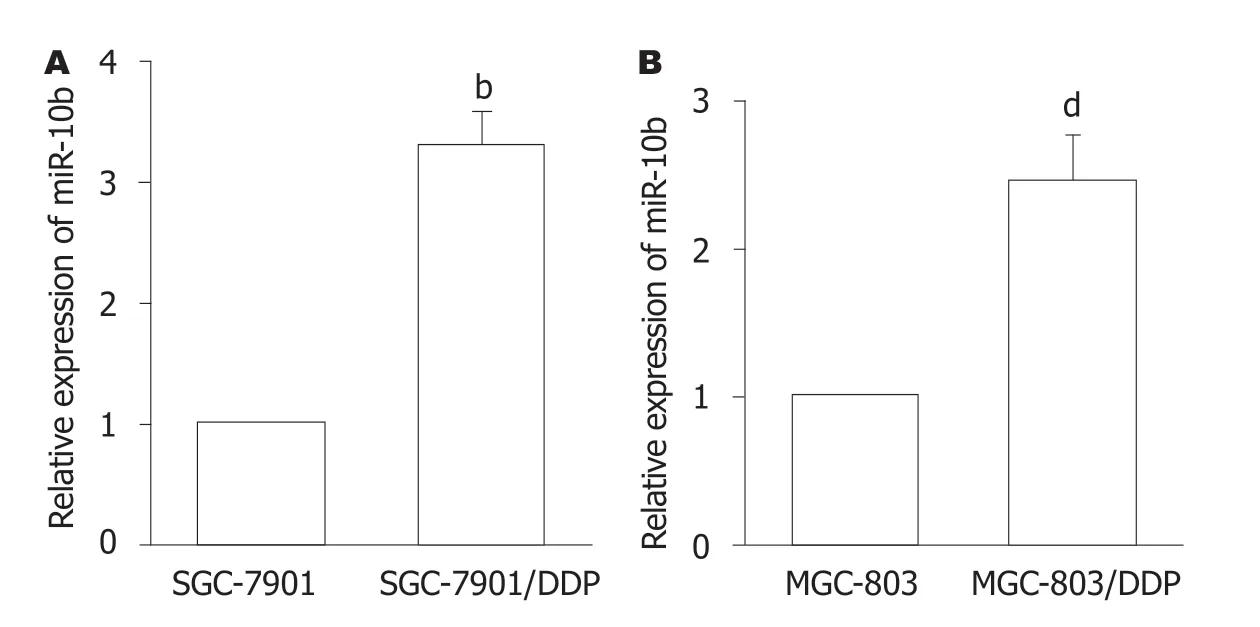
图2 miR-10b在胃癌顺铂耐药细胞中高表达.A、B:RT-qPCR检测SGC-7901/DDP(A)和MGC-803/DDP(B)细胞中miR-10b表达.n=4,bP<0.01 vs SGC-7901细胞;dP<0.01 vs MGC-803细胞.DDP:顺铂.
综上所述,本研究表明上调miR-10b会使GC细胞对DDP产生耐药性,并且这一作用可能是通过下调KLF4的表达实现的,通过上调KLF4的表达能在一定程度上降低GC细胞对DDP的耐药性.
文章亮点
实验背景
胃癌(gastric cancer,GC)在化疗程序中会产生获得性化疗耐药,最终导致化疗失败.已有研究显示miRNAs可参与调节GC的化疗耐药,而miRNAs数量众多,多数miRNAs在调节GC化疗耐药中的作用尚未被鉴定.
实验动机
上调miR-10b能增加食管癌和鼻咽癌细胞对顺铂(cisplatin,DDP)的耐药性.miR-10b在GC中高表达.而目前尚无关于GC中miR-10b与DDP化疗敏感性的关系的报道.
实验目标
研究miR-10b与GC细胞DDP化疗敏感性的关系,并探讨其中的机制.
实验方法
比较GC细胞与DDP耐药细胞中miR-10b的表达差异.观察过表达miR-10b对体外和体内DDP化疗敏感性的影响.分析过表达miR-10b对KLF4表达的影响,并通过修复实验验证miR-10b、KLF4与DDP敏感性三者之间的内在联系.
实验结果
miR-10b在GC的DDP耐药细胞中高表达.上调GC细胞中miR-10b表达能导致细胞对DDP敏感性降低,并下调KLF4表达.上调KLF4能废除过表达miR-10b对GC细胞DDP耐药的促进作用.
实验结论
上调miR-10b表达能通过负调控靶基因KLF4促进GC细胞DDP化疗耐药.
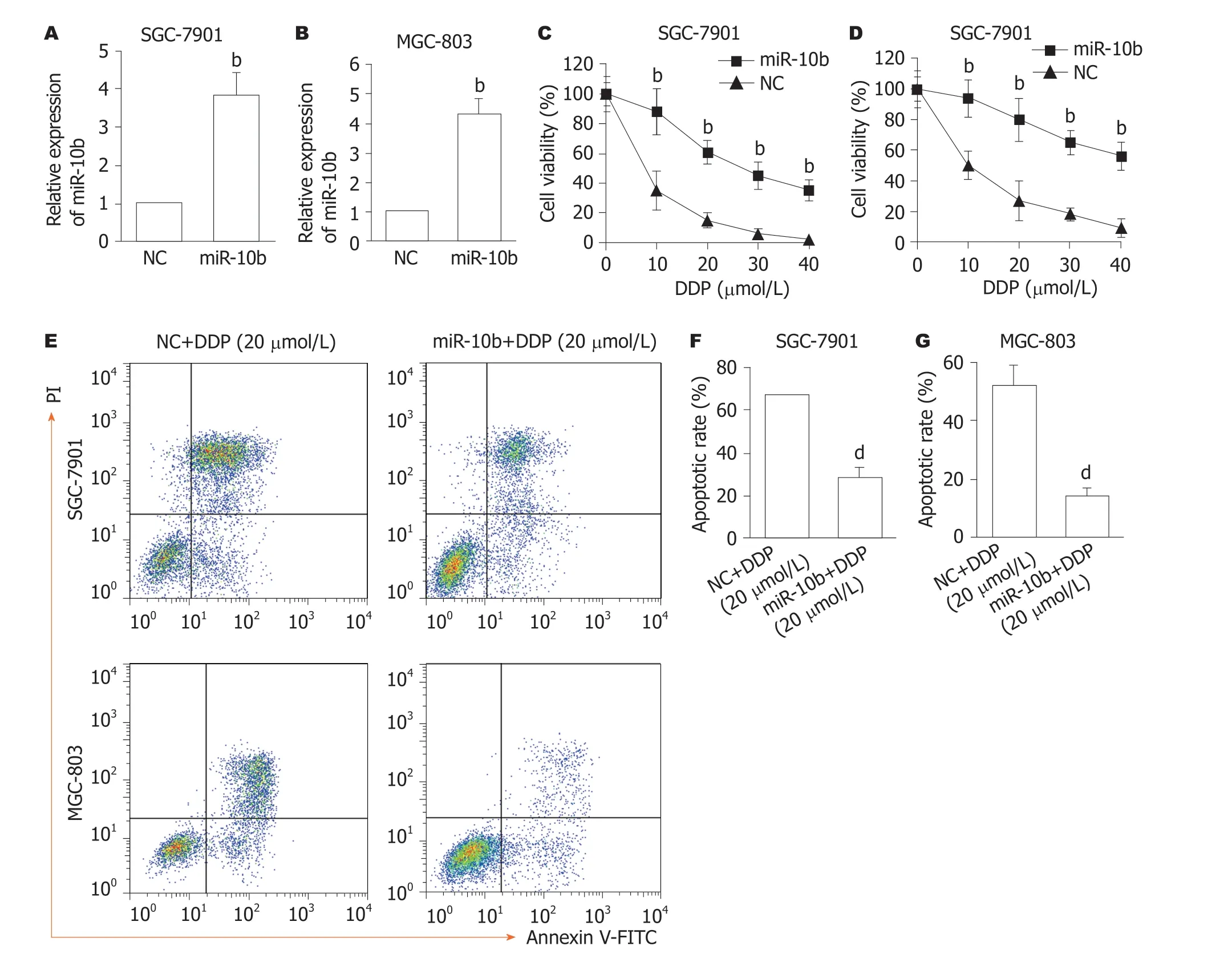
图3 过表达miR-10b对顺铂诱导的胃癌细胞活力及凋亡的影响.A:SGC-7901细胞中miR-10b过表达效率鉴定,n=4,bP<0.01 vs NC组;B:MGC-803细胞中miR-10b过表达效率鉴定,n=4,bP<0.01 vs NC组;C:SGC-7901细胞转染miR-NC或miR-10b后,接着再分别用0、10、20、30和40 μmol/L DDP处理细胞24 h,MTT法检测细胞活力,n=4,bP<0.01 vs NC组;D:MGC-803细胞转染miR-NC或miR-10b后,接着再分别用0、10、20、30和40 μmol/L DDP处理细胞24 h,MTT法检测细胞活力,n=4,bP<0.01 vs NC组;E-G:SGC-7901和MGC-803细胞转染miR-NC或miR-10b后,接着再用20 μmol/L DDP处理细胞24 h,Annexin V-FITC/PI染色法检测细胞凋亡(E:代表性流式细胞散点图;F:SGC-7901细胞凋亡统计结果,n=4,dP<0.01 vs NC+DDP组;G:MGC-803细胞凋亡统计结果,n=4,dP<0.01 vs NC+DDP组).DP:顺铂;PI:碘化丙锭;annexin V:膜联蛋白V.
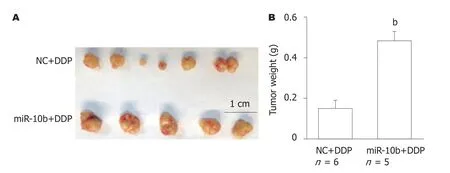
图4 miR-10b过表达导致SGC-7901细胞移植瘤对顺铂产生耐药性.A:瘤体的宏观图像;B:瘤体重量的统计数据,bP<0.01 vs NC+DDP组.DDP:顺铂.

图5 KLF4在胃癌顺铂耐药细胞中表达和miR-10b对KLF4表达的影响.A-C:SGC-7901和SGC-7901/DDP细胞中KLF4的mRNA (A)和蛋白(B和C)的表达水平,n=4,bP<0.01 vs SGC-7901细胞;D-F:MGC-803和MGC-803/DDP细胞中KLF4的mRNA (D)和蛋白(E和F)的表达水平,n=4,dP<0.01 vs MGC-803细胞;G-I:过表达miR-10b后,SGC-7901细胞中KLF4的mRNA (G)和蛋白(H和I)的表达水平,n=4,fP<0.01 vs NC组;J-L:过表达miR-10b后,MGC-803细胞中KLF4的mRNA (J)和蛋白(K和L)的表达水平,n=4,fP<0.01 vs NC组.DDP:顺铂.
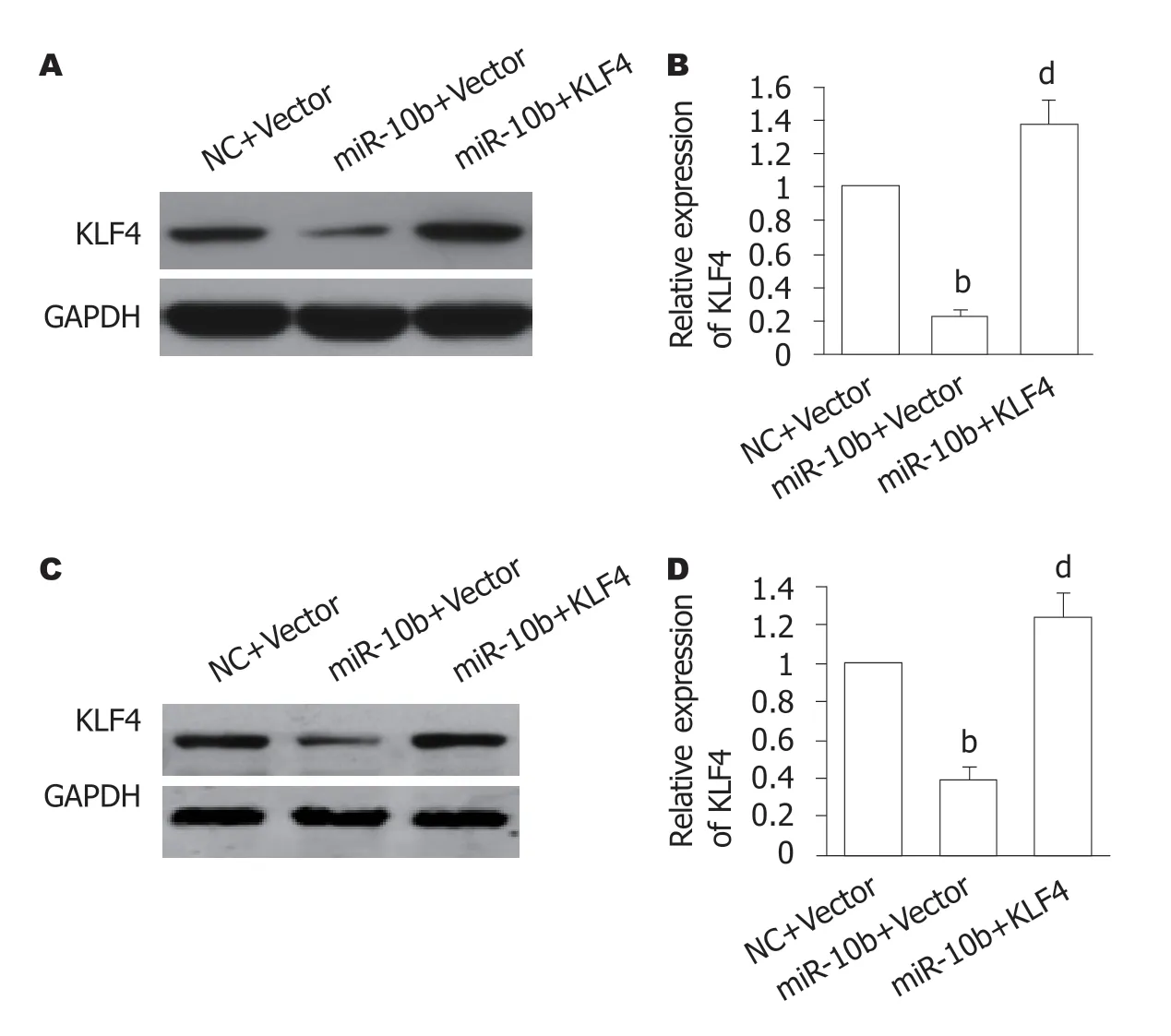

图6 上调KLF4的表达可部分逆转miR-10b介导的顺铂耐药.A和B:三组的SGC-7901细胞中KLF4的蛋白表达水平,n=4,bP <0.01 vs NC+Vector组,dP<0.01 vs miR-10b+Vector组;C和D:三组的MGC-803细胞中KLF4的蛋白表达水平,n=4,bP<0.01 vs NC+Vector组;dP<0.01 vs miR-10b+Vector组;E:三组的SGC-7901细胞的细胞活力,n=4,bP<0.01 vs NC+Vector组;cP<0.05 vs miR-10b+Vector组;F:三组的MGC-803细胞的细胞活力,n=4,bP<0.01 vs NC+Vector组;cP<0.05 vs miR-10b+Vector组.DDP:顺铂.
展望前景
本研究探明了miR-10b促进GC的DDP耐药调控机制,并为GC的DDP耐药的治疗提供了参考靶点.
