肝癌微波消融的研究进展
2020-06-12
何泽华,广西医科大学附属埌东医院普通外科 广西壮族自治区南宁市 530022
吴秋林,叶行,王开元,黎乐群,彭宁福,广西医科大学附属肿瘤医院肝胆胰外科 广西壮族自治区南宁市 530021
0 引言
原发性肝癌在我国恶性肿瘤发病率中排第四位,肿瘤相关死亡率中位居第三.其中,肝细胞癌(hepatocellular carcinoma,HCC)约占85%-90%,年龄标化后的5年生存率仅为10.1%.目前,早期肝癌的根治性手段主要包括手术切除、肝移植、消融治疗等.然而,由于常伴肝功能不全及其它合并症、肝内肿瘤分布、供体缺乏等原因,仅部分患者可行手术切除或肝移植治疗.由此,经皮局部消融(percutaneous local ablation,PLA),尤其微波消融(microwave ablation,MWA),被推荐为当前最佳替代治疗方法之一,适用于BCLC临床分期中的部分早期(A期)患者,要求肿瘤直径≤5 cm,以≤3 cm为优.依据2019年我国卫健委颁布的原发性肝癌诊疗规范,对Ia期及部分Ib期肝癌(即单个肿瘤、直径≤5 cm;2-3个肿瘤、最大直径≤3 cm;无血管、胆管和邻近器官侵犯及远处转移;肝功分级Child-Pugh A或B级);ECOG-PS 0-2,推荐行PLA或联合介入.对于适合肝移植的早期肝癌,PLA可作为桥接手段之一.其中,MWA即利用电磁波产生电磁场、加热诱导组织凝固坏死,临床上已广泛应用于肝癌(包括肝转移瘤)的治疗.本文将重点介绍MWA在肝癌患者中的疗效及并发症,同时介绍新一代MWA系统的相对优越性,为肝癌的消融治疗提供一些参考.
1 MWA规划策略及疗效评估
1.1 消融规划策略 MWA规划着重于如何将探针准确置入靶肿瘤,并选择合适的消融功率和时间(通常5-20 min),以确保肿瘤适形消融,尽可能保全周围正常组织.近来,鉴于缺乏可靠的MWA治疗规划,Liu等[1]提出三维可视规划系统,可显示肿瘤与周边重要脉管结构及临近组织的空间关系,测算其距离,并提供最少进针次数、最佳针径等参数,不仅有利于指导操作,且助于术后评估消融区.操作过程,常采用B超、计算机断层扫描(computed tomography,CT)等引导.B超具备实时、多平面成像、无辐射等优点,应用最广;CT可用于B超难以发现的部分病灶(如隔顶、肺附近),但有辐射.此外,两者联合可显著提高进针准度.然而,有时仍难以将探针精确靶向病灶.2019年最新研究[2]提示,计算机辅助导航、立体定向成像系统可显著提升靶向精度,进而提高安全性和疗效.另外,新近动物实验显示,CT引导下机器人能准确将各型消融针置入任一靶区[3];随后,在比较机械针系统与CT引导徒手置针的RCT研究中发现,前者定位次数与置入精度均优于后者[4].因此,智能三维置针可能是MWA未来研究的重要方向之一.
1.2 疗效评估方法 与手术切除相比,MWA不彻底消融率较高,相应局部复发率增加.为降低局部复发率,消融边界应至少扩大至肿瘤周围正常肝组织3-5 mm.目前,评估消融边界的常用手段包括B超、超声造影(contrastenhanced ultrasound,CEUS)、CT、增强CT(contrast enhancement CT,CECT)和磁共振成像(magnetic resonance imaging,MRI).其中,CECT不仅准确性较高[5],尚可早期发现MWA相关的并发症.B超准确度受组织产生的气体影响,而CEUS准确率类似于CECT,且成本低、无辐射.CT因MWA前后图像水平和方向不全匹配,很难确认是否达足够的消融范围.MRI可准确区分消融边缘及靶区内肿瘤组织,尤其弥散加权成像.鉴于消融后肿瘤存活与坏死部分的表观扩散系数存在差异,MRI可能是评估消融边缘的最有效方法[6].此外,PET/CT也具有一定的临床应用前景,但限于成本过高.然而,呼吸运动可引起消融前后切面位置不同,故CECT、CEUS和MRI在评估消融边界方面尚存在一定的局限.Tang等[7]发现,采用CT图像对肿瘤和消融部位进行三维重建拟合,可改善评估效果.
2 HCC的MWA及其它治疗
2.1 HCC的MWA治疗 首次治疗采用MWA的221例HCC中,术后随访1 mo.其中,201例(90.95%)获得一次性完全消融,8例(3.62%)实现二次完全消融,余12例(5.43%)二次消融后仍未完全消融,尤其>5 cm的肿瘤难以取得一次性完全消融.相关并发症22例(10.4%),包括胸腔积液、高胆红素血症各5例,腹水、腹腔内出血各2例,肝性脑病、肾上腺危象各1例,肾衰竭6例,无死亡.肿瘤大小、数目、位置与并发症发生率无显著相关性.中位随访41 mo,中位无复发生存(relapse free survival,RFS)、总生存(overall survival,OS)分别为14 mo、41 mo.多因素分析显示,甲胎蛋白(alpha-fetoprotein,AFP)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)是RFS独立影响因素,而肿瘤数目及大小、AFP、GGT、复发类别为OS独立预后因素.这些结果表明,MWA在HCC一线治疗中疗效显著,且具有良好耐受性[8].
2.2 MWA与手术切除 肝切除术(hepatic resection,HR)是治疗早期HCC的金标准,而PLA,包括MWA,广泛用于肿瘤<5 cm、高龄、肝功受损患者.长期随访表明,对于<5 cm的单发HCC,MWA与HR预后无明显差异,且前者创伤较小[9].然而,对于肿瘤>3 cm的患者,HR的RFS优于MWA,因此肝功正常患者,建议行HR[9,10].同时,有研究表明MWA和HR的OS和并发症发生率无显著差异,但前者局部复发率高于后者[10-13].在一项Meta分析中,包括1个随机对照试验(randomized controlled trial,RCT)和15个观察研究,涉及22-424名患者,随访时间为15-60 mo,大部分研究比较MWA与HR疗效,部分比较MWA+HR与单用HR/MWA治疗.结果显示,MWA局部复发的风险显著高于HR (RR=2.49,P=0.016).此外,MWA+HR与HR/MWA单一治疗的局部复发率无明显差异.虽然MWA、HR的1年生存率相同,但前者3、5年生存率分别较后者低6%、12%.然而,对于肿瘤较小和/或较深、肝功不全、合并症较多、肝外转移等不适合肝切除患者更倾向于选择MWA[14].
2.3 MWA与射频消融 射频消融(radiofrequency ablation,RFA)即利用电极电流在肿瘤内产热,使其坏死.与RFA比较,MWA有以下优势:产生更大消融区、治疗时间更短、不受周围组织及热沉效应影响.对95项研究(包括5224例经RFA治疗的肝肿瘤)行Meta分析结果显示,RFA局部复发率为12.4%,其中肿瘤>3-5 cm、>5 cm(局部复发率依次为24.1%、58.1%)治疗后局部复发率明显增高[15].对40项临床试验进行Meta分析,HCC患者经MWA治疗后(与RFA相比),肿瘤>3 cm的OS为22 mo (21 mo),肿瘤≤3 cm的OS为50 mo (27 mo);局部复发率、并发症发生率、无病生存期分别为3.9%-22.0% (0%-20.9%)、2.1%-61.5% (0%-45.4%)、14-22 mo (10.5 mo-NA).这些结果表明MWA和RFA的OS无统计学差异,当肿瘤直径≥3 cm或位于血管周围时,MWA优于RFA[16].另一研究,22例HCC 27个病灶行腹腔镜下(laparoscopic,Lap) MWA,13例HCC 15个病灶行Lap-RFA,发现两者安全性相当,但前者手术时间较短、肿瘤完全坏死率较高[17].此外,对于<2 cm的HCC,RFA消融次数、局部复发率明显低于MWA,且消融面积较大、OS较长,而异位复发率无显著差异[18].以上结果显示各研究间尚存争议,仍需深入探索两者间的疗效差异.
2.4 MWA与肝移植 患者在等待供体时,为延缓疾病进展,以免错失肝移植(liver transplantation,LT)机会,常行桥接治疗.比较RFA和MWA作为LT桥接手段的疗效,发现两组肿瘤完全坏死率分别为45%和53%,且RFA/MWA联合TACE,均可有效诱导HCC肿瘤坏死[19].在比较不同桥接方式的疗效中发现,MWA生存率与TACE、RFA无明显差异[20].此外,由于应用免疫抑制等因素,LT后常有肝内多发复发和肝外转移,已不适合行手术治疗.LT后复发患者行MWA治疗,其3、6、9、12、18、24 mo生存率分别为90.9%、81.8%、71.6%、51.5%、30.7%、15.3%,平均生存时间为17.3 mo,且近期并发症少、副作用轻、耐受性好,而远期疗效仍有待继续观察[21].
2.5 MWA联合经动脉化疗栓塞 对于晚期肝癌,经动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)联合PLA是其有效治疗方式之一.其中,TACE+RFA的疗效和OS均优于单用RFA,而TACE+MWA亦可显著提高疗效和OS,尤其在<3 cm肿瘤中可减少治疗次数,且随访期间未见复发及相关并发症[22].对35例HCC的41个<3 cm肿瘤行TACE+MWA序贯治疗,后经CT及活检证实,肿瘤完全坏死34个、不完全坏死7个,随访期间2例复发[23].在≤7 cm HCC治疗中,随机分为联合(TACERFA/TACE-MWA)和单一(RFA/MWA)治疗组,联合组疗效、RFS、OS均优于单一组[24].另外,TACE+MWA可延长>5 cm的HCC患者的OS,且无严重并发症[25].在不可切除的HCC中,TACE+MWA有明显缩瘤效应,生存率优于单用TACE[26],且MWA应至少在TACE的2 wk后进行.此外,对于大小不等HCC,TACE+MWA与TACE+RFA疗效相似[27].Li等[28]将3000例HCC分为TACE+MWA组和TACE组,发现联合治疗组的肿瘤完全坏死率和生存率均较高.研究证实,TACE中使用的碘油及明胶海绵可通过动脉-门脉瘘道、增强RFA或MWA诱导的凝固坏死,使消融面积扩大,并加强卫星结节完全性坏死,从而降低复发风险、延长生存[16].
3 MWA相关并发症
MWA死亡率≤0.36%,并发症发生率为2.4%-4.6%[29],可分为消融术中、术后及延迟发生类型,以下将讨论其发生机制及相应防治策略.
3.1 术中类型 主要为疼痛、迷走兴奋、肿瘤破裂等.MWA常用局部麻醉,对于肿瘤较大、临近肝包膜、消融时间较长者疼痛较为明显,可引起身体不经意活动、伤及临近组织,偶有消融被迫停止、影响疗效,甚至可诱发胆心反射.术前镇静镇痛处理、术中心电监护,可有效降低其发生率.发生迷走兴奋者可予以阿托品类药物,缓解症状.外生型肝肿瘤易破裂,可能为消融灶内压力过高所致,故消融过程应逐渐增加输出功率,且需谨慎监测针尖位置[30].
3.2 术后类型 主要包括消融后综合征、胸部合并症、肝脓肿、毗邻组织损伤、门脉或肝静脉栓塞、大出血和皮肤烧伤.消融后综合征发生率约30%-60%,常见于术后3 d内,呈低热、畏寒、乏力、疼痛、恶心、呕吐等,可能与肿瘤坏死、吸收有关[31].胸部合并症发生率约1.8%,包括胸腔积液、积血,气胸、脓胸,肺栓塞等,多见肿瘤位居隔顶者,常伴膈肌损伤,采用人工胸水策略可有效降低其发生率[32].肝脓肿发生率约1.7%,为较严重并发症,常为消融灶或软组织感染所致,严重者可诱发脓毒症、脓毒症休克、多器官功能障碍综合征,甚至死亡.术中严格遵守无菌操作,高危患者预防性使用抗菌药,一旦发生加强抗感染、早期穿刺充分引流,甚至持续冲洗,多可治愈[33].肝毗邻组织损伤常见于胆囊、胃肠道、膈肌等,消融边界距肝表面<1 cm时易发生.胆囊损伤可引起胆囊壁增厚、反应性胆囊炎等,胆囊穿孔因胆汁散热效应而较为少见.肠穿孔发生率约0.1%-0.3%,其症状往往数天后才出现,可能与肠壁热损伤、周围炎症抑制穿孔相关表现有关,采取人工腹水及胃肠道排空可减少其发生[34].膈肌热损伤多见肿瘤位居膈顶者,常伴胸部合并症.同理,人工胸水或腹水可降低其发生率.消融伤及肾上腺可致儿茶酚胺分泌过多、引发Takotsubo综合征,故消融边缘距肾上腺≥1 cm为宜.门脉或肝静脉栓塞发生率约1.1%,门脉易形成血栓,肝静脉次之,与血管直径、腔内流速、消融方式、管壁机械性损有关.此外,血栓脱落可致肺栓塞[35].大出血发生率约0.1%-0.4%,常见于肿瘤临近血管、凝血功能障碍、包膜下肿瘤破裂者.对于顽固性或动脉出血者,常需行动脉栓塞,甚至手术处理[36].PLA相关皮肤灼伤发生率约0.1%-3.2%,基于MWA采用内部冷却探针,安全性较高,皮肤灼伤较为少见[37].此外,PLA相关坏死物可致肾功不全患者发生急性肾衰.上述多数并发症呈自限性,积极非手术处理后可恢复.操作过程选择安全进针路径、合适温度,实时监测穿刺过程,术中术后严密监测生命体征,可有效减少甚至避免其发生.
3.3 延迟发生类型 主要为胆道损伤、瘘管形成、肿瘤播散及快速增殖等.其中,胆道损伤发生率约1%-12%,常引起胆瘘、胆汁瘤、胆管狭窄,并继发胆道感染.部分患者无需特殊治疗,而胆管炎反复发作者则需行胆道引流[38].此外,还有肠管-胸腔瘘、胆道-心包瘘等.病理表现为胆道积脓、积气,一旦发生加强抗感染、充分引流,部分严重者需手术处理.操作过程选择安全路径、规范操作,可有效减少其发生.肿瘤播散发生率约0.6%,以针道种植转移为主,应减少穿刺次数、消融针道10-20 s、避免直接穿刺外生肿瘤[39].PLA相关性肿瘤快速增殖发生率为0.1%-2.9%,可能与缺氧诱导因子-1α、血管内皮生长因子、血小板源性生长因子、成纤维细胞生长因子等促进残余瘤细胞快速增殖有关,也可能为PLA后瘤内高压促使瘤细胞扩散至门脉所致.此外,与针道播散亦存一定相关性[40].因此,消融应保证瘤组织完全坏死,并预留足够安全边缘.
4 新一代MWA系统
4.1 新一代MWA原理 起初,MWA用于肝切除术中的辅助止血,后在肝肿瘤治疗中获得快速发展.它利用电磁波产生快速振荡电磁场,使水分子运动、摩擦产热,可在探针周围产生2 cm加热区,引起肿瘤组织凝固坏死.其频率有915 MHz和2450 MHz,后者为目前最常用类型[13].目前,临床上所使用的MWA系统对消融区大小和形状缺乏可预测性,导致无法取得预期疗效.新一代MWA系统(Emprint™ Ablation System with Thermosphere™Technology,Microwave thermosphere ablation,MTA)是同一制造商研发的MWA改进版,常用频率为2450 MHz,由100 W发电机、高效可重复使用的电缆线和消融泵组成.其中,消融过程消融泵对探针进行冷却.MTA克服了MWA磁场为椭圆形的局限性(图1),通过场控制、热控制、波长控制,可获得较大、精确及可预测的球形消融区[41].场控可调节电子在探针中的运动,产生预期的场形状,且不受组织环境改变的影响.通常,探针和同轴电缆过度加热可导致非靶区热损伤,而热控采用无菌盐水滴注、产生内部冷却,以确保消融区不受干燥组织影响.此外,肿瘤组织消融加热过程,其介电常数相继变化,使电磁波波长发生改变,最后导致场形状改变.波长控制是通过无菌生理盐水循环于探针轴,产生以下效应:使该介电常数变化最小、维持较短恒定波长、保持探针所需电子运动模式,利于场控,从而维持较恒定的环境.与MWA相比,相同功率及时间下,MTA在离体牛肝中,可产生大小相当、形态规则、更接近球形的消融灶,且受热沉效应的影响更小[42].
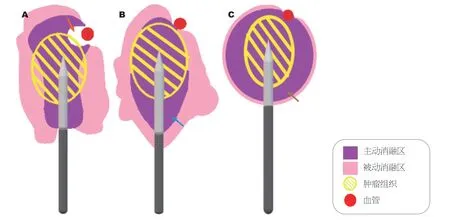
图1 射频消融、微波消融及新一代微波消融的消融区形状.A:箭头所示为射频消融因热沉效应致消融区扭曲,导致消融不彻底;B:箭头所示为传统微波消融虽不受邻近组织影响,但其消融区为椭圆形且不可控;C:箭头所示为新一代微波消融可形成一球形消融区,且其被动消融区与主动消融区基本一致.
4.2 MTA在肝癌中的治疗 Zaidi等[43]对53例肝肿瘤行Lap-MTA,结果显示并发症发生率约11.3%,无死亡;肿瘤完全消融率99.3%,不全消融灶1个(0.7%);中位随访4.5 mo,观察到局部复发灶1个(0.7%).另外,在腔镜或开腹MTA治疗的100例肝肿瘤(共301个肝肿物;HCC 10例,共21个肝肿物)患者中,排除19例联合肝切和8例联合肠癌切除,其90 d并发症发生率7% (5/73),包括急性肾损伤、慢性阻塞性肺疾病加重、颈内静脉血栓形成伴肺栓塞、肠系膜上静脉及门脉血栓形成、术后肺炎各1例,其中1例与消融无关;中位随访16 mo,病灶、患者局部复发率分别为6.6% (20/301)、15% (15/100),均属肝转移瘤,而HCC未观察到局部复发[44].此外,在HCC的有关研究中,44例52个病灶行MTA,55例70个病灶行RFA,发现两组肿瘤完全坏死率无显著差异,治疗后随访1年,局部复发率无统计学差异(MTA/RFA:6.91%/5.17%;HR=0.82;log rank=0.8036),均无针道种植转移.其并发症发生率亦无显著差异(MTA/RFA:13.6%/14.5%),其中MTA组包括肝梗死1例、出血3例和胆汁瘤2例,RFA组包括肝梗死2例、出血3例、皮肤灼伤1例、迷走神经反射1例和胆汁瘤1例[45].还有,比较MTA和RFA在肠癌肝转移治疗中情况,发现两者局部复发率依次为10%、20% (P=0.020);90 d并发症发生率相似(MTA/RFA:10%/8%;P=0.848),均无死亡[46].上述研究多因素分析提示,肿瘤>3 cm、消融方式、消融边缘、肿瘤类型均为局部复发的独立预测因子,皆证实MTA安全、可行,且其近期局部复发率较低.
4.3 MTA的优势与缺陷 MTA具有较高的瘤内温度及热效率,且可在远离针头处形成消融区,对于肿瘤位于大血管之间及存在肝周粘连者,针头不需100%插入肿瘤中央[43].同时,MTA亦存在某些缺陷,如消融区迅速扩大易导致邻近组织意外消融、玻璃纤维针头无法承受明显扭曲等[43].与其它PLA技术(包括MWA)比较,MTA似乎为较大HCC及肝转移瘤(包括复发类型)的潜在有效治疗手段,如联合TACE,效果更佳.然而,MTA替代手术、RFA、TACE等其它方式的可行性,尚需大规模RCT研究提供证据.
总之,在MWA治疗部分肝癌的研究中,已证实其有效性及安全性;可与肝切、RFA相媲美,甚至略显更优;与TACE序贯联合,有助于提高疗效;还可作为肝移植的桥接手段之一.近年,新一代MWA(即MTA)开始逐步应用于肝癌的治疗,尤其肝转移瘤领域.初步结果显示,MTA一定程度上能克服既往MWA在消融靶区大小及形状等不可预测的局限性.然而,MTA尚未广泛应用于临床,其使用经验较少,处理策略亦不成熟.此外,MTA也存在消融靶区迅速扩大而致邻近组织意外消融等共性问题.因此,MTA与MWA、RFA等的优劣比较,尚有待广泛开展、深入探索.
