Graves病患者外周血T细胞亚群与甲状腺功能及甲状腺自身抗体间的相关性分析
2020-06-11马金刚魏红丽尚恒
马金刚 魏红丽 尚恒
沧州市人民医院体检中心 061000
Graves病是临床中常见的自身免疫性甲状腺疾病,在遗传、环境、感染等因素的影响下,甲状腺内自身免疫发生紊乱,导致抑制性T细胞功能降低,辅助性T细胞(Th)不适当致敏,刺激B细胞产生促甲状腺激素受体抗体(TRAb),从而导致甲状腺功能亢进症的发生。因此,细胞免疫功能异常在Graves病的发病机制中发挥了重要的作用[1]。
CD4+T细胞可分化为Th1、Th2、Th17、调节性T淋巴细胞(CD4+CD25+Foxp3+Treg,Treg细胞)等细胞亚群。Th1主要分泌肿瘤坏死因子、干扰素-γ等,介导细胞免疫;Th2主要分泌白细胞介素(IL)-4等,介导体液免疫;Treg细胞主要分泌IL-10、转化生长因子-β(TGF-β)等,发挥免疫调节功能[2]。Th17是2005年首先被报道的一种新亚型,主要分泌IL-17A,在炎性反应早期阶段发挥促炎作用[3]。研究表明,Th各亚群之间的免疫失衡对Graves病的发生和发展有重要作用。Phenekos等[4]发现,在Graves病患者的外周血中存在Th1/Th2的免疫失衡,并向Th2方向偏移。而Th17和Treg细胞也参与了Graves病的发生与发展[5]。Th17和Treg细胞之间的动态平衡被破坏,自身免疫抑制功能下降可能是Graves病的发病原因[6]。
目前的研究多集中于Graves病患者外周血中Th1/Th2或者Th17/Treg细胞单一方面细胞免疫功能的变化,而关于Graves病患者外周血中Th1、Th2、Th17、Treg细胞之间的相关性以及各T细胞亚群与甲状腺功能及甲状腺自身抗体之间相关性的研究很少。本研究拟分析Graves病患者外周血中T细胞亚群之间的相关性以及T细胞亚群与甲状腺功能及甲状腺自身抗体之间的相关性,为Graves病的发生与发展提供新的研究思路。
1 对象与方法
1.1 研究对象及分组 选取2017年12月—2018年6月于沧州市人民医院内分泌科门诊或住院初发未经治疗的Graves病患者65例(GD组)。其中男性18例,女性47例,年龄(30.28±6.53)岁,病程(7.62±2.93)个月;选取同期我院健康体检者50名作为对照组,其中男性20名,女性30名,年龄(32.51±6.84)岁。两组的性别、年龄等一般情况差异无统计学意义。研究项目经沧州市人民医院伦理委员会批准。所有受试者均签署知情同意书。
1.2 诊断及排除标准 Graves病的诊断依据中华医学会内分泌学分会2008 年颁布的《中国甲状腺疾病诊治指南》。排除标准:治疗前存在白细胞减少、肝功能损害的患者;其他自身免疫性疾病以及近期使用免疫抑制剂或者皮质类固醇者;亚临床甲状腺功能亢进症、妊娠、近期感染、各种恶性肿瘤、肾功能衰竭患者。
1.3 标本采集及相关指标检测
1.3.1 标本采集 所有初发Graves病患者均空腹抽取静脉血,健康体检者于体检时抽取静脉血。甲状腺功能指标包括:FT3、FT4、促甲状腺激素(TSH),检测方法为电化学发光法,设备为罗氏e601,采用配套试剂盒;甲状腺自身抗体包括:甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb)、TRAb,检测方法为免疫化学发光法,设备为美国Beckman coulter分析仪,采用配套试剂盒。
1.3.2 流式细胞仪检测Th1、Th2、Th17、Treg细胞 肝素抗凝静脉血5 ml,行Ficoll密度梯度离心法分离外周血单个核细胞(PBMC),调整细胞密度为1×106/ml,悬浮于RPMI 1640培养液中。将PBMC悬液置于24孔培养板内,每孔加入佛波酯(美国Alexis公司)25 μg/L,伊诺霉素(美国Alexis公司)1 mg/L后,在37℃孵育箱中培养4 h,并收集细胞,加入PE-抗人CD4单克隆抗体进行细胞表面染色(所有流式抗体均购自美国eBioscience公司),分别加入FITC抗干扰素-γ、PE-抗IL-4、抗人CD25-APC、PE-抗人Foxp3单克隆抗体、PE-抗人IL-17A单克隆抗体和对照抗体进行细胞内因子染色,采用流式细胞仪检测分析。用Cell Quest软件获取分析数据,以CD4+干扰素-γ+/CD4+T表示Th1占CD4+T细胞的比例,CD4+IL-4+/CD4+T表示Th2占CD4+T细胞的比例,以CD4+CD25+Foxp3+/CD4+T表示Treg细胞占CD4+T细胞的比例。CD4+IL-17A+/CD4+T表示Th17占CD4+T细胞的比例。用CellQuest软件获取分析数据。
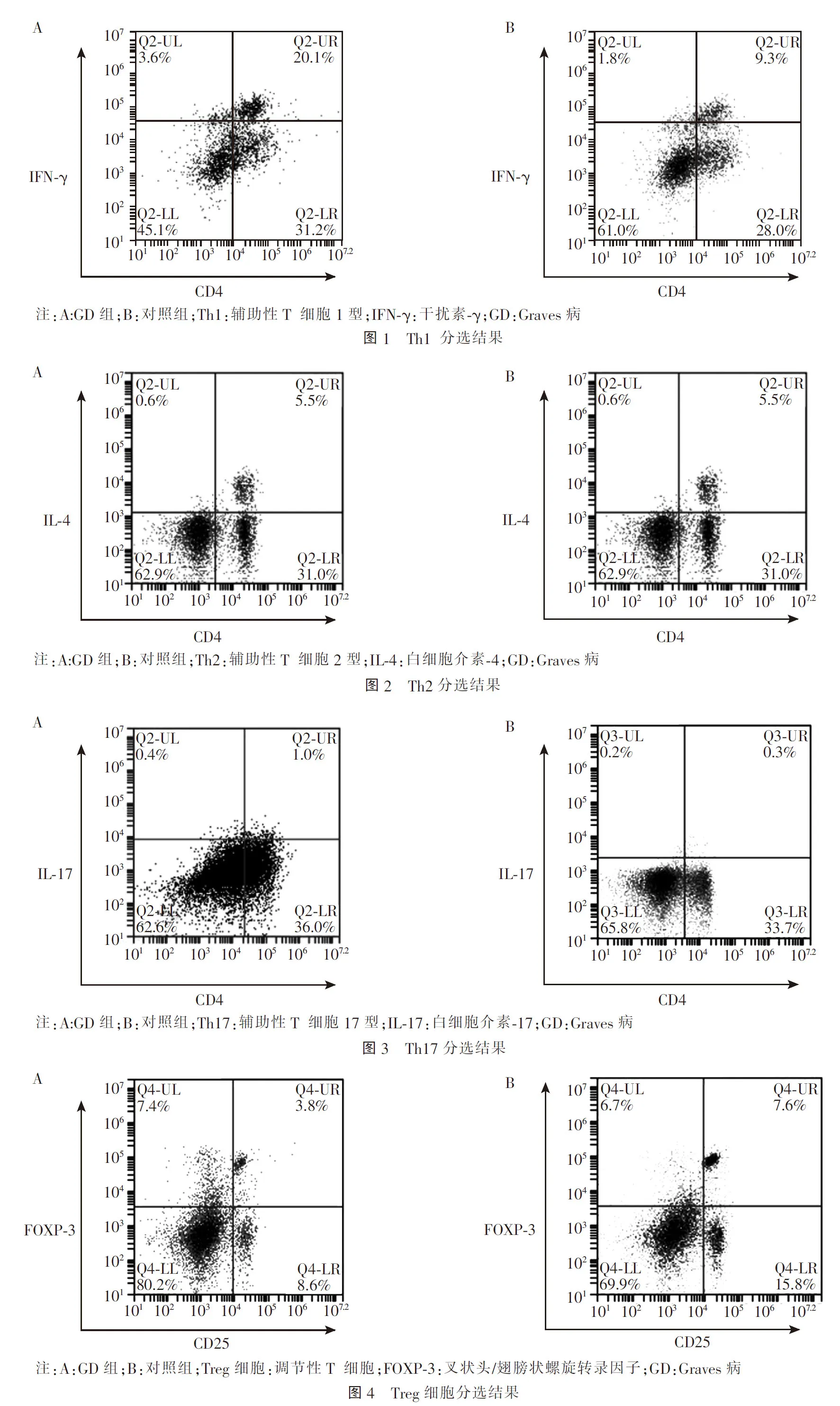
2 结果
2.1 两组一般资料及甲状腺功能、甲状腺自身抗体水平的比较 GD组年龄、性别构成与对照组的差异均无统计学意义(P均>0.05)。与对照组相比,GD组FT3、FT4、TGAb、TPOAb和TRAb水平均显著升高(P均<0.01),TSH水平降低(P<0.01),见表1。
2.2 两组外周血中Th1、Th2、Th17 和Treg细胞的流式细胞分选结果 GD组中Th1、Th2、Th17在CD4+T细胞中的比例较对照组升高,GD组中Treg细
胞在CD4+T细胞中的比例较对照组降低,见图1~4。
2.3 两组外周血中Th1、Th2、Th17、Treg细胞比例的比较 与对照组相比,GD组Th1、Th2、Th17在CD4+T细胞中的比例、Th1/Th2比值、Th17/Treg细胞比值均升高(P均<0.01),Treg细胞在CD4+T细胞中的比例降低(P<0.01),见表2。
2.4 两组外周血中Th1、Th2、Th17、Treg细胞比例之间的相关性分析 相关性分析显示,GD组Th1占CD4+T细胞的比例与Th17占CD4+T细胞的比例呈正相关(P=0.005),其余T细胞亚群之间未发现显著相关性,见表3、4。
2.5 GD组Th1、Th2、Th17、Treg细胞百分比分别与FT3、FT4、TGAb、TPOAb、TRAb的相关性分析 GD组Th1占CD4+T细胞的比例与FT4、TPOAb水平呈正相关(P均<0.05)。Th2占CD4+T细胞的比例与TRAb水平呈正相关(P=0.002),Th17占CD4+T细胞的比例与FT4、TPOAb水平呈正相关(P均<0.05)。Treg细胞占CD4+T细胞的比例与FT3、FT4、TGAb、TPOAb、TRAb之间未发现显著相关性,见表5。
3 讨论
Graves病是临床中常见的器官特异性自身免疫性疾病,Th1/Th2、Th17/Treg细胞免疫失衡在Graves病的发病机制中发挥着重要作用[7-8]。由于TRAb的刺激性作用导致了Graves病的发病,多数研究认为Graves病以体液免疫为主,Th2在Graves病发病机制中起主要作用。而本研究显示,GD组Th1、Th2占T细胞比例、Th1/Th2比值显著高于对照组,提示Th1/Th2免疫失衡可能向Th1漂移。其原因可能是因为入组病例均为初发的Graves病患者,多数患者处于疾病发展的早期阶段,提示Th1在Graves病的发病早期发挥了重要作用。Bossowski等[9]认为,Graves病发病机制中以Treg细胞的免疫抑制功能降低为主,而本研究发现GD组Treg细胞占CD4+T细胞的比例较对照组明显下降,而Th17占CD4+T细胞的比例较对照组明显升高,提示抑制性T细胞功能缺陷以及Th不适当的致敏均可能参与了Graves病的发病。

表1 对照组和GD组一般资料及血常规、甲状腺功能、甲状腺自身抗体水平的比较
注:GD组:Graves病组;TSH:促甲状腺激素;TGAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;TRAb:促甲状腺激素受体抗体


组别例数Th1(%)Th2(%)Th1/Th2比值Th17(%)Treg细胞(%)Th17/Treg细胞比值对照组5021.25±6.8911.47±4.012.09±1.021.44±0.327.40±2.710.23±0.11GD组6540.70±7.6615.69±5.402.94±1.203.10±0.603.29±1.021.06±0.45t值14.104.634.0217.71-11.2512.74P值0.000.000.000.000.000.00
注:GD组:Graves病组;Th:辅助性T细胞;Treg细胞:调节性T细胞

表3 对照组外周血中Th1、Th2、Th17和Treg细胞比例之间的相关性分析
注:Th:辅助性T细胞;Treg细胞:调节性T细胞

表4 GD组外周血中Th1、Th2、Th17和Treg细胞比例之间的相关性分析
注:Th:辅助性T细胞;Treg细胞:调节性T细胞

表5 GD组各指标间相关性分析
注:Th:辅助性T细胞;Treg细胞:调节性T细胞;TSH:促甲状腺激素;TGAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;TRAb:促甲状腺激素受体抗体
Th1、Th2、Th17、Treg细胞比例之间的相关性分析显示,Th1占CD4+T细胞的比例与Th17占CD4+T细胞的比例呈正相关,而其余各T细胞亚群之间未发现显著相关性。一方面,Th1分泌的干扰素-γ能增加Graves病患者甲状腺组织主要组织相容性复合物Ⅱ类抗原表达,摧毁甲状腺自身免疫耐受,而由Th1所分泌的肿瘤坏死因子-α可直接造成甲状腺滤泡细胞的破坏,二者共同介导促炎反应,使疾病处于活动期[10]。另一方面,Th17具有很强的致炎功能,其分泌的细胞因子可引起炎性细胞对甲状腺组织的浸润以及对甲状腺滤泡细胞的破坏,Th17与炎性反应的活动度以及疾病的严重程度相关[11]。因此,Th1和Th17可能均参与了Graves病患者甲状腺滤泡细胞的炎性反应。而GD组Treg细胞比例下降,其免疫抑制功能降低,可能导致Th1、Th17不适当的致敏,激活体液免疫系统,使Th2产生TRAb,从而促进Graves病的发生,但Th1与Th17所分泌细胞因子之间的相互作用有待进一步研究。
Graves病患者外周血T细胞亚群比例与甲状腺功能及甲状腺自身抗体之间的相关性分析显示,Th2占CD4+T细胞的比例与TRAb水平呈正相关,这可能与Th2介导体液免疫,产生TRAb有关。而Th1、Th17占CD4+T细胞的比例与FT4、TPOAb水平呈正相关。TPOAb是具有破坏性的抗体,通过补体发挥细胞毒性作用,从而破坏甲状腺滤泡细胞,其血液浓度与甲状腺内活动性炎性反应关系密切,而TGAb、TRAb不具有破坏性作用[12]。因此,FT4、TPOAb水平可以反映Graves病患者甲状腺滤泡细胞功能及炎性反应,而促炎反应是Th1、Th17参与Graves病发病的病理机制。综上所述,Th1、Th17介导的促炎反应参与了甲状腺功能亢进症及免疫炎性反应的发生。
因此,及时纠正Graves病患者的细胞免疫紊乱,降低Th1、Th17促炎反应水平,能够提高甲状腺功能亢进症治疗的时效性,从而为Graves病发病机制的研究和治疗靶点的选择提供理论基础。
