河南豫北地区196例成人急性髓系白血病临床病理特征分析
2020-06-11李敬东字友梅高攀科韩效林
杨 翠,李敬东,字友梅,高攀科,韩效林
(新乡医学院第一附属医院血液科,河南 卫辉 453100)
急性髓系白血病(acute myeloid leukemia,AML)是一种造血干/祖细胞的异质性恶性克隆性疾病,是血液系统最常见的恶性肿瘤。白血病的形成是一个复杂、多步骤的过程,基因组异常在AML的发生中发挥着至关重要的作用,这种异常包括染色体异位、基因突变等,其可形成具有肿瘤特征的融合基因参与AML的发生、发展、诊断及预后[1]。目前这种基因组学可用于AML的诊断、分型、疗效监测和预后评估等。因此,本研究通过回顾性分析,收集本院196例初诊原发AML患者的临床资料,细胞形态学、免疫组织化学,免疫分型,融合基因及5种常见基因突变[FMS样酪氨酸激酶3-内部串联重复(fms-like tyrosine kinase 3-internal tandem duplication, FLT3-ITD)、脱氧核糖核酸甲基转移酶3A(deoxyribonucleic acid methytransferase 3A, DNMT3A)、核仁磷酸蛋白1(nucleophosmin gene 1,NPM1)、CCAAT/增强结合蛋白A(CCAAT/enhancer binding protein A,CEBPA)、C-KIT基因突变],旨在探讨河南豫北地区AML患者的临床病理特征。
1 资料与方法
1.1 临床资料入组我院2013年1月至2018年12月收治的临床资料完整的初诊原发AML患者为研究对象,均经骨髓细胞形态学、免疫学、细胞遗传学、分子生物学等检查证实符合AML的诊断标准[2]。排除标准:排除骨髓增生异常综合征、骨髓增殖性肿瘤、慢性粒细胞白血病等转变的AML。共筛选出符合条件的患者196例,均为河南豫北地区户籍,入住我院前未接受任何抗白血病治疗。196例患者中,男109例、女87例,初诊年龄18~85岁,根据患者年龄分为老年组(≥60岁,75例)、青年组(<60岁,121例)。
1.2 主要试剂和仪器Trizol购自美国Gibcol-BRL公司,RPMI-1640培养基购自美国HyClone公司,胎牛血清购自北京赛奥吉诺生物科技有限公司,PTC-200聚合酶链反应(polymerase chain reaction, PCR)仪、371型二氧化碳细胞培养箱购自美国Thermo公司,CK40型倒置显微镜购自日本Olympus公司,FACS Calibur型流式细胞仪购自美国Beckman Coulter公司。
1.3 骨髓细胞形态学检查取患者骨髓液制作成涂片,干燥后进行瑞氏染色和组织化学染色,并于显微镜下观察细胞形态。
1.4 免疫学检查抽取患者骨髓液2 mL,经肝素抗凝后,制备成单个核细胞的细胞悬液,通过荧光标记的单克隆抗体和流式细胞仪检测分析白血病细胞的表面抗原,阳性细胞数以幼稚细胞抗原在细胞总数中的表达比例表示;阳性表达定义为细胞质在细胞总数中的表达百分比≥10%,细胞膜抗原表达百分比≥20%,比对抗原表达阳性率进行计算[3]。
1.5 融合基因检测抽取患者骨髓液2~3 mL,经乙二胺四乙酸二钾抗凝后,Trizol提取有核细胞RNA,通过多巢式PCR检测AML的43种融合基因,分别为:NUP98-HoxD13、NPM-ALK、TCF3-HLF、ETV6/PDGFRA、FLP1L1-RARa、STAT5b-RARa、BCR-ABL1、PML-RARa、AML1-ETO、NUP98-HoxC11、NUP98-HoxA13、NUP98-HoxA11、TEL-JAK2、CBFβ-MYH11、PLZF-RARa、FLP1L1-PDGFRA、DEK-CAN、AML1-MDS1/EV11、AML1-MTG16、E2A-PBX1、NPM-MLF、MLL-AF9、MLL-AF10、NUMA1-RARa、PRKAR1A-RARa、NUP98-PMX1、MLL-AFX、MLL-ENL、MLL-AF17、MLL-AF1p、MLL-AF1q、MLL-ELL、MTT-SEPT6、MLL-AF6、MLL-AF4、NPM-RARa、SIL-TAL1、SET-CAN、TEL-AML1、TEL-PDGFRB、TLS-ERG、TEL-ABL1、NUP98-HoxA9。
1.6 基因突变检测抽取患者骨髓液2~3 mL,经乙二胺四乙酸二钾抗凝后,送检郑州金域检验公司,通过一代或二代基因测序的方法检测DNMT3、FLT3-ITD、NPM1、CEBPA、C-KIT等5种常见AML突变基因。

2 结果
2.1 2组外周血指标及骨髓原始细胞比例的比较老年组患者外周血红细胞、血红蛋白及血小板水平均较青年组患者显著下降,差异均有统计学意义(P均<0.05);2组患者外周血白细胞和骨髓原始细胞比例比较差异均无统计学意义(P均>005)。见表1。
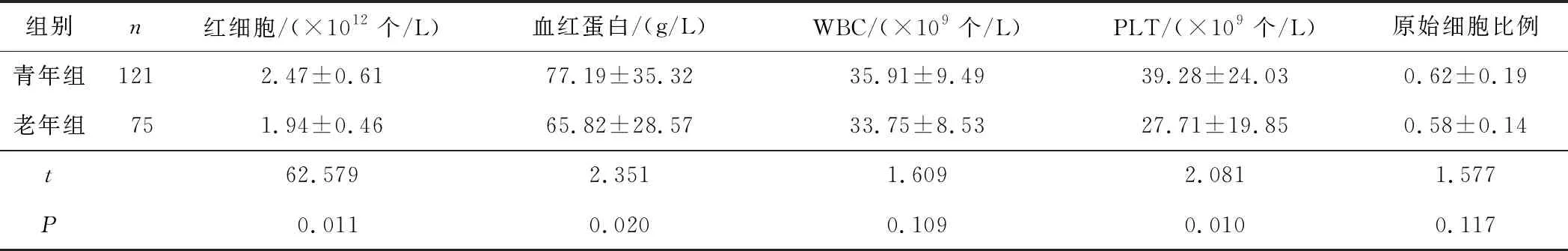
表1 2组外周血指标及骨髓原始细胞比例的比较
2.2 2组免疫分型结果比较FAB分型显示:老年组患者以M2型为主,青年组患者以M3型为主,差异均有统计学意义(P均<0.05)。见表2。

表2 2组免疫分型结果比较 n(%)
2.3 2组融合基因分析结果比较196例患者中共有72例检测出融合基因,检出率为36.7%,未检测到携带≥2种融合基因者,检出的融合基因分别为AML1-ETO、PML-RARa、CBFβ-MYH11、BCR-ABL1、MLL-AF9、NUP98-HoxA9。2组患者各种融合基因检测结果比较差异均无统计学意义(P均>0.05)。见表3。
2.4 2组基因突变分析结果比较196例患者5种基因突变总检出率为37.2%。老年组患者DNMT3A突变发生率高于青年组患者,差异有统计学意义(P<0.05);2组患者FLT3-ITD、NPM1、CEBPA、C-KIT突变率比较差异均无统计学意义(P均>0.05)。见表4。
2.5 2组基因突变数目分析结果比较老年组患者发生2种及以上基因突变的比例高于青年组患者,差异有统计学意义(P<0.05)。2组患者发生1种基因突变的比例比较差异无统计学意义(P>0.05)。见表5。
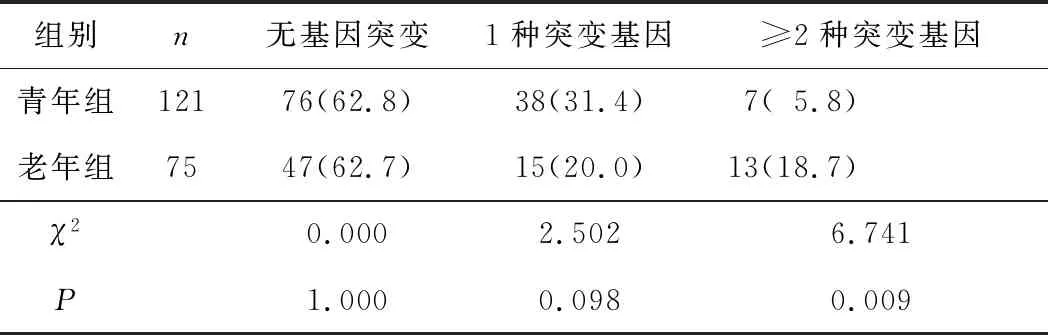
表5 2组基因突变数目分析结果比较 n(%)
3 讨论
AML是血液系统高发的恶性肿瘤之一,AML的发病中位年龄大于60岁,且随着年龄的增长,治疗效果逐渐下降。随着中国老龄化社会的到来,AML的发病率逐渐增加,同时老年AML亦会逐年增加[4]。老年AML国际标准定义为≥60岁,因此本文根据患者年龄分为老年组(≥60岁)和青年组(<60岁)。
AML的诊断方式,自20世纪以来已经从依靠形态学、组织化学这种单一的诊断模式,发展为形态学、免疫学、细胞遗传学和分子生物学等多种诊断技术的精准诊断。诊断技术的发展使得人们对AML的肿瘤细胞生物学特性更加了解,从而衍生出不同的靶向治疗。靶向药物的治疗可提高AML的治疗效果,但因为体质差、并发症多、化疗耐受性差、具有独特的不良反应等众多因素的影响[5],使得老年AML患者从靶向药物的治疗中获益低于年轻患者。综合来说,即为肿瘤的生物学特性、治疗的耐受性和老年的病理生理特征影响了其治疗效果。已有学者[6]报道不同年龄AML患者具有不同的分子生物学特性,且AML患者的分子生物学特征不同的研究小组报道存在地域差异。因此本文根据河南豫北地区的经济情况、机体生理状态等,分析豫北地区≥60岁和<60岁的AML患者的一般特征及常见的生物学特性,希望总结本地区的AML不同年龄组患者的疾病特征,为今后AML患者的治疗提供参考。本研究结果显示:老年组AML患者红细胞减少、血红蛋白下降和血小板减少的发生率均高于青年组,而2组患者白细胞计数和骨髓原始细胞比例相近。从FAB分型方面分析,老年AML以M2型高发,青年AML以M3型高发。
目前已有多种分子生物学标记用于疾病的诊断、分型及预后的评估。2016版WHO的AML诊断分型强调了遗传学信息异常在急性白血病诊断中的价值,部分伴重现性遗传学异常AML成为了独立的分类。这种细胞遗传学的改变与形态学特征的关系尚不明确,少数异常基因在特定的AML中检出率较高,可以用于诊断某些特殊类型的AML。PML-RARAα融合基因由t(15;17)(q22;q21)染色体易位形成,主要见于AML-M3,阳性率超过80%。AML1-ETO融合基因t(8;21)(q22;q22)染色体易位形成,其阳性多见于AML-M2,刘恒[7]报道其阳性率为17.4%,高于国外学者的研究,但其在M2b型的阳性率高达90%,因此其是M2b分型诊断重要的分子标志。还有一部分融合基因在多种疾病中可以检测到,在AML中检出率较低,但多与AML的预后密切相关,提示预后欠佳,如BCR-ABL1融合基因由t(9;22)(q34;q11)染色体易位形成,多见于急性淋巴细胞白血病,少数可见于AML[8];NUP98-HoxA9融合基因是由t(7;11)(p15; p15)染色体易位形成,Hox基因可促进髓系的增殖,目前认为与AML形成密切相关[9];MLL-AF9融合基因是t( 9; 11) ( p22; q23)易位形成,是MLL融合基因最常见的一种易位形成,多见于AML-M4、AML-M5[10]。本文研究了AML常见的43种融合基因,总体检出率为36.7%,比国内王钰等[11]报道的检出率35.9% 略高;检出的融合基因分别为AML1-ETO、PML-RARa、CBFβ-MYH11、BCR-ABL1、MLL-AF9、NUP98-HoxA9,2个年龄段患者6种融合基因的检出率相近。
新一代测序技术为AML个体化诊断和治疗开辟了新的视野[12]。在过去的5~10 a中,新一代测序技术已被广泛引入专业的血液学实验室。在AML患者中已检测到越来越多的基因突变,这些突变可作为潜在的标志物,可发展为AML的预后参数、靶向治疗的选择依据,并帮助我们探索新的潜在治疗途径或耐药机制。Yu等[13]报道了老年和年轻AML患者新一代测序技术分析,结果发现,老年患者的诊断时分子基因突变的频率显着高于年轻患者;老年患者RUNX1、TP53、IDH2、SF3B1和ASXL1基因突变的频率明显更高;对比分析老年患者和年轻患者AML基因突变类别发现,老年AML患者的DNA甲基化相关基因突变发生率更高,可达87.7%;但在年轻的AML患者中,转录失调与激活的信号相关基因突变之间似乎没有差异。国内外同样有相关报道证实老年AML患者以DNMT3A基因突变高发,而中青年患者以FLT3-ITD基因突变多发[14]。DNMT3A属于DNA甲基转移酶家族,承担了DNA的甲基化修饰工作,是造血干细胞分化的必需物,其通过影响造血干细胞的某些调节基因的转录来发挥作用。在AML中DNMT3A基因突变发生率为14%~34%[14],且DNMT3A基因突变易伴发其他突变,如在AML中DNMT3A基因突变容易诱发FLT3-ITD基因突变发生,发生这种双突变的AML患者诱导缓解率较低,复发率和死亡率高[15]。DNMT3A基因突变在AML患者中的意义未明,部分学者认为DNMT3A基因突变提示AML预后差。王丽娟[16]报道了AML患者中DNMT3A基因突变发生率为9.76%,且认为DNMT3A基因突变为复发的独立危险因素;DNMT3A基因突变可能会改变某些白血病亚型的独特基因表达谱。本文根据豫北地区患者的经济能力,行5种常见AML基因突变测序分析,196例患者检出率为37.2%,稍高于国内学者的报道;老年患者DNMT3A基因突变发生率高于青年患者,与国内学者报道相似;且老年患者更易发生2种及以上的基因突变,这也是老年AML患者预后差的主要原因之一。
总之,河南豫北地区老年和青年初诊AML患者临床病理特征存在一定差异;与青年组比较,老年组患者外周血红细胞、血红蛋白、血小板水平较低,DNMT3A突变率较高,且易出现多基因突变。本文通过对豫北地区AML患者的特征分析,为今后本地区AML患者的治疗提供一定的参考。
