羟苯磺酸钙对动脉粥样硬化斑块形成的影响及其机制
2020-06-11王莹李彩朱峰金笑平
王莹,李彩,朱峰,金笑平
(台州医院神经内科,浙江台州317000)
动脉粥样硬化(atherosclerosis,AS)是多数心脑血管疾病的共同病理基础,主要表现为动脉壁内大量脂质和纤维组织蓄积并伴有局部炎性反应,严重威胁患者的心身健康[1]。AS早期即表现为内皮功能障碍,调节内皮功能可有效防治AS导致的心脑血管疾病。羟苯磺酸钙作为一种血管保护剂,可以改善局部血液循环,已广泛应用于治疗糖尿病相关并发症和肾功能不全相关疾病,而其对AS斑块形成影响的研究较少[2]。本研究旨在以液氮冻伤术建立兔AS斑块模型,并给予羟苯磺酸钙干预,以探讨羟苯磺酸钙对AS斑块形成的影响及其可能机制。
1 材料和方法
1.1 材料 SPF级健康雄性新西兰兔24只,兔龄为3~4个月,体质量1.9~2.2kg,购自温州医科大学实验动物中心[动物许可证号:SCXK(浙)2015-0001]。羟苯磺酸钙由西安利君制药有限责任公司生产,批号0706057。内皮素-1(endothelin-1,ET-1)、一氧化氮(nitricox-ide,NO)和血管内皮生长因子(vascularendothe-lialgrowthfactor,VEGF)ELISA试剂盒购自南京建成生物工程研究所,基质金属蛋白酶9(matrixmetalloproteinase-9,MMP-9)和纤溶酶原激活物抑制剂-1(plasminogenactivatorinhibitor-1,PAI-1)及SP超敏试剂盒购自上海天呈科技有限公司。
1.2 方法
1.2.1 兔AS斑块模型的建立:所有动物适应性喂养3d,以液氮冻伤术建立AS斑块模型,模型的制作参照FANG等[3]的方法,即以3%戊巴比妥钠(30mg/kg)进行全身麻醉,分离右颈总动脉,血管两端以动脉夹阻断血流,以0.9%氯化钠溶液冲洗后抽空血管腔,再以1mL注射器抽取液氮,快速注入血管腔,反复3次以造成血管内皮损伤。放开动脉夹恢复血流,缝合肌肉组织及皮肤,常规使用抗生素预防感染。实验程序遵循动物保护和应用条例。
1.2.2 分组与处理:造模后将兔随机分为治疗组和模型组,每组各12只。治疗组于造模当天开始给予羟苯磺酸钙(0.15mg/g/d)+高脂饲料(含1%胆固醇、3%大油、15%蛋黄和81%普通饲料)喂养,模型组仅给予高脂饲料喂养,连续8周。
1.3 检测指标
1.3.1 组织病理学检查:8周后处死兔,取出右颈总动脉2~3cm,一部分以4%多聚甲醛固定24h,常规脱水,石蜡包埋,制备4μm厚连续石蜡切片,作HE染色和弹力纤维染色,光镜观察AS斑块病理形态;另一部分以3%戊二醛溶液固定,超薄组织切片,醋酸铀及枸橼酸铅双染色,JEM-1230透射电镜观察AS斑块病理形态。
1.3.2 免疫组织化学染色:取上述右颈总动脉石蜡切片,采用SP法测定斑块中MMP-9和PAI-1蛋白表达,DAB显色,棕黄色颗粒状产物为阳性标记。具体步骤参照试剂盒说明书进行。采用LeicaQWINV3图像分析系统对免疫组织化学结果进行分析,每张玻片标本均随机选取8个视野,以平均灰度值表示检测的右颈总动脉各层染色阳性面积。
1.3.3 ELISA检测:治疗前及治疗8周后分别抽取各组兔耳缘静脉血2mL,离心分离血清,ELISA法检测血清ET-1、NO及VEGF含量。具体操作步骤严格按照试剂盒说明书进行。
1.4 统计学处理方法 采用SPSS20.0统计软件进行数据处理。计量资料以表示,组间比较采用两样本t 检验,组内比较采用配对t 检验。P <0.05为差异有统计学意义。
2 结果
2.1 病理形态学检测结果
2.1.1 HE染色:治疗组右颈总动脉可见内膜、中膜增厚,平滑肌增殖并向内膜迁移,血管腔内可见一层不规则的较薄斑块,内含泡沫细胞和炎性细胞(见图1A)。模型组右颈总动脉内膜、中膜增厚明显,血管腔内可见半球形脂质斑块显著隆起,斑块表面有纤维组织覆盖,形成典型的“纤维帽”,内含大量泡沫细胞及炎性细胞浸润(见图1B)。

图1 治疗8周后兔右颈总动脉斑块形成情况(HE染色,×200)
2.1.2 弹力纤维染色:治疗组右颈总动脉弹力纤维和胶原纤维形态不规则,排列稍紊乱,胶原纤维增多,蓝黑色的内弹力板以内可见较薄脂质斑块(见图2A)。模型组右颈总动脉弹力纤维和胶原纤维排列紊乱,蓝黑色的内弹力板以内有断裂现象,可见突向血管腔的较大脂质斑块(见图2B)。
2.1.3 透射电镜:治疗组右颈总动脉中层平滑肌细胞梭形,排列稍紊乱,间质增宽,结缔组织增生,胞质内见微丝及密体密斑,内膜及中膜可见少量脂滴(见图3A)。模型组右颈总动脉内膜呈斑块状增生,细胞结构不清,内弹力膜增厚变性,中层平滑肌细胞排列紊乱,间质增宽,中膜结缔组织增生,内膜及中膜可见大量脂滴,高度空泡变性(见图3B)。

图2 治疗8周后兔右颈总动脉内膜病变情况(弹力纤维染色,×200)

图3 治疗8周后兔右颈总动脉斑块处透射电镜表现
2.2 免疫组织化学检测结果 8周后,抗MMP-9、PAI-1染色发现,MMP-9、PAI-1阳性染色为棕褐色,治疗组可见右颈动脉斑块处MMP-9、PAI-1呈散在弱阳性表达,而其在模型组则表达明显增高,呈强阳性表达。治疗组MMP-9、PAI-1在上述部位的表达量较模型组明显减少(P均<0.05)。见图4-5和表1。

图4 治疗8周后兔右颈总动脉斑块处MMP-9表达情况(DAB染色,×200)

图5 治疗8周后兔右颈总动脉斑块处PAI-1表达情况(DAB染色,×200)
表1 2组兔右颈总动脉MMP-9和PAI-1免疫组织化学灰度值比较(每组n=12

表1 2组兔右颈总动脉MMP-9和PAI-1免疫组织化学灰度值比较(每组n=12
与模型组比:aP <0.05
组别 MMP-9 PAI-1模型组 136.97±7.81 145.02±10.26治疗组 118.08±14.36a 126.15±8.65a
2.3 ELISA检测结果 治疗前两组血清ET-1、NO及VEGF表达水平差异无统计学意义(P>0.05)。治疗8周后,2组ET-1水平均显著降低,NO、VEGF水平均显著升高,且治疗组血清ET-1水平低于模型组,NO、VEGF水平高于模型组,差异均有统计学意义(P<0.05)。见表2。
表2 2组血清ET-1、NO及VEGF水平比较(每组n=12
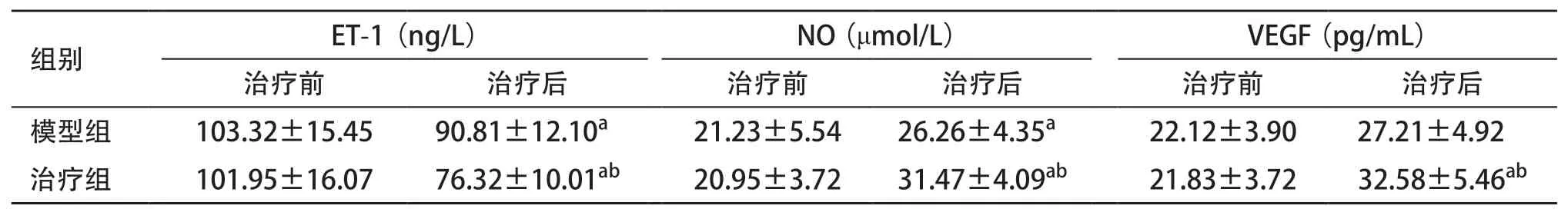
表2 2组血清ET-1、NO及VEGF水平比较(每组n=12
与组内治疗前比:aP <0.05;与模型组治疗后比:bP <0.05
组别 ET-1(ng/L) NO(μmol/L) VEGF(pg/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后模型组 103.32±15.45 90.81±12.10a 21.23±5.54 26.26±4.35a 22.12±3.90 27.21±4.92治疗组 101.95±16.07 76.32±10.01ab 20.95±3.72 31.47±4.09ab 21.83±3.72 32.58±5.46ab
3 讨论
目前,有关AS斑块形成机制的学说主要有:内皮损伤学说、脂质浸润学说、慢性炎症学说、平滑肌细胞增生学说、血栓源学说等[4-5],其中血管内皮损伤和脂质浸润被认为是导致AS的始动因素[6]。
AS疾病普遍存在内皮功能障碍[7]。研究表明,内皮细胞可通过释放血管活性物质如NO和ET-1等调控血管内皮细胞的功能[8]。NO是由NO合酶催化左旋精氨酸氧化生成,它不仅参与介导血管舒张,使平滑肌松弛,对血管有一定的保护作用,还能阻止血小板的聚集和黏附,具有显著的抗血栓形成作用。ET-1则正好相反,可以引起血管收缩,激活巨噬细胞,引起血小板聚集,损害血管内皮,促进平滑肌细胞增殖和迁移,促使AS的形成[9]。病理状态下,血管内皮功能出现紊乱,NO降低,并促进ET-1分泌,造成血管痉挛,诱导AS形成[10]。我们可以通过调节NO和ET平衡,维持血管内皮功能正常及结构完整,从起始环节干预AS斑块形成[11]。此外,VEGF可通过促进NO合成酶的生成,进而促进NO的生成,与NO共同作用发挥舒张血管的作用,促进新生血管的稳定和成熟,避免血栓形成,减轻AS发病程度[12]。由于VEGF在正常血管中基本无表达,而在AS斑块中表达显著增加,它能特异性地促进血管内皮修复与新生血管形成,促进AS斑块的形成,所以,VEGF在加速AS斑块形成过程中也具有重要作用。
目前研究认为,AS的发展过程与细胞外基质的降解、平滑肌细胞迁移和基质再生等密切相关[13]。MMP-9作为基质金属蛋白酶类中相对分子质量最大的酶,是降解IV、V型胶原最主要成员之一。胶原纤维的降解降低了内皮细胞基底膜的完整性,促使中膜平滑肌细胞向内膜迁移,在AS病变及斑块的破裂中发挥最关键性的作用[14]。PAI-1是一种丝氨酸蛋白酶抑制剂,在正常血管内皮细胞中合成。PAI-1可能通过影响血管内皮再生、平滑肌细胞迁移、动脉附壁血栓形成等环节参与AS的形成。当血管内皮细胞损伤时,血浆PAI-1等纤溶因子水平异常,启动和加速AS的发生发展[15]。
羟苯磺酸钙作为血管保护剂,已广泛应用于糖尿病肾病、慢性静脉功能不全、冠心病等的治疗[16-17]。研究证实[18],羟苯磺酸钙能通过减少内皮细胞中山梨醇的形成,减轻血管内皮的损伤,抑制血管活性物质及血小板的活化和聚集,降低毛细血管的通透性和脆性,从而对血管发挥一定的保护作用。
在本研究中,我们通过液氮冻伤术结合高脂饮食建立兔AS斑块模型,再以羟苯磺酸钙干预模型兔,结果表明,羟苯磺酸钙不仅能降低血循环中ET-1含量,升高NO、VEGF水平,还能减少血管壁局部组织中PAI-1和MMP-9蛋白的表达,说明羟苯磺酸钙可能从保护血管内皮、延缓动脉硬化及稳定粥样斑块等方面保护大血管。因此,羟苯磺酸钙能明显改善AS斑块形成的可能机制是减轻内皮细胞损伤,增加血管内皮细胞的密度,减少微血栓形成,进而阻止AS斑块的发生发展。
