宫颈癌细胞培养上清液诱导THP-1巨噬细胞M2表型
2020-06-11窦晓青温明晓朱迎萍张淑珍徐献丽许江燕
窦晓青,温明晓,朱迎萍,张淑珍,徐献丽,许江燕
(浙江中医药大学附属第一医院,浙江杭州310000,1.妇产科;2.检验科)
宫颈癌是发展中国家女性癌症第三大死亡原因[1]。虽然治疗宫颈癌的手术、肿瘤免疫治疗等多种方法已取得初步成果,但仍有部分患者存在复发风险,这与癌组织局部的肿瘤微环境密切相关。在宫颈癌的肿瘤微环境中,巨噬细胞占所有细胞比例高达30%~50%,预示其对于肿瘤发生发展的关键作用[2]。根据巨噬细胞表型可将其分为M1及M2型,其中M1型巨噬细胞发挥杀伤细胞内病原体、破坏肿瘤、促进Th1免疫反应的作用;而M2型巨噬细胞可通过表达血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)、程序性死亡配体1等促进肿瘤的发生发展,与癌症不良预后密切相关[3-4]。研究发现,宫颈癌组织中浸润的巨噬细胞以M2型为主,且宫颈癌可通过分泌IL-4、IL-10来促进巨噬细胞向M2极化[3],但这些细胞因子是否在诱导或维持M2巨噬细胞表型中发挥重要作用尚未明确。为此,本研究探讨宫颈癌细胞系(HeLa)培养上清液是否可诱导并维持THP-1巨噬细胞M2表型,以明确HeLa细胞培养上清液对THP-1巨噬细胞分化的影响。
1 材料和方法
1.1 材料 流式抗体CD206-FITC、CD163-FITC、HLA-DR-APC、STAT1-PE、pSTAT1-PE、STAT6-PE和pSTAT6-PE购自美国BioLegend公司;IL-2、IL-4、IL-6、IL-10 细胞因子检测试剂盒购于深圳达科为公司;HumanGrowthFactorPanelMulti-analyteFlowAssay试剂盒购自美国BioLegend公司;硝酸全氮/亚硝酸盐比色法试剂盒购自美国R&D公司。抗pSTAT6抗体购于美国BioLegend公司。
1.2 方法
1.2.1 HeLa细胞培养上清液收集及细胞因子检测:将HeLa细胞系以1×105个/孔接种于6孔板中,培养体系为DMEM的完全培养基(含10%的FBS,1%的双抗)。细胞培养至第3天时,收集细胞并离心收集上清液,分装后冻存于-80℃冰箱。使用深圳达科为公司的细胞因子检测试剂盒和美国BioLegend公司的HumanGrowthFactorPanelMulti-analyteFlowAssay试剂盒测定细胞因子和生长因子,操作按说明书进行。
1.2.2 实验分组及处理:实验分组:空白对照组(Mθ组)、M2细胞诱导组(M2组)、HeLa细胞培养上清液处理组(Mθ+sHeLa组)。THP-1细胞系以1×106个/孔接种于12孔板中,培养体系为RPMI-1640完全培养基(含10%的FBS,1%的双抗)。待细胞培养至对数生长期,收集THP-1并用无菌PBS洗涤3遍后进行如下处理。Mθ组:不做刺激处理的基础状态;M2组:20ng/mLIL-4、20ng/mLIL-10 处理3d;Mθ+sHeLa组:加入50%HeLa细胞培养上清液处理培养3d。
1.2.3 流式细胞术检测巨噬细胞CD163、CD206和HLA-DR的表达:离心收集1.2.2中的巨噬细胞并用PBS洗涤3 次,加入Fc受体阻断剂于37℃封闭阻断人Fc受体30min;PBS洗涤3次后,加入CD163-FITC、CD206-FITC或HLA-DR-APC抗体1mL,4℃孵育30min,PBS洗涤3次后,调整终体积至300mL,流式仪上机检测。
1.2.4 HeLa细胞培养上清液处理后的巨噬细胞产生细胞因子、生长因子、TGF-β3水平检测:用HeLa细胞培养上清液处理THP-1巨噬细胞3d后,500r/min离心收集细胞上清液。使用流式细胞术检测细胞因子和血管生成素-2(angiopoietin-2,ANG-2)、肝细胞生长因子(hepatocytegrowthfactor,HGF)、VEGF。利用Bio-PlexProTMTGF-β3-Plex试剂盒分析TGF-β3的产生。细胞因子、生长因子和TGF-β3浓度以pg/mL表示,以上操作均按说明书进行。
1.2.5 去除HeLa细胞培养上清液48h后THP-1巨噬细胞产生生长因子能力变化:为评估在去除HeLa细胞上清液后,巨噬细胞分泌细胞因子及生长因子情况。先用HeLa细胞培养上清液处理THP-1巨噬细胞3d,随后用新鲜的DMEM完全培养基替换HeLa细胞上清液后继续培养48h。最后,500r/min离心收集细胞上清液并检测细胞因子、生长因子、TGF-β3的浓度。
1.2.6 JAK-STAT6信号通路影响HeLa细胞培养上清液对THP-1的分化效果:离心收集并用PBS洗涤各组处理3d后的巨噬细胞,用破膜固定液于冰上处理细胞20min,随后用BD染色缓冲液洗涤细胞3次,最后加入STAT6-PE或pSTAT6-PE抗体1μL,4℃避光孵育30min。用PBS洗涤并重悬细胞后上机检测。使用FlowJo对结果进行分析,以平均荧光强度(meanfluorescenceintensity,MFI)展示实验结果。提取THP-1细胞蛋白,采用BCA法进行定量,SDS-PAGE电泳后电转移至硝酸纤维素膜,5%脱脂奶粉室温封闭1h,加入pSTAT6 一抗4℃孵育过夜,TBST洗膜3次,加入相应HRP标记的二抗室温孵育2h,滴加ECL发光,显影,使用ImageJ进行灰度分析。

图1 HeLa细胞培养基中细胞因子(A)及生长因子(B)的检测
1.3 统计学处理方法 采用GraphPad5软件进行数据分析。计量资料采用表示,多组比较采用单因素方差分析,采用Student’st 检验分析组间差异。P<0.05为差异有统计学意义。
2 结果
2.1 HeLa细胞分泌的细胞因子 HeLa细胞分泌的细胞因子如图1所示,HeLa分泌的代表性细胞因子(IL-4、IL-6、IL-10)及生长因子(ANG-2、HGF、VEGF)表达的水平。在细胞因子方面,HeLa细胞分泌IL-6较多;在生长因子方面,则以HGF、VEGF含量较多。见图1。
2.2 HeLa细胞培养上清液对巨噬细胞表面受体和转录因子表达的影响 为探讨HeLa细胞培养上清液对巨噬细胞极化的影响,用HeLa细胞培养上清液处理巨噬细胞3d后,收集细胞分析M1和M2表型表面受体的表达水平,结果见图2。与Mθ组比,M2组及Mθ+sHeLa组的M1型细胞极化相关的细胞表面标记物(HLA-DR)表达差异无统计学意义(P>0.05),而M2型细胞极化相关的细胞表面标记物(CD163和CD206)含量升高,差异有统计学意义(P<0.05)。
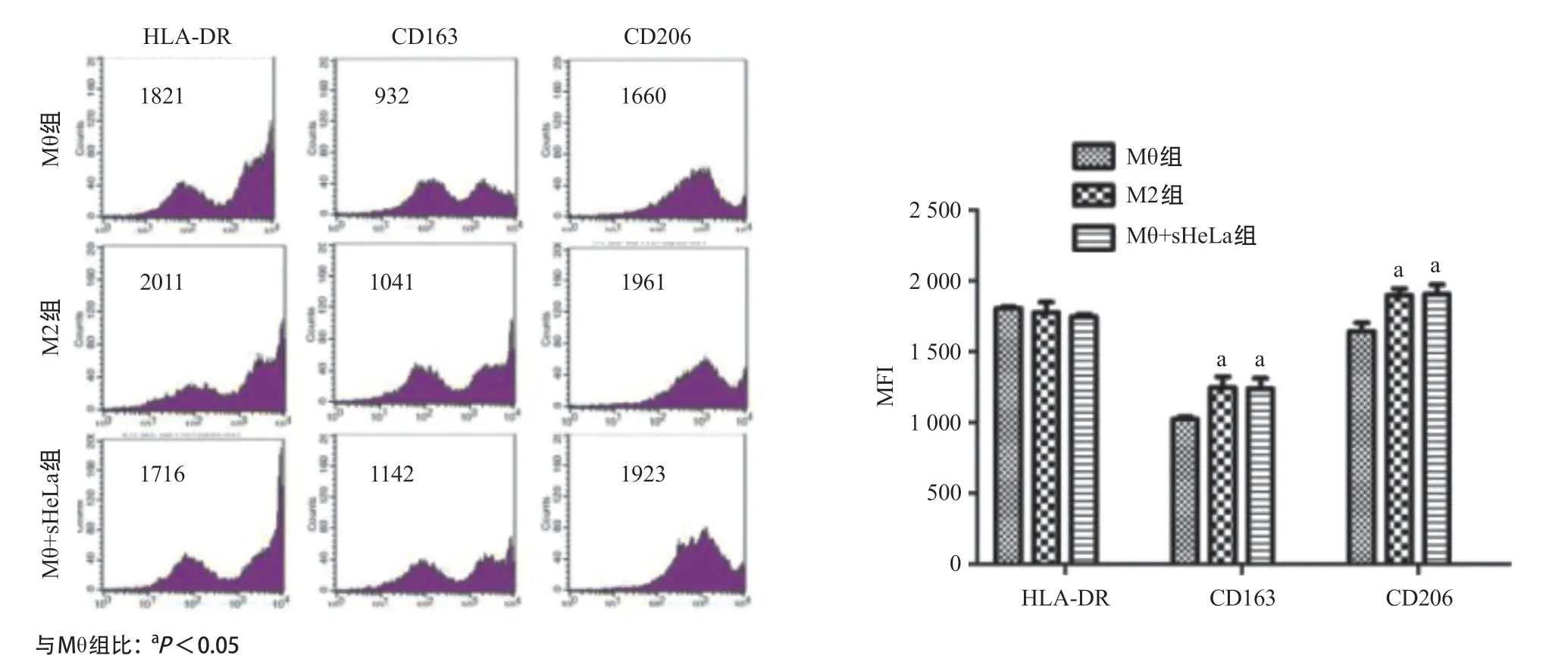
图2 HeLa细胞培养上清液处理的THP-1巨噬细胞膜受体HLA-DR、CD163和CD206的检测
2.3 HeLa细胞培养上清液处理后的巨噬细胞产生细胞因子、生长因子水平 为探讨HeLa细胞培养上清液对巨噬细胞释放细胞因子、生长因子的影响,用HeLa细胞培养上清液处理巨噬细胞3d,流式细胞术检测胞内细胞因子,收集细胞上清液检测生长因子水平,结果见图3。与Mθ组比,M2组及Mθ+sHeLa组细胞因子(IL-4、IL-6、IL-10)表达水平明显升高,差异有统计学意义(P<0.05)。与Mθ组比,M2组及Mθ+sHeLa组的HGF、ANG-2和VEGF明显升高,差异有统计学意义(P<0.05)。与Mθ组比,M2组及Mθ+sHeLa组的TGF-β3分泌增加,差异有统计学意义(P<0.05)。

图3 HeLa细胞培养上清液处理后的THP-1巨噬细胞分泌细胞因子、生长因子、TGF-β3水平的检测
2.4 去除HeLa细胞培养上清液48h后巨噬细胞细胞因子、生长因子及TGF-β3水平 与Mθ组比,去除HeLa细胞培养上清液48h的巨噬细胞(Mθ+sHeLasHeLa组)分泌IL-4、IL-6、IL-10、Ang-2、HGF、VEGF浓度增加(P<0.05);同时,与Mθ组比,Mθ+sHeLa-sHeLa组TGF-β3增加(P<0.05),见图4。

图4 去除HeLa细胞培养上清液48h后THP-1巨噬细胞中细胞因子、生长因子、TGF-β3蛋白水平
2.5 JAK-STAT6信号通路参与HeLa细胞培养上清液对M2型巨噬细胞的分化 M2型巨噬细胞极化相关转录因子(STAT6、pSTAT6)表达如图5所示,与Mθ组比,Mθ+sHeLa组的巨噬细胞pSTAT6表达水平明显升高,差异有统计学意义(P<0.05)。HeLa细胞培养上清液可通过激活JAK-STAT6信号通路诱导巨噬细胞向M2型分化。
3 讨论
浸润肿瘤组织中的巨噬细胞通常称为肿瘤相关的巨噬细胞,其对肿瘤的发展起重要作用。巨噬细胞可在不同条件的诱导下向M1或M2极化,其中M2表型巨噬细胞参与促进Th2免疫反应,并通过表达VEGF、TGF-β、吲哚胺2,3-双加氧酶、程序性死亡配体1促进肿瘤的发生,且M2巨噬细胞的存在与不良预后有关[2]。本研究初步分析宫颈癌细胞培养上清液相关生长及细胞因子水平,并探讨其对于巨噬细胞极化的影响。
肿瘤细胞所释放的细胞产物一方面促进血管生成、新陈代谢、肿瘤相关细胞募集和肿瘤增长[5-6];另一方面,它们也可诱导M2表型巨噬细胞,在维持免疫抑制微环境、促进血管生成和代谢方面发挥重要作用[7]。胃癌细胞通过释放的IL-4、IL-10、单核细胞集落刺激因子引起肿瘤相关巨噬细胞(tumorassociatedmacrophages,TAMs)向M2表型极化[8]。本研究发现HeLa细胞培养上清液中有高浓度的IL-6、IL-4、HGF、VEGF。细胞因子IL-6、IL-4被认为参与单核细胞分化成肿瘤相关巨噬细胞样细胞的过程中,同时也是诱导M2表型巨噬细胞的重要因子[9];VEGF和HGF一样具有较强的促血管生成作用,共同参与肿瘤的发生发展过程[10]。这表明,HeLa细胞上清液也一方面可通过释放IL-6、IL-4 等细胞因子诱导TAMs向M2表型极化,另一方面也可通过释放HGF、VEGF可通过促进血管生成、新陈代谢、肿瘤相关细胞募集和肿瘤生长。
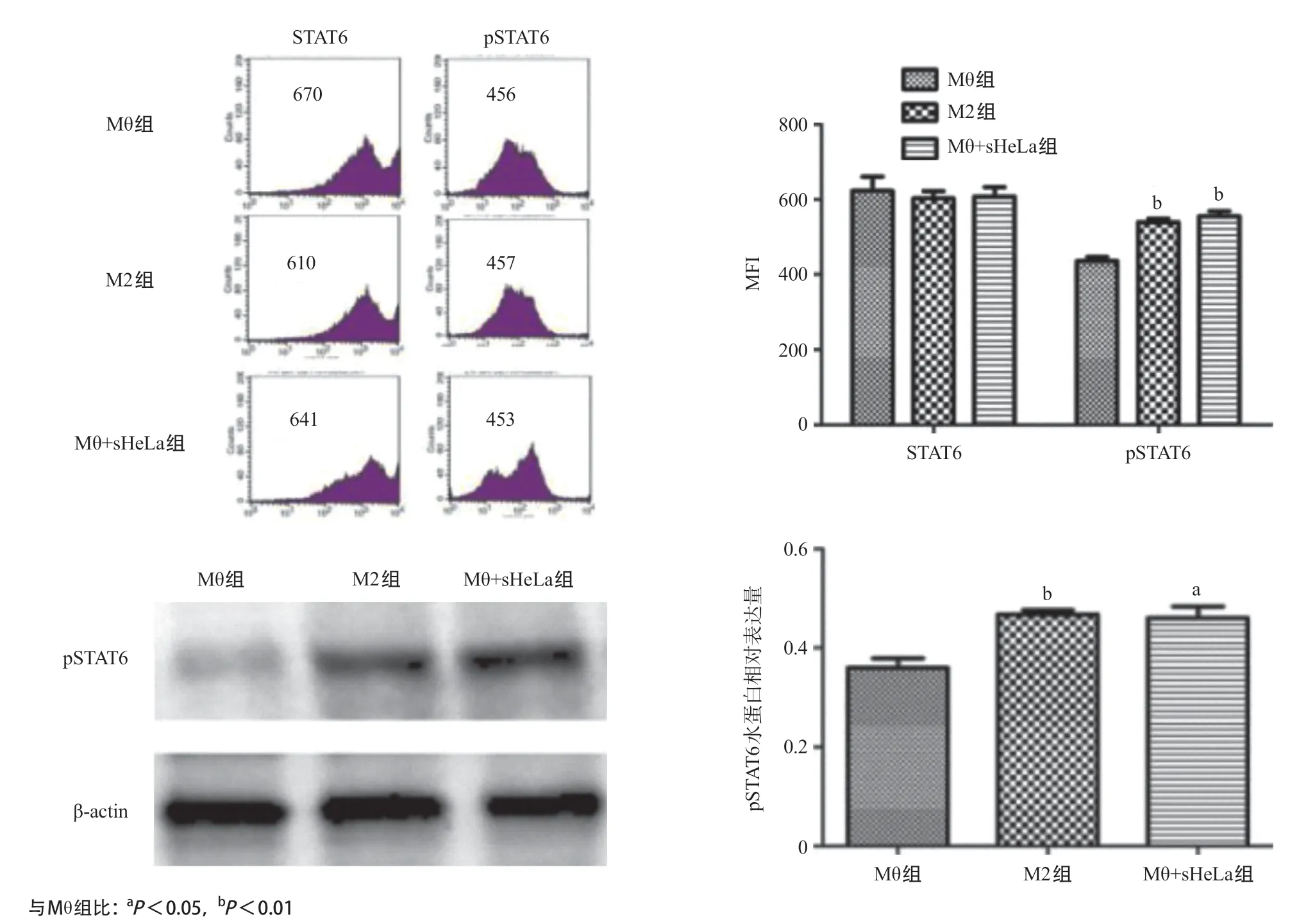
图5 流式细胞术及Westernblot检测巨噬细胞中pSTAT6水平
在本研究中,经HeLa细胞培养上清液处理后的M2巨噬细胞标记物的CD163、CD206表达上调,说明HeLa细胞培养上清液可诱导巨噬细胞向M2细胞极化。同时,HeLa细胞培养上清液处理后的巨噬细胞可释放大量ANG-2、HGF、VEGF。ANG-2作为M2表型的巨噬细胞分泌的代表性生长因子,可发挥促进肿瘤生长作用,它与HGF、VEGF一道通过不同方式促进肿瘤细胞生长。重要的是,在去除Hela细胞培养基48h后,巨噬细胞可持续高表达IL-4、IL-6、IL-10以及ANG-2、VEGF、HGF,这预示在切除肿瘤后,受到原先肿瘤局部微环境影响的M2型巨噬细胞可继续分泌相关细胞因子及生长因子来促进肿瘤复发。既往研究显示TGF-β3 的高表达可促进肿瘤发生发展,并且M2型巨噬细胞分泌的TGF-β3也可通过自分泌的形式作用于自身,进一步促进巨噬细胞向M2极化[7]。在黑色素瘤与乳腺癌中,TGF-β3 的高表达与病情加重及不良预后有关[11]。本研究同样发现经过Hela细胞培养上清液处理后的巨噬细胞释放TGF-β3水平升高,也提示其在宫颈癌中的重要作用。
JAK/STAT信号通路与由各种细胞因子诱导的各种生物学应答有关,在非受体型JAK的作用下,转录因子STAT磷酸化并发生二聚化,磷酸化的STAT转位至核内,激活相关基因表达;转录因子STAT分为多种亚型,其中STAT6与M2相关特异性基因表达有关,研究发现IL-4等细胞因子可通过激活JAK/STAT6途径调节巨噬细胞M2的极化[12]。本研究也发现HeLa细胞培养上清液处理后的巨噬细胞中磷酸化STAT6水平增加。由于HeLa细胞培养上清液存在IL-4等多种细胞因子,因此可以推测HeLa细胞是通过释放相关细胞因子来激活JAK/STAT6途径,进而导致巨噬细胞向M2极化。
本研究也存在不足,首先本研究采用Hela细胞系,和真实肿瘤细胞存在差异;其次,HeLa细胞系及巨噬细胞可分泌诸多细胞产物,而本研究仅检测少数几种与M2巨噬细胞极化有关的细胞因子及生长因子,其余细胞产物的作用还需后续深入研究。
综上所述,HeLa细胞培养上清液可诱导巨噬细胞向M2表型的极化,参与肿瘤的生长和血管生成。
