1, 25-二羟维生素D3对软脂酸诱导的胰岛素抵抗血管内皮细胞功能的影响
2020-06-11王靓董思思陈婧吴笑英阮璐雅潘优津胡云良郑超
王靓,董思思,陈婧,吴笑英,阮璐雅,潘优津,胡云良,郑超
(1.温州医科大学附属第二医院内分泌代谢科,浙江温州325027;2.临沂市妇女儿童医院检验科,山东临沂276000;3.温州医科大学附属第二医院检验科,浙江温州325027)
1,25-二羟维生素D3[1, 25(OH)2D3]作为维生素D最重要的活化形式,通过与体内一种特异性核受体,即VitD受体(VDR)结合而起作用。研究表明,1, 25(OH)2D3能调控体内钙磷代谢以维护骨健康,低血清1, 25(OH)2D3水平与内皮细胞功能障碍、动脉粥样硬化、心血管疾病(包括高血压、冠状动脉疾病、缺血性心脏病、心力衰竭)的风险增加和胰岛素抵抗相关[1-4]。但目前鲜见1, 25(OH)2D3对软脂酸(palmiticacid,PA)所诱导的胰岛素抵抗的血管内皮细胞功能障碍作用的机制研究。本研究探讨1, 25(OH)2D3是否通过激活胰岛素抵抗的血管内皮细胞的Akt/eNOS信号通路促进产生NO,影响内皮素1(endothelin-1,ET-1)的表达,从而减轻血管内皮细胞的损伤。
1 材料和方法
1.1 材料
1.1.1 细胞和试剂:人脐静脉内皮细胞(humanumbilicalveinendothelialcells,HUVECs)购自中国科学院细胞库。骨化三醇注射液购于德国APPPharmaceuticals公司,棕榈酸及BSA(FAFBSA)购于美国Sigma公司。DMEM培养基、0.25%胰酶-EDTA购于美国Gibco公司。兔peNOS(Ser1177)抗体购于美国CellSignaling公司,鼠pAkt(Ser473)抗体、鼠单克隆GAPDH抗体购于美国BioworldTechnology公司。CCK-8试剂盒购于日本同仁化学研究所,葡萄糖检测试剂盒购于北京普利莱公司,硝酸盐/亚硝酸盐荧光检测用试剂盒购于美国Cayman公司,ET-1以及VDR引物购于上海生工生物工程有限公司。
1.1.2 仪器:荧光显微镜、多功能酶标仪、二氧化碳孵箱、化学发光凝胶成像系统、恒温水浴箱、LightCycle480分析仪、冷冻离心机、PCR仪、MiniVE垂直电泳系统、倒置显微镜。
1.2 方法
1.2.1 分组:将HUVECs设置为对照组、PA组、VD组。其中对照组为仅DMEM培养基培养的未干预HUVECs。PA组为最佳浓度0.6mmol/LPA诱导的HUVECs,即胰岛素抵抗血管内皮细胞模型。VD组为最佳浓度1nmol/L1, 25(OH)2D3干预后的上述胰岛素抵抗血管内皮细胞模型,据干预时间分为VD0.5h组、VD1h组、VD2h组、VD4h组、VD8h组、VD16h组。
1.2.2 细胞培养:HUVECs培养于DMEM高糖培养基(含10%的胎牛血清、1%青霉素/链霉素)中,并置于含5%CO2,相对湿度为95%的37℃恒温培养箱中培养,选取处于对数生长期的内皮细胞,用于后续实验。
1.2.3 胰岛素抵抗血管内皮细胞模型的建立:HUVECs细胞接种到96孔板中(每孔的体积为100μL),培养于恒温培养箱中。待贴壁稳定生长后,加入不同浓度(0.3、0.4、0.5、0.6、0.7、0.8、0.9mmol/L)的PA培养液继续培养18h。CCK-8试剂盒检测细胞增殖活力:每孔加CCK-8溶液继续孵育1.5h,测定各孔450nm处的OD值。对照组只加CCK-8溶液,每组设置5个复孔。培养基中葡萄糖含量的检测:蒸馏水稀释葡萄糖标准品(10mmol/L),分别为125、250、500、1000μmol/L。按照空白管(蒸馏水5μL+工作溶液195μL)、标准管(标准品5μL+工作溶液195μL)、测定管(样本5μL+工作溶液195μL)加样。孵育37℃20min之后测定570nm处的OD值。计算各样品的葡萄糖浓度。用各组细胞的葡萄糖消耗量反映胰岛素抵抗的程度。据测得的相对细胞增殖活力及葡萄糖消耗量确定最佳PA浓度培养的胰岛素抵抗内皮细胞模型,为后续实验的PA组。
1.2.4 Westernblot法测定pAkt及peNOS蛋白表达:最佳PA浓度培养的胰岛素抵抗内皮细胞模型(PA组),加入含0.01、0.1、1、10、100nmol/L1, 25(OH)2D3作用1h,随后弃去培养基,PBS清洗后加入细胞裂解液,在冰上裂解细胞,提取细胞总蛋白,用BCA试剂盒测定相应的蛋白浓度。用样品缓冲液配平蛋白样品,煮沸法使蛋白变性。SDS-PAGE胶电泳分离不同分子量的蛋白,转膜至PVDF膜上,含5%脱脂奶粉的TBST室温下摇床封闭2h,加入兔peNOS、pAkt抗体作为特异性一抗,室温孵育2h,TBST洗膜后以相应的抗兔或抗鼠IgG作为二抗室温摇床孵育2h,TBST洗膜后曝光显影,对目的条带进行半定量分析,测得pAkt及peNOS蛋白的表达量,据结果确定1, 25(OH)2D3最佳干预浓度。
1.2.5 NO分泌的检测:最佳浓度1, 25(OH)2D3干预细胞模型不同时间(15、30、60、120、240、480s),根据NO检测试剂盒说明书检测对照组、PA组、VD组NO浓度。将硝酸盐标准品依次稀释,按照空白孔(硝酸盐分析缓冲液80μL),标准孔(缓冲液30μL+标准品50μL),待测样品孔(缓冲液60μL+样品20μL)加样,之后每个孔依次加入10μL硝酸还原酶的辅因子和10μL硝酸盐还原酶。加入10μLDAN试剂后继续孵育10min,加入20μLNaOH,测量各孔荧光值(激发波长360nm,发射波长430nm),根据所得标准曲线计算样品的实际浓度,获得各时段NO浓度。
1.2.6 实时荧光定量PCR检测ET-1mRNA、VDRmRNA的相对表达量:1nmol/L1, 25(OH)2D3干预胰岛素抵抗内皮细胞,分别于0.5、1、2、4、8、16h时检测。①总RNA提取,弃去培养基后,无菌PBS洗涤细胞,加入1mLTRIzol冰上充分裂解后转移至去酶的EP管。加入0.2mL氯仿,振荡、冰上静置,4℃12000r/min离心15min,吸取无色上清液移入去酶EP管,加入等量异丙醇,颠倒混匀、冰上静置,4℃12000r/min离心10min。去除异丙醇上清液,加入75%乙醇1mL,颠倒混匀,4℃7500r/min离心5min重复2 次,弃去上清液,通风干燥5~10min待乙醇挥发,加入30μLDEPC水使沉淀完全溶解,测定RNA的浓度。②严格按照二步法反转录试剂盒说明书合成cDNA。③Real-TimePCR反应,模板cDNA2μL,SYBRGreen10μL,灭菌蒸馏水6μL,上、下游引物各1μL混匀,注意避免气泡产生,按照91℃1min,94℃40s,65℃40s,72℃1min,72℃1min,重复35 个循环。以GAPDH作为内参进行结果分析,计算出相应mRNA的表达量。
1.3 统计学处理方法 采用SPSS18.0软件行统计学分析。计量资料以表示,多组间的比较采用单因素方差分析,方差齐性采用LSD检验,方差不齐采用Dunnett’sT3检验。P<0.05为差异有统计学意义。
2 结果
2.1 PA干预HUVECs后细胞活力下降,细胞外葡萄糖消耗减少 CCK-8法检测结果显示,在PA浓度为0.4~0.9mmol/L时,HUVECs活力逐渐下降,并且呈浓度梯度依赖性(见图1)。与对照组相比,PA(0.3~0.9mmol/L)处理后,HUVECs细胞外的葡萄糖消耗量显著降低,并且在PA浓度为0.6mmol/L时,葡萄糖消耗量最少(见图2)。结合细胞增殖活性以及葡萄糖消耗量的实验结果,本研究选定PA浓度为0.6mmol/L建立胰岛素抵抗血管内皮细胞模型。
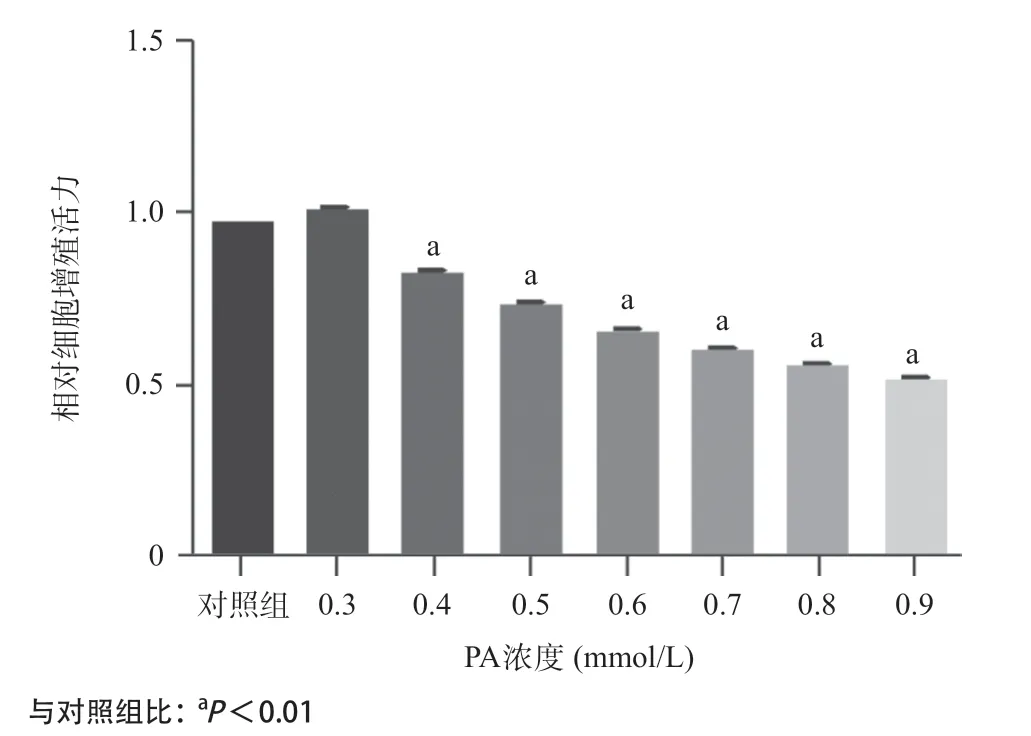
图1 不同浓度PA作用的HUVECs相对细胞增殖活力

图2 不同浓度PA作用的HUVECs细胞外葡萄糖消耗量
2.2 1, 25(OH)2D3能够增加胰岛素抵抗血管内皮细胞peNOS、pAkt的蛋白表达水平 如图3-4所示,0.01、0.1、1、10、100nmol/L1, 25(OH)2D3分别干预胰岛素抵抗细胞模型(即最佳浓度0.6mmol/LPA处理后的细胞模型)1h后,Westernblot结果显示peNOS、pAkt的蛋白表达量增加,并且在1nmol/L时表达量达到最高(P <0.05)。提示1nmol/L1, 25(OH)2D3可以上调peNOS、pAkt蛋白水平的表达,激活Akt/eNOS通路。
2.3 1, 25(OH)2D3逆转胰岛素抵抗血管内皮细胞的NO含量下降 如图5所示,1nmol/L1, 25(OH)2D3刺激胰岛素抵抗内皮细胞NO产生,随着1, 25(OH)2D3作用时间延长,NO浓度升高,在60s时浓度最高,与PA组比较差异有统计学意义(P<0.01),但是随着作用时间进一步增加,NO浓度迅速下降,在120s时达到最低后逐渐轻度上升。

图3 不同浓度1, 25(OH)2D3干预的胰岛素抵抗内皮细胞模型peNOS相对表达量
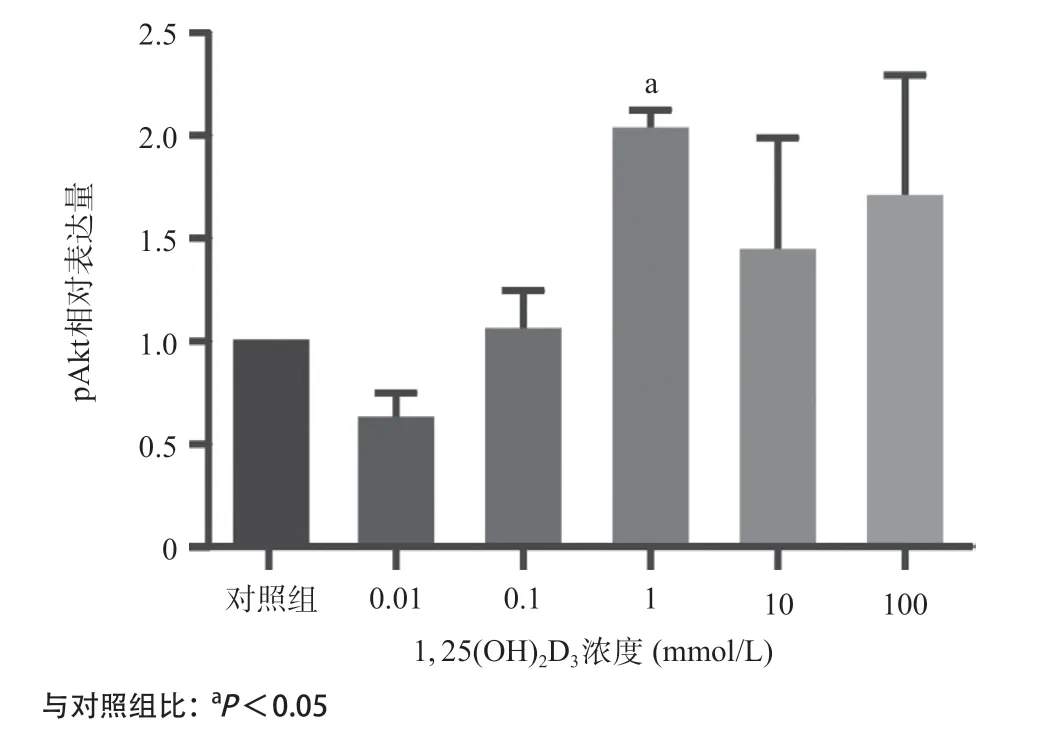
图4 不同浓度1, 25(OH)2D3干预的胰岛素抵抗内皮细胞模型pAkt相对表达量
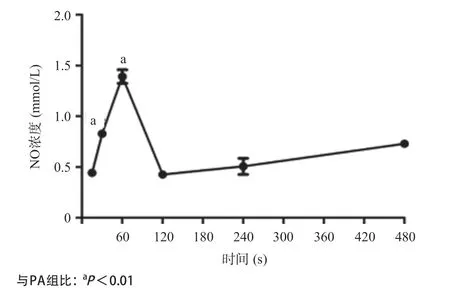
图5 1nmol/L1, 25(OH)2D3干预后VD组NO浓度
如图6所示,PA组较对照组细胞NO浓度下降(P<0.01),1, 25(OH)2D3干预60s后NO浓度显著增加,与PA组比较,差异有统计学意义(P<0.01)。
2.4 1, 25(OH)2D3减少胰岛素抵抗血管内皮细胞ET-1和VDRmRNA相对表达量 如图7所示,PA组ET-1mRNA相对表达量显著升高,与对照组比较差异有统计学意义(P<0.01)。VD组ET-1mRNA的相对表达量较PA组显著下降(P<0.01),随着VD干预时间的延长,ET-1mRNA相对表达量逐渐降低。1, 25(OH)2D3处理后,与PA组相比,各个时间点的VDRmRNA的表达差异无统计学意义(见图8)。

图6 对照组、PA组、VD组NO浓度比较

图7 对照组、PA组、VD不同时间组ET-1mRNA相对表达量

图8 对照组、PA组、VD不同时间组VDRmRNA相对表达量
3 讨论
胰岛素所调控的微血管开放功能障碍是早期胰岛素抵抗的重要病理机制之一[1]。研究发现,肥胖的2型糖尿病患者往往在病程初期阶段存在骨骼肌中微血管开放总面积的下降[2]。微血管开放功能主要与各组织器官的血管内皮细胞的舒张功能有关。胰岛素可以调控血管的舒张,这与调节NO的释放有关。胰岛素抵抗的肥胖个体通常伴有血管内皮舒张功能的受损。已有研究证明,1, 25(OH)2D3可通过钙离子内流影响内皮细胞的收缩[3]。内皮细胞存在有VDR,与维生素D相结合后可激活调节血管内皮生长中的反应元件因子(vegf)启动子并影响钙离子内流[4]。MOLINARI等[5]发现VDR与1, 25(OH)2D3相互作用可引起Akt、ERK和P38的磷酸化,从而活化eNOS,使内皮细胞NO量显著增加。但1, 25(OH)2D3对胰岛素抵抗的血管内皮细胞作用机制尚不明确。本研究观察到1nmol/L1, 25(OH)2D3刺激胰岛素抵抗内皮细胞NO产生,随着1, 25(OH)2D3作用时间延长,NO浓度升高,在60s时浓度最高。我们的研究结果与以往的研究结果有一致性,1, 25(OH)2D3不仅促进培养的人脐静脉内皮细胞产生NO,同时对PA诱导的功能受损的血管内皮细胞也有相同的作用,这可能是一个潜在的维生素D改善血管内皮细胞胰岛素抵抗的机制。
维生素D改善血管内皮功能可能的机制与激活PI3K-Akt-eNOS通路和下调ET-1有关。ALVAREZ等[6]发现,游离脂肪酸可以导致内皮功能受损、NO水平下降以及氧化应激增强。游离脂肪酸诱导凋亡的机制与eNOS和Akt磷酸化水平降低以及caspase-9的活性增强相关。国内有学者采用棕榈酸诱导内皮细胞损伤,从细胞层面上观察黄芪多糖对AMPK、Akt、eNOS及Nox4蛋白活性表达以及细胞内NO含量的影响,探索其改善血管内皮功能障碍、保护内皮细胞损伤的可能机制[7]。本研究发现,在0.4~0.9mmol/L范围内,PA可抑制HUVECs活力,并呈浓度依赖性。研究还发现,PA组与对照组比较,NO浓度下降,而1nmmol/L的1, 25(OH)2D3能够上调eNOS和Akt的磷酸化水平,增加NO产生,从而改善PA诱导的血管内皮细胞的功能障碍。
ET-1是最强效的内源性血管收缩剂之一。有研究表明,2型糖尿病患者微血管内皮细胞中的ET-1表达量较正常人有所增加[8]。游离脂肪酸能够增强胰岛素诱导的ET-1的释放[9]。在本实验中,PA组血管内皮细胞ET-1mRNA表达显著增加,与对照组相比差异有统计学意义(P<0.01),而1nmmol/L的1, 25(OH)2D3干预后,ET-1mRNA的相对表达量较PA组显著下降,且随着干预时间的延长,ET-1mRNA相对表达量逐渐降低,VD干预各组与PA组比较差异均有统计学意义(P<0.01)。因此推测1, 25(OH)2D3降低PA诱导的ET-1mRNA的表达可能是改善内皮细胞胰岛素抵抗的因素之一。本研究还发现,1, 25(OH)2D3作用后VDRmRNA的表达与PA干预组相比差异无统计学意义,这可能是因为1, 25(OH)2D3激活PI3K/Akt/eNOS通路,并不影响VDR的数量。
综上所述,本研究通过建立PA诱导的胰岛素抵抗血管内皮细胞模型,用不同浓度1, 25(OH)2D3干预,发现1nmol/L1, 25(OH)2D3可以增加peNOS、pAkt蛋白的表达,促进NO的产生,并且下调ET-1mRNA的表达,从而改善PA诱导的胰岛素抵抗血管内皮细胞功能障碍。
